hIAPP 与麦芽糖结合蛋白的融合表达、纯化和鉴定
尚金召,王雪芹,熊聿力,路福平,刘夫锋
(食品营养与安全国家重点实验室,工业发酵微生物教育部重点实验室,工业酶国家工程实验室, 天津科技大学生物工程学院,天津 300457)
淀粉样蛋白聚集成不溶性的淀粉纤维可导致各种疾病,例如淀粉样β-蛋白质(Aβ)在大脑细胞外聚集形成淀粉样斑块是阿尔茨海默症的病理特征[1-2]、α-突触核蛋白(alpha-synuclein)聚集形成的路易小体是帕金森病理特征[3]和人胰岛淀粉样多肽(hIAPP)的聚集体导致胰岛内β 细胞功能障碍和凋亡进而引起2 型糖尿病[4-5].2017 年全世界约有4.25 亿糖尿病患者,预计到2035 年,糖尿病患病人数将增长55%,远超6 亿[6].因此,探索该疾病的致病机理和寻找治疗2 型糖尿病的药物成为研究热点.
2 型糖尿病患者胰岛组织内含有大量的人胰岛淀粉样多肽(hIAPP)的聚集体[7].hIAPP 含37 个氨基酸[8],相对分子质量约为3.9×103.hIAPP 是由人胰岛β 细胞合成并分泌的[9].生理状态下的hIAPP 可以协同胰岛素等血糖调节激素对人体血糖进行更精准的调节[10].由于hIAPP 氨基酸残基极易发生构象转换形成分子β-折叠结构,并进一步聚集形成各种有毒的聚集体[11];研究结果[12-13]表明,hIAPP 的聚集是引起2 型糖尿病的主要原因,因此开发hIAPP 的聚集抑制剂就成为攻克2 型糖尿病的研究热点.尽管目前对hIAPP 纤维化过程取得了一些研究成果,但很多关于这些聚集体的大小、结构、形态以及与细胞毒性之间的关系等方面目前仍存在很多未知的问题.
实验过程中所用的hIAPP 主要通过固相化学合成法制备[14-16].虽然该方法高效、快速、价格低廉,但固相合成过程中残留的氨基酸或多肽片段会严重影响hIAPP 的聚集和毒理特性[17].由于hIAPP 存在高疏水性和易于聚集的特性且活体组织中含量极低,很难从胰岛B 细胞组织中大量提取和纯化.虽已有一些研究组利用融合表达纯化获得重组hIAPP[18],但存在表达量低和分离纯化困难等缺点.利用分子生物学和基因工程等技术表达生产hIAPP,可能成为获取该蛋白质的主要手段.利用几丁质结合域蛋白与hIAPP 融合在大肠杆菌中表达[19],其缺陷是很难保证hIAPP 氨基酸序列N 端的完整性.
为了克服以上缺陷,本研究采用麦芽糖结合蛋白(maltose binding protein,MBP)与hIAPP 融合表达获得高纯度具有原始氨基酸序列的hIAPP.MBP 作为常用的蛋白融合标签具有能够提高目标蛋白高效可溶性表达的功能,因此利用具有该标签的表达载体pMAL-c2x 可实现疏水性蛋白的大量可溶性表达.MBP 标签已用于一些疏水性蛋白质的重组表达.例如,本研究室将淀粉样β-蛋白质(Aβ)与MBP融合表达,获得高纯度的Aβ42[20].采用直链淀粉树脂可特异性亲和层析纯化以MBP 为融合标签的目标蛋白,一步纯化的纯度可达到70%~90%[21].融合标签MBP 的相对分子质量约为4.2×104,由大肠杆菌(E.coli)K12 的malE 基因编码.一般将MBP 融合表达在蛋白的N 端或C 端,可大大增加融合蛋白的溶解性.为了提高酶切效率,在融合蛋白与目标蛋白之间添加一些连接片段和蛋白酶切位点,如凝血酶、凝血因子Xa、肠激酶和烟草蚀纹病毒蛋白酶(rTEV)[22]等.最后用位点专一的蛋白酶切割MBP 标签,从而获得目标蛋白.本研究采用MBP 为融合蛋白标签,MBP 与hIAPP 之间添加刚性且可溶性较强的蛋白片段[23],并用改进的rTEV 切除MBP 标签,最后利用Genshare CFAS any KD PAGE 蛋白胶电泳和MALDI TOF 鉴定获得的hIAPP.本研究旨在能为以研究hIAPP 的体外聚集来开发2 型糖尿病药物提供原料,以及为其他疏水性或有毒性蛋白及多肽在大肠杆菌中的表达提供思路.
1 材料与方法
1.1 材料
大肠杆菌(E.coli)JM109、大肠杆菌(E.coli) BL21(DE3)和原核表达载体pMAL-c2x 保存于本实验室.该原核表达载体上含有MBP 蛋白质的基因malE.
高保真Pyrobest DNA 聚合酶、Solution 连接酶和限制性内切酶EcoRⅠ、HindⅢ,宝生物工程(大连)有限公司;质粒提取试剂盒和rTEV 蛋白酶(重组型),北京索来宝科技有限公司;蛋白纯化重力柱、直链淀粉树脂,英国 New England Biolabs 公司;Genshare CFAS any KD PAGE 蛋白电泳凝胶制备试剂盒,西安晶彩生物科技有限公司;其他常见化学试剂均为分析纯,北京奥博星生物技术有限责任公司.
1.2 方法
1.2.1 引物合成以及融合表达载体和工程菌的构建
根据NCBI 中hIAPP(GenBank:ADD13605.1)多肽氨基酸序列,密码子优化[24]为偏好大肠杆菌表达的DNA 序列.为了获得具有原始氨基酸序列的hIAPP,基因合成过程中在hIAPP 基因的上游添加了蛋白片段(NANP)3和TEV 蛋白酶识别位点的基因序列即(NANP)3-TEV-hIAPP.(NANP)3-TEV-hIAPP基因合成及测序由苏州金唯智公司合成.引物由深圳华大基因合成.
hIAPP 的DNA 序列以pUC57-hIAPP 形式合成,用EcoRⅠ和HindⅢ将目的片段从该质粒上切下,凝胶回收酶切产物 hIAPP,与具有相同黏性末端的pMAL-c2x 载体16 ℃连接4 h;转化JM109 大肠杆菌感受态细胞,37 ℃培养12 h;挑取阳性转化子进行菌落PCR 验证,并提取质粒送至基因公司进行测序鉴定.将鉴定正确的质粒命名为pMAL-hIAPP.
测序正确的质粒转化到表达宿主E.coli BL21 (DE3)中,菌落通过PCR 验证.将验证正确的菌株命名为BL21-pMAL-hIAPP.
1.2.2 MBP-hIAPP 融合表达纯化和表达条件优化
将构建好的工程菌BL21-pMAL-hIAPP 挑取单菌落接种于5 mL LB 试管(氨苄青霉素抗性终质量浓度为50µg/mL);培养12 h 后取1 mL(2%的接种量)转接到50 mL LB 培养基中(氨苄青霉素抗性终质量浓度为50µg/mL),37 ℃培养至菌体浓度达到A600=0.4~0.8,加诱导剂IPTG至终浓度为0.5mmol/L[25-26].诱导发酵后离心收集菌体,用20 mL MBP 结合缓冲液(20 mmol/L Tris-HCl,pH 7.4,200 mmol/L NaCl,1 mmol/L EDTA,1 mmol/L DTT)重悬菌体,加入1%蛋白酶抑制剂PMSF,冰浴30 min;250 W 超声破碎20 min,12 000 r/min 离心30 min 后收集上清液.上清液过0.22µm 除菌膜后加入到直链淀粉树脂,结合30 min 后层析柱上样,用15 倍柱体积的洗涤缓冲液(20 mmol/L Tris-HCl,pH 7.4,200 mmol/L NaCl,1 mmol/L EDTA,1 mmol/L DTT)洗涤柱子,最后用10 倍柱体积的洗脱缓冲液(20 mmol/L Tris-HCl,pH 7.4,200 mmol/L NaCl,1 mmol/L EDTA,1 mmol/L DTT,20 mmol/L 麦芽糖)洗脱,洗脱液4 ℃保存.
接种工程菌BL21-pMAL-MBP-hIAPP 于5 mL LB 试管,并培养过夜.转接种子液后,37 ℃培养菌体浓度 A600=0.4 ~0.8,加入终浓度 0.5 mmol/L IPTG,分别于13 ℃和16 ℃诱导培养32 h 和16 h 后收集菌体,通过直链淀粉树脂纯化融合蛋白MBPhIAPP,用20 mmol/L 麦芽糖溶出目的蛋白.取不同诱导条件下纯化后的融合蛋白,加 5µL 蛋白loading,煮沸10 min,通过SDS-PAGE 电泳分析诱导结果.
1.2.3 MBP-hIAPP 融合蛋白的酶切
根据rTEV 蛋白酶使用说明书,取1 mg 上述纯化的融合蛋白,加入4 μL 250×buffer,2.4 μL TEV酶,用缓冲液(50 mmol/L NaH2PO4,150 mmol/L NaCl,pH 8.0)补足至1 mL,置于16 ℃酶切反应,取6、12 h 酶切产物分别进行12% SDS-PAGE 分析.
1.2.4 尺寸排阻色谱(SEC)纯化酶切产物
MBP-hIAPP 融合蛋白经rTEV 酶切反应6 h 后,将反应产物浓缩至500 μL,过0.22 μm 滤膜后进样.采用GE 公司的凝胶过滤层析柱Superdex 200,柱体积 30 mL,流动相为 20 mmol/L Tris-HCl、150 mmol/L NaCl 和1 mmol/L DTT.根据出峰位置收集相应的产物,冻干纯化产物,-80 ℃保存[27].
1.2.5 Genshare CFAS any KD PAGE 蛋白胶电泳分析与MALDI-TOF 质谱鉴定
根据Genshare CFAS any KD PAGE 蛋白电泳凝胶制备试剂盒的使用说明书制备蛋白电泳凝胶.取20µL hIAPP 样品,加5µL 非变性PAGE 蛋白上样缓冲液.使用超低相对分子质量蛋白marker,相对分子质量范围为3.3×103~2.01×104,使用前煮沸5~10 min.SDS-PAGE 电泳时采用120 V 电压,制备的样品和超低相对分子质量蛋白marker 上样量均为10µL,电泳至蛋白loading 到凝胶板底部结束.
通过凝胶过滤层析得到的高纯度多肽hIAPP 溶液作为样品,将样品hIAPP 溶液与多肽基质(HCCA)按照体积 1﹕1 的比例混合,采用 H+模式通过MALDI-TOF 质谱进行相对分子质量鉴定.
2 结果与分析
2.1 MBP-hIAPP融合蛋白表达载体及工程菌的构建
基于hIAPP 的氨基酸序列和TEV 酶切机理设计并构建了MBP-hIAPP 融合蛋白表达载体,如图1(a)所示.
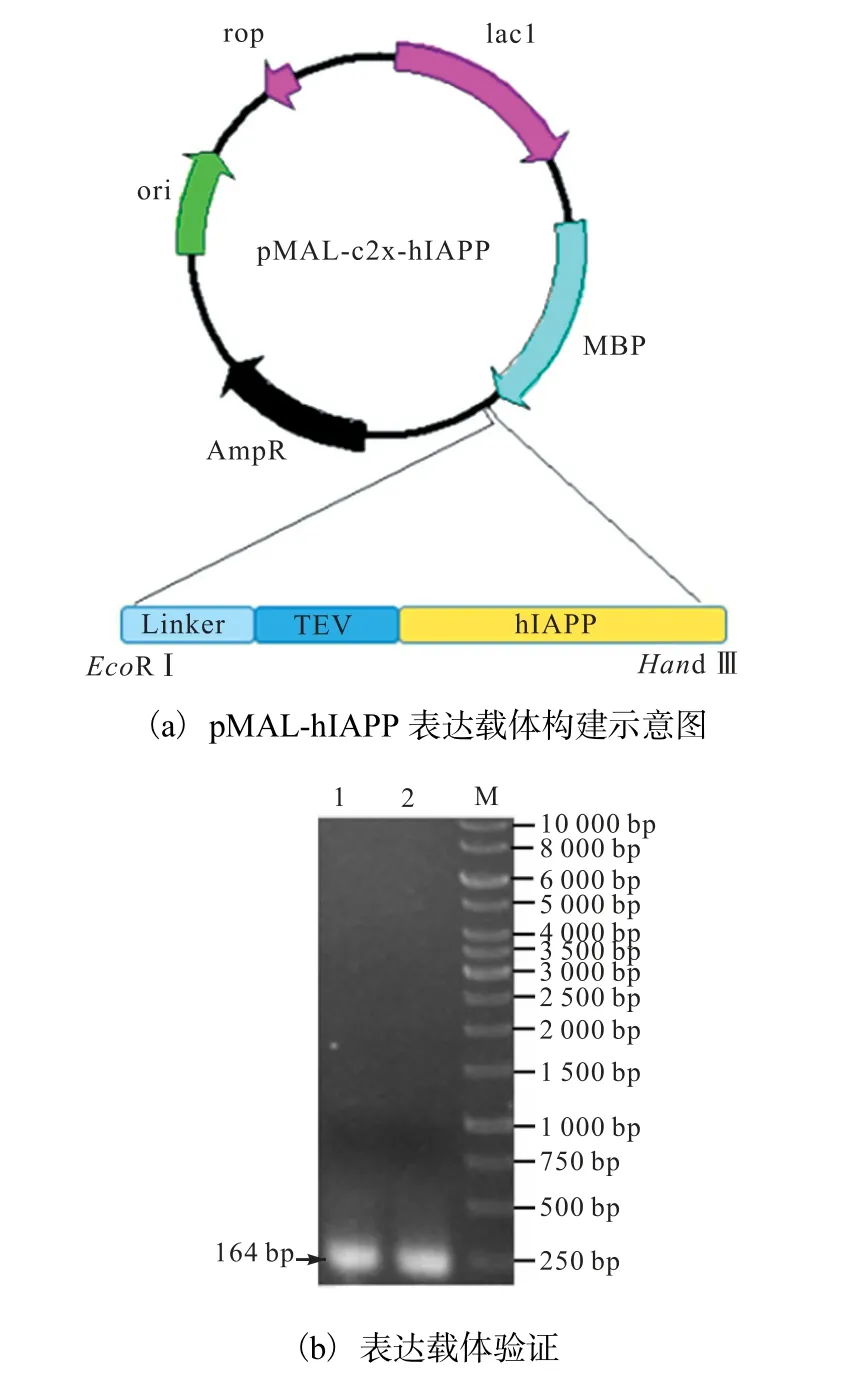
M.1 kbp marker;1—2.pMAL-hIAPP 转化大肠杆菌BL21 阳性转化子为模板的PCR 验证
为了提高酶切效率,在hIAPP 序列前加入既有刚性且可溶的蛋白片段(NANP)3.根据大肠杆菌密码子偏好性进行密码子优化,获得目的DNA 序列 (NANP)3-TEV-hIAPP 为 AATGCCAATCCGAACG CCAACCCGAATGCCAACCCGATTGAAGGCCGCA AATGCAACACCGCAACCTGTGCCACCCAGCGTC TGGCCAACTTTCTGGTGCACAGCAGCAACAACT TTGGCGCCATTCTGAGCAGCACCAATGTGGGCA GCAATACCTAT,优化后的基因由苏州金维智公司合成.
用EcoRⅠ和HindⅢ双酶切含目的片段的质粒pUC57-hIAPP,并将其克隆到含有相同黏性末端的表达载体pMAL-c2x 连接,并转化到大肠杆菌JM109. 转化后过夜培养,挑取单菌落培养后进行双酶切验证,验证正确的质粒送金维智公司测序,测序正确的表达载体命名为pMAL-hIAPP.
将表达载体pMAL-hIAPP 转化到大肠杆菌表达宿主E.coli BL21(DE3)中,经菌落PCR 验证(上游引物(EcoRⅠ)NANP-hIAPP-F:CGGAATTCAATGC CAATCCGAATGCCA;下游引物(HindⅢ)hIAPP-R: CCAAGCTTTTAGGCAATCACCACGCC),PCR 产物的琼脂糖凝胶电泳结果如图1(b)所示,PCR 产物琼脂糖凝胶电泳目的条带大小约为120 bp,与hIAPP基因大小一致,验证正确的菌株命名为BL21-pMALhIAPP.
2.2 MBP-hIAPP融合蛋白纯化及表达条件优化
构建好的工程菌BL21-pMAL-hIAPP 经IPTG 诱导发酵后收集细胞,超声破碎分别取上清液和沉淀进行SDS-PAGE 凝胶电泳,结果如图2 所示.
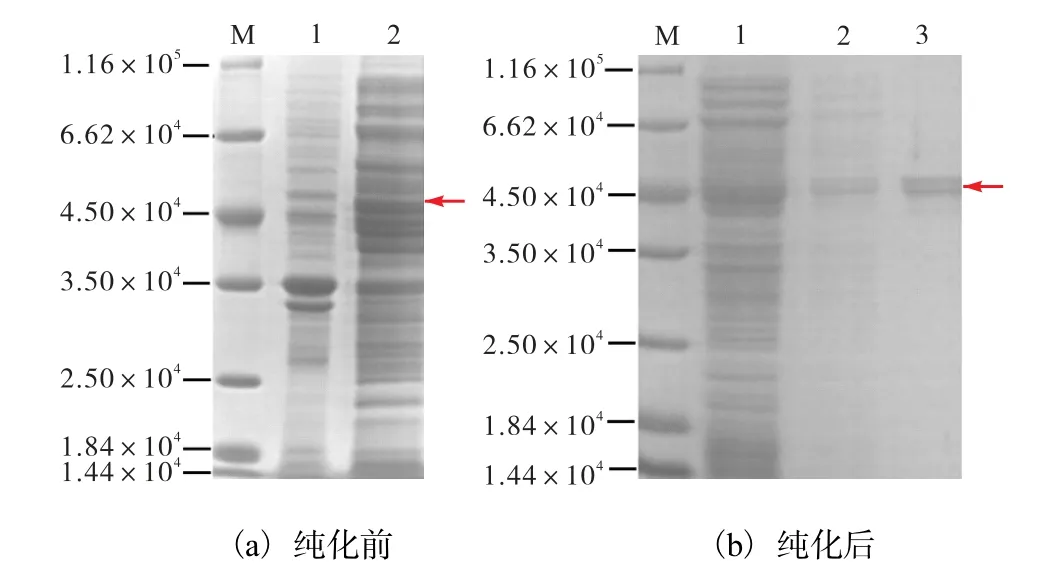
M.蛋白marker. (a)中,1.破碎后沉淀;2.破碎后上清液.(b)中,1.流出液;2.洗涤缓冲液;3.洗脱缓冲液
图2(a)泳道2 显示融合蛋白MBP-hIAPP(红色箭头)位于细胞破碎液上清液中,证明MBP-hIAPP融合蛋白可溶性表达.融合蛋白先利用直链淀粉亲和层析纯化,将与直链淀粉树脂结合的融合蛋白用20 mmol/L 麦芽糖进行洗脱,最终纯化获得MBPhIAPP(红色箭头)融合蛋白,通过SDS-PAGE 电泳分析结果如图2(b)所示.图2(b)中第3 泳道有2 个条带,相对分子质量较大的条带是融合蛋白 MBPhIAPP,相对分子质量较小的条带是MBP 蛋白.
为了提高融合蛋白MBP-hIAPP 的表达量,系统研究了温度和诱导时间对目标融合蛋白质表达的影响.取不同诱导条件下纯化后的洗脱液进行SDSPAGE 电泳和灰度分析,结果如图3 所示.当诱导温度为13 ℃且A600=0.4 时,总蛋白表达量与灰度分析中MBP-hIAPP 所占比例的乘积达到最大,即目标蛋白MBP-hIAPP 表达量达到最大.经BCA 试剂盒测定洗脱液蛋白浓度,结合灰度分析数据,最终结果得发酵1 L 菌液可获得约80 mg MBP-hIAPP 融合蛋白.
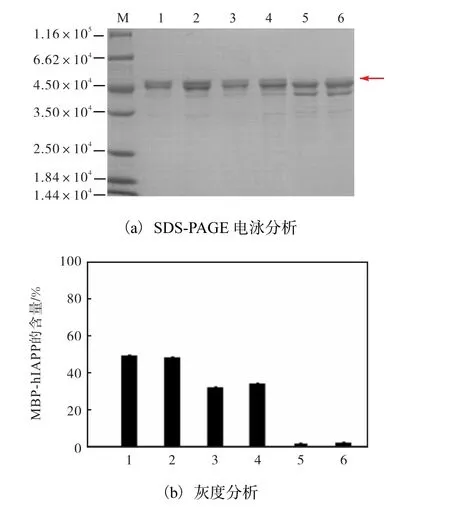
M.蛋白marker;1—6 代表不同的诱导条件. 1.13 ℃,A600=0.3;2.13 ℃,A600=0.4;3.16 ℃,A600=0.5;4.16 ℃,A600=0.4;5.16 ℃, A600=0.7;6.16 ℃,A600=0.6
2.3 MBP-hIAPP融合蛋白的rTEV蛋白酶切效果
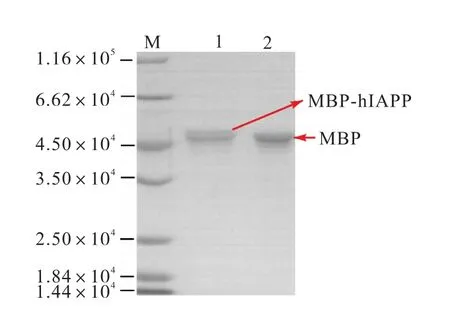
在16 ℃下利用rTEV 酶对MBP-hIAPP 融合蛋白进行酶切,酶切6 h 时取样的SDS-PAGE 电泳分析如图4 所示.从图4 的泳道2 看出,酶切6 h 时融合蛋白MBP-hIAPP 条带几乎完全消失.与之相反,MBP 的含量增加,即MBP-hIAPP 被切成MBP 和hIAPP,并且酶切反应在6 h 以后达到最大酶切比例,与rTEV 说明书上的最大酶切比例时间保持一致.
2.4 SEC凝胶过滤层析纯化酶切产物
酶切产物过除菌膜后通过Superdex 200 分子筛凝胶柱进一步纯化,最终获得高纯度hIAPP 多肽 (图5).
M.蛋白marker;1.0 h;2.6 h
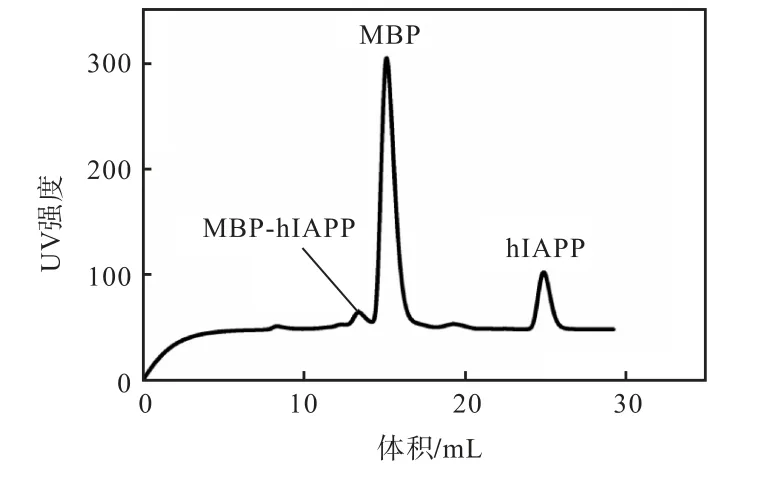
图5 融合蛋白MBP-hIAPP酶切后的凝胶层析过滤纯化Fig. 5 Purification of the fusion protein MBP-hIAPP after gel filtration
根据凝胶过滤层析原理,相对分子质量大的蛋白先从层析柱里面出来,最后面的峰是hIAPP,收集此处出峰时的样品,利用Nanodrop 测定hIAPP 浓度并计算出hIAPP 产量为4~6 mg/L.收集的样品进一步用于Genshare CFAS any KD PAGE 蛋白胶电泳分析和MALDI-TOF 二级质谱鉴定.
2.5 利用蛋白胶电泳和 MALDI-TOF 质谱鉴定hIAPP
凝胶过滤层析得到hIAPP 样品的SDS-PAGE 电泳结果如图6 所示.

图6 凝胶过滤层析得到hIAPP样品的SDS-PAGE电泳结果 Fig. 6 Results of SDS-PAGE analysis of hIAPP samples obtained with gel filtration chromatography
图6 中红色虚线框内的条带在3.3×103~5.8×103之间,与hIAPP 的相对分子质量一致.SEC 纯化分离后的hIAPP 二级质谱鉴定结果如图7 所示,质核比为3 932.57 处有信号.又因采用H+模式,可计算出此处的蛋白相对分子质量大小是3 931.57,与文献[19]报道hIAPP 与几丁质结合域蛋白融合表达的质谱鉴定结果一致.同时,对多肽序列进行了对比,序列一致性为100%.
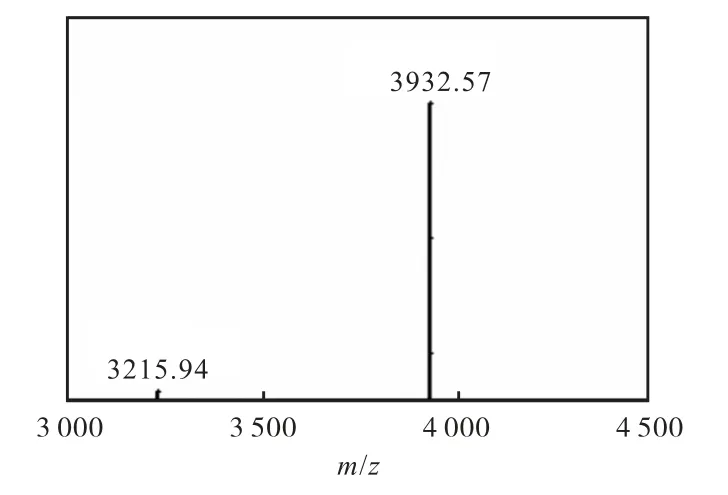
图7 纯化后hIAPP二级质谱 Fig. 7 Identification of hIAPP secondary mass spectrometry after SEC purification
3 结 语
本研究获得了一株高产hIAPP 的重组大肠杆菌菌株,以及可溶性表达纯化、高产hIAPP 多肽的方法.该方法采用麦芽糖结合蛋白为融合蛋白,实验证明融合蛋白是可溶性,与文献[19]采用几丁质结合域蛋白作为融合标签相比hIAPP 多肽的产率提高了约2 倍.添加可溶性蛋白片段(NANP)3,并用改进的烟草蚀纹病毒蛋白酶(rTEV)切除MBP 标签,优化酶切条件,最后得到不含任何多余残基的hIAPP 多肽,经低相对分子质量蛋白胶电泳分析和质谱鉴定确定为hIAPP.此研究可以为以研究hIAPP 的体外聚集用以开发2 型糖尿病药物和研究hIAPP 的细胞毒性提供基础数据.另外,本研究也为其他疏水性或有毒性蛋白及多肽在大肠杆菌中的表达提供了思路.

