山兰萌发种子定向培养成苗技术研究
张正海,张亚玉※,孙海,张淋淋,张悦,侯淑丽
(1.中国农业科学院特产研究所,长春 130112;2.吉林省医药中等职业学校,长春 130031)
山兰〔Oreorchis patens(Lindl.)Lindl.〕是兰科山兰属多年生阴生草本植物,广泛分布于我国西南、华中、西北及东北各地,朝鲜半岛至西伯利亚地区,日本等地也有少量分布[1]。其干燥假鳞茎入药,甘、辛,寒,有小毒,具有滋阴清肺、化痰止咳的功效,用于治疗痈疳疮肿、瘰疬、无名肿毒[2],但长期以来,山兰的药用价值并未受到重视,而是被当作山慈菇伪品对待[3]或者作为习用品入药[4]。随着近些年山兰需求量增加,价格暴涨,导致其野生资源遭到毁灭性破坏,被列为吉林省三级保护植物[5]。有关山兰的资源开发[6-7]、药效成分、药理活性[8-10]、野生驯化[11]以及菌根真菌[12]等的相关研究较多,但制约山兰大面积人工栽培的种苗繁育关键技术研究极少[13]。本研究以山兰萌发种子为试验材料,研究不同分裂素和生长素及配比对山兰从种子到种苗发育过程中的调节和促进作用,使山兰萌发种子定向发育,缩短成苗时间,提高成苗效率。
1 材料与方法
1.1 试验材料
以肉眼可分辨的萌发种子为原球茎增殖试验的外植体(约1 mm 1 mm 1 mm),以增殖的原球茎为球茎分化外植体,以原球茎分化产生的球茎为生根试验外植体。
1.2 分裂素对原球茎增殖的影响
以MS+NAA 0.1 mg/L+蔗糖30 g/L+琼脂粉4.5 g/L为基本培养基,添加分裂素为TDZ、Zt、6-BA、KT,添加量分别为 0.1、2.0、4.0、6.0、8.0、10.0 mg/L,培养温度23 ℃、光暗周期14 h/10 h、光照强度1 500 lx、培养时间55 d,每处理3 个重复,每重复15 个外植体,统计指标为外植体均重。
1.3 生长素对原球茎增殖的影响
以MS+6-BA0.1 mg/L+蔗糖30g/L+琼脂粉4.5g/L为基本培养基,添加生长素为2,4-D、NAA、IBA、IAA,添加量分别为 0.1、2.0、4.0、6.0、8.0、10.0 mg/L,培养温度23 ℃、光暗周期14 h/10 h、光照强度1 500 lx、培养时间55 d,每处理3 个重复,每重复15 个外植体,统计指标为外植体均重。
1.4 6-BA 和NAA 组合对原球茎增殖的影响
以 MS+蔗糖30 g/L+琼脂粉4.5 g/L 为基本培养基,以对原球茎增殖效果最好的6-BA和NAA进行组合,6-BA 浓度为 2.0、3.0、4.0、5.0、6.0 mg/L,NAA 浓度为 6.0、7.0、8.0、9.0、10. 0 mg/L,培养温度 23 ℃、光暗周期14 h/10 h、光照强度1 500 lx、培养时间55 d,每处理3 个重复,每重复15 个外植体,统计指标为外植体均重。
1.5 6-BA、KT 和ZT 对原球茎分化为球茎的影响
以MS+IBA 6.0 mg/L+蔗糖30 g/L+琼脂粉4.5 g/L为基本培养基,添加分裂素为6-BA、KT、ZT,添加量分别为 0.1、2.0、4.0、6.0、8.0、10.0 mg/L,培养温度 23℃、光暗周期14 h/10 h、光照强度1 500 lx、培养时间55 d,每处理3 个重复,每重复15 个外植体,统计指标为原球茎分化为球茎系数,原球茎分化为球茎系数=分化球茎数/接种原球茎数。
1.6 IBA 和IAA 对原球茎分化为球茎的影响
以MS+6-BA 4.0 mg/L+蔗糖30 g/L+琼脂粉4.5 g/L为基本培养基,添加生长素为IBA、IAA,添加量分别为 0.1、2.0、4.0、6.0、8.0、10.0 mg/L,培养温度 23 ℃、光暗周期14 h/10 h、光照强度1 500 lx、培养时间55 d,每处理3 个重复,每重复15 个外植体,统计指标为原球茎分化为球茎系数。
1.7 KT 和IBA 组合对原球茎分化为球茎的影响
以 MS+蔗糖30 g/L+琼脂粉4.5 g/L 为基本培养基,以对原球茎分化为球茎效果最好的KT 和IBA 进行组合,KT 浓度为 2.0、2.5、3.0、3.5、4.0 mg/L,IBA 浓度为 2.5、3.0、3.5、4.0、4.5 mg/L,培养温度 23 ℃、光暗周期14 h/10 h、光照强度1 500 lx、培养时间55 d,每处理3 个重复,每重复15 个外植体,统计指标为原球茎分化为球茎系数。
1.8 6-BA 和IAA 组合对球茎生根的影响
以 MS+蔗糖30 g/L+琼脂粉4.5 g/L 为基本培养基,以 6-BA 和 IAA 进行组合,6-BA 浓度为 0.1、2.5、5.0、7.5、10.0 mg/L,IAA 浓度为 0.1、2.5、5.0、7.5、10.0 mg/L,培养温度23 ℃、光暗周期14 h/10 h、光照强度1 500 lx、培养时间55 d,每处理3 个重复,每重复15 个外植体,统计指标为球茎生根数。
1.9 数据分析
试验数据用SAS 8.01 进行方差分析。
2 结果与分析
2.1 分裂素对原球茎增殖的影响
各分裂素对原球茎增殖效果差异不显著,但6-BA的增殖效果较好,且随6-BA 浓度增加呈先增加后降低的趋势,在6-BA 4.0 mg/L 时达到最大值39.62 mg/原球茎。结果见表1。
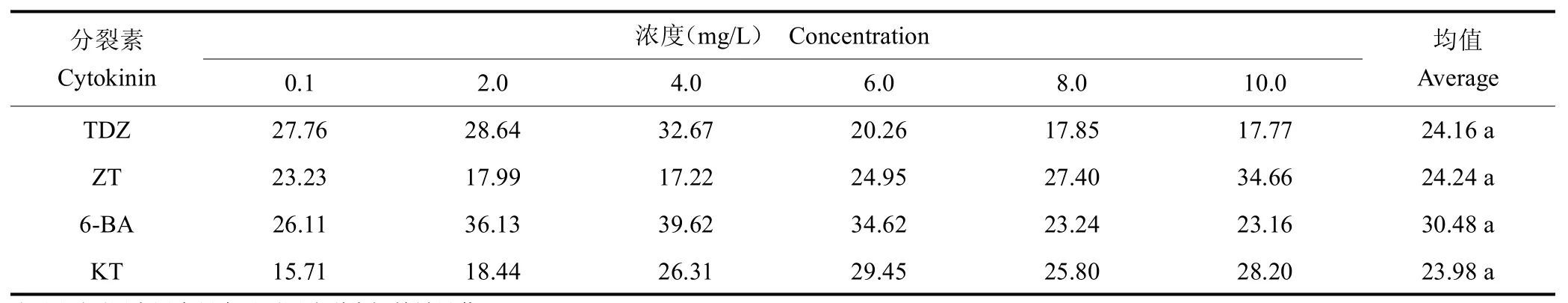
表1 分裂素对原球茎增殖的影响Tab.1 Effect of cytokinins on protocorm multiplication (mg/原球茎)
2.2 生长素对原球茎增殖的影响
对原球茎增殖效果显著的生长素是NAA,增殖效果呈先降后增再降的趋势,在NAA 8.0 mg/L时达到最大值78.05 mg/原球茎。结果见表2。

表2 生长素对原球茎增殖的影响Tab.2 Effect of auxins on protocorm multiplication (mg/原球茎)
2.3 6-BA 和NAA 组合对原球茎增殖的影响
在6-BA 5.0mg/L 时原球茎增殖效果较好,且随NAA 浓度增大呈先增加后降低的趋势,在6-BA 5.0 mg/L+NAA 8.0 mg/L 时达到最大值106.88 mg/原球茎。结果见表3、图1。
2.4 分裂素对原球茎分化为球茎的影响
对原球茎分化为球茎效果较好的分裂素是KT,分化系数随KT浓度增加呈先增加后降低的趋势,在KT 4.0 mg/L 时达到最大值0.40。结果见表4。

图1 萌发种子增殖产生的原球茎Fig.1 Protocorm produced by germination of seed

表3 6-BA 和NAA 组合对原球茎增殖的影响Tab.3 Effect of 6-BA and NAA combination on protocorm multiplication(mg/原球茎)

表4 分裂素对原球茎分化为球茎的影响Tab.4 Effects of cytokinins on the differentiation of protocorms into corms
2.5 生长素对原球茎分化为球茎的影响
IBA 和IAA 对原球茎分化为球茎效果差异不显著,IBA对原球茎分化为球茎效果较好,分化系数随着IBA 浓度增加而降低,在IBA 0.1 mg/L 时分化系数达到最大值1.00。结果见表5。

表5 生长素对原球茎分化为球茎的影响Tab.5 Effects of auxins on the differentiation of protocorms into corms
2.6 KT 和IBA 组合对原球茎分化为球茎的影响
在KT 2.5 mg/L 时原球茎分化为球茎效果较好,原球茎分化为球茎效果随IBA 浓度增加呈降低趋势,在KT 2.5 mg/L+IBA 2.5 mg/L 时分化系数达到最大值1.30。结果见表6、图2。
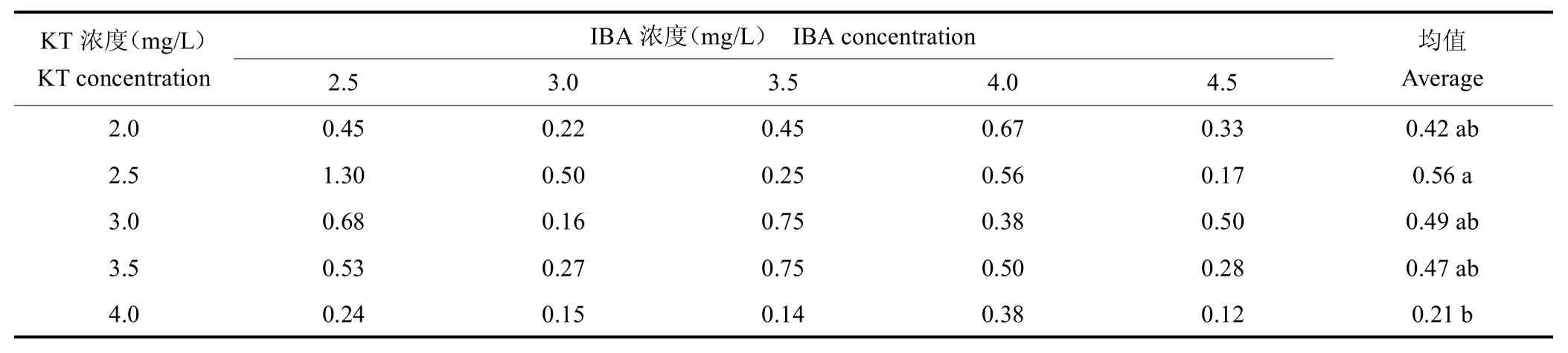
表6 KT 和IBA 组合对原球茎分化为球茎的影响Tab.6 Effect of KT and IBA combination on differentiation of protocorm into corms
2.7 6-BA 和IAA 对球茎生根的影响
在6-BA 0.1 mg/L 时球茎生根效果较好,球茎生根数随IAA 浓度增大呈先增后减趋势,在6-BA 0.1 mg/L+IAA 2.5 mg/L时球茎生根数达到最大值6.6条/球茎。结果见表7、图3。

图2 原球茎分化产生的球茎Fig.2 Corms produced by protocorm differentiation

图3 球茎生根Fig.3 Rooting of corm
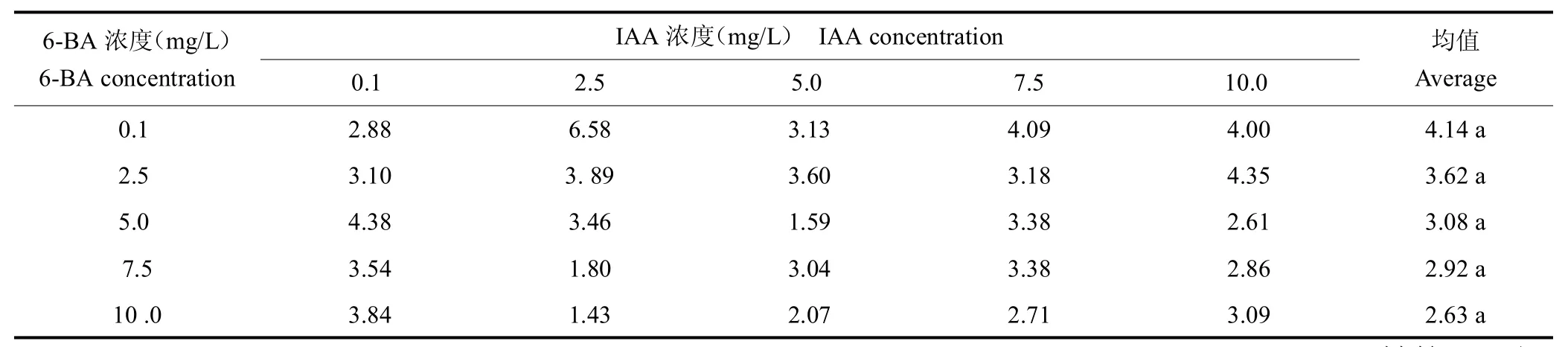
表7 6-BA 和IAA 对球茎生根的影响Tab.7 Effects of 6-BA and IAA on rooting of corm 条/球茎
3 讨论
3.1 由于山兰种子非常细小,刚萌发的种子继代操作极不方便,可以将种子直接播种在原球茎增殖培养基中进行培养,当原球茎体积增加到一定大小时再进行继代,既方便操作又减少培养环节。由于原球茎体积不容易测量,本研究以原球茎重量变化来代替体积变化。
3.2 当原球茎体积达到一定标准后转入球茎分化培养基,在球茎分化培养时,低浓度IBA 有利于球茎分化,但低浓度IBA 条件下分化出的球茎重量小,影响移栽成活率,因此选择有利于球茎重量增加的IBA 浓度范围与KT 进行组合;而近缘植物杜鹃兰种子萌发研究表明,适宜浓度的IBA 与KT 组合有利于种子萌发[14],这可能与植物种类及激素配比有关,也对减少山兰种苗繁育环节有启示作用。
3.3 种子直接产生的原球茎体积小、重量轻、球茎分化系数低,但由于山兰种子细小、数量巨大,因此以种子作繁殖材料,进行人工定向培养,可在短时间内获得大量种苗。

