LMNAR527C基因突变纯合型小鼠表型及其组织、细胞衰老相关蛋白表达观察
李东明,刘恒,朱兰玉,方玲,吴华裕,潘尚领,林有坤,舒伟
(1广西医科大学基础医学院,南宁530021;2广西医科大学第一附属医院)
LMNA基因主要编码LaminA/C蛋白与LaminB蛋白共同构成细胞核膜内层的网状核纤层结构,维持细胞核结构稳定,参与对外界机械力的转导,固定染色质和基因转录调控作用[1~3]。LaminA/C还存在细胞核质中,对细胞增殖分化、染色质重组和DNA复制具有调控功能。LMNA第527位氨基酸(LMNAR527)位于蛋白结构域的表面,参与盐桥的形成,精氨酸是碱性氨基酸,半胱氨酸是中性氨基酸。因此,R527C的取代会破坏蛋白质的表面结构,对核纤层结构产生影响[4]。LMNAR527是引起核纤层蛋白病的热点突变区域。LMNA基因突变导致十几种退行性疾病的发生,包括Emery-Dreyfus肌营养不良、外周神经病变、脂肪营养不良和儿童早老症等[5]。研究[6]发现,LMNAR527C基因突变会导致儿童早老症,但在LMNAR527C基因突变导致的早老症患者细胞中,并未发现有prelamin A的堆积和早老蛋白progerin的积累[7]。目前,LMNAR527C基因突变在衰老中的作用仍不清楚, LMNA基因突变与疾病的发生发展呈现复杂和多样性,LMNA基因型与疾病表型的关系并不明确[8]。2016年9月~2019年3月,本研究通过构建LMNAR527C突变基因小鼠模型,观察了LMNAR527C基因突变纯合型小鼠的表型特征及细胞衰老标志物的变化,以探讨LMNAR527C基因突变对衰老的影响。
1 材料与方法
1.1 动物、细胞、试剂、仪器 品系为 C57BL/6的LMNA杂合突变小鼠来源于上海南方模式生物科技有限公司。293T细胞,LMNA 基因敲除的293T细胞由本实验室保存;pEGFP-N1质粒购自北京全式金公司;LaminA抗体购于英国Abcam公司;γH2Ax抗体购于英国Abcam;DMEM培养基(Gibco公司);胎牛血清(FBS,Gibco);青霉素-链霉素(Hyclone公司);Lipofectamine2000(Invitrogen公司);PDVF膜购于Millipore(Kenilworth公司);EMD Millipore LμminataTMWestern HRP 化学反应发光液(WBLUR0500公司);DAPI(Beyotime公司);1%蛋白酶抑制剂(Thermoscientific公司);RIPA(Thermoscientific公司);细胞衰老相关β-半乳糖苷酶染色试剂盒(Beyotime公司);Adobe Photoshop软件(Adobe公司),Image J 软件(MD公司)
1.2 LMNAR527C基因突变纯合型小鼠的获得及表型观察 LMNA杂合型小鼠南方模式动物中心构建完成,构建同源重组载体,利用胚胎细胞打靶技术通过显微注射法转入小鼠胚胎细胞中,将注射后的小鼠囊胚移植到假孕母鼠子宫内,阳性F0通过与野生型小鼠交配获得LMNA基因杂合子突变小鼠。LMNA杂合型小鼠引进后在SPF动物房饲养和杂交繁殖,公母鼠合笼后生出的小鼠F1代剪尾提DNA进行PCR测序,雌雄鼠合笼后出生的F1 代小鼠有三种基因型:野生型(基因型LMNAWT/WT),杂合型(基因型LMNAWT/R527C),纯合型(基因型LMNAR527C/R527C),将F1 代的纯合型小鼠继续公母鼠合笼,生出的F2 代全为纯合型小鼠。选取LMNA野生型、LMNA杂合型、LMNAR527C型三种基因型小鼠各20只,雌雄各半,测量第4周到12周小鼠的体质量和体长。小鼠双耳连线的中点到尾体交接处代表体长,将放在笼子上面,当小鼠在抓紧笼子时,拉住它的尾巴使其自然伸直,然后进行测量。随机选择9笼小鼠,每笼一雌一雄,对其产的第二胎幼仔进行统计。同时选取三种基因型单一性别小鼠各20只,记录生存周期。
1.3 LMNAR527C基因纯合突变小鼠尾组织及腹部皮肤组织中γH2Ax蛋白检测 ①采用Western blotting法。剪取纯合型、杂合型、野生型小鼠尾巴,根据RIPA试剂说明书操作提取尾巴组织总蛋白,上样25 μg总蛋白的裂解液于10% 的聚丙烯酰胺凝胶中进行电泳,300 mA恒定电流转膜90 min使蛋白转移至PDVF膜上。5% 脱脂牛奶覆盖膜,摇床轻柔晃动1h封闭膜,加入适量抗体4 ℃摇床过夜,然后用含1% 吐温20(Tween 20)的PBS清洗膜,加入辣根过氧化物酶-共轭二抗覆盖住膜,摇床轻柔晃动1 h。EMD Millipore LμminataTMWestern HRP 化学反应发光液进行显色反应。使用Adobe Photoshop软件对蛋白条带扫描,计算各蛋白条带的灰度值,以目的蛋白与内参β-actin蛋白条带灰度值比值表示目的蛋白表达量。② 采用免疫组化法。取野生型、纯合型小鼠腹部皮肤组织,皮肤标本冷冻切片,切片水化,然后放于微波炉煮沸后,放入0.01 mol/L pH 6.0的枸橼酸钠缓冲液中水浴20 min,进行抗原修复。根据SP试剂盒(9001,ZSGB-Bio)操作步骤进行试验,最后二氨基联苯胺底物试剂盒显色,苏木精复染,显微镜下观察拍照。采用Image J 软件分析统计图片总细胞和阳性细胞数,结果以阳性细胞占总细胞百分比表示γH2Ax蛋白的表达。
1.4 LMNA敲除的293T 细胞LMNAR527C突变基因转染及其γH2Ax蛋白、LaminA蛋白检测 根据TRIzol试剂说明书操作提取野生型和LMNA基因突变型小鼠尾组织的总RNA ,使用oligo(dT)和M-MLV反转录酶反转录为cDNA。根据PrimeSTAR®Max DNA Polymerase试剂说明书操作,使用LMNA基因特异引物(正向引物:5′GGTGAATTCAAATGGAGACCCCGTCACACG3′,反向引物:5′CTTGGTACCAACATGATACTGCAGTTCTGGG3′),PCR扩增小鼠LMNA和LMNAR527C突变基因。利用分子克隆技术获得小鼠pEGFP-N1-LMNA和pEGFP-N1-LMNA R527C重组质粒,然后转染293T LMNA敲除细胞,转染2 μg pEGFP-N1-LMNA R527C质粒的细胞作为实验组,转染2 μg pEGFP-N1-LMNA质粒的细胞作为对照组,转染2 μg pEGFP-N1空质粒的细胞作为空白组;采用Western blotting法检测到实验组及对照组中LaminA表达,提示质粒转染成功。各组细胞处理48 h后,收集细胞采用Western blotting法检测γH2Ax蛋白。将293T细胞作为正常组,选取实验组细胞采用细胞免疫荧光法检测LaminA蛋白,荧光倒置显微镜观察拍照,分析与正常组相比,实验组LaminA蛋白的分布和定位。
1.5 LMNAR527C基因纯合突变小鼠肺成纤维细胞β-半乳糖苷酶活性检测 无菌操作取2~3周的纯合型及野生型小鼠,处死后取肺叶置于PBS液中,PBS清洗2遍,剪碎肺叶组织,提取肺成纤维细胞。在六孔板中接种2×105/孔的小鼠肺成纤维细胞,根据细胞衰老相关β-半乳糖苷酶染色试剂盒(碧云天)说明书操作对细胞进行染色。显微镜下拍照,采用Image J 软件分析,结果以β-半乳糖苷酶活性染色阳性细胞占总细胞百分比表示。
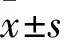
2 结果
2.1 不同LMNA基因型小鼠表型比较 三种基因型小鼠体质量、体长比较,P均>0.05,详见表1、2。野生型小鼠笼号1、2、3、4、5、6、7、8、9、10、11、12繁殖幼仔个数分别为6、5、7、6、5、7、5、4、6、6、5、7个,杂合型小鼠笼号1、2、3、4、5、6、7、8、9、10、11、12繁殖幼仔个数分别为5、6、7、5、7、4、5、8、5、5、6、7个,纯合型小鼠笼号1、2、3、4、5、6、7、8、9、10、11、12繁殖幼仔个数分别为6、4、5、6、7、5、6、7、5、6、4、5个;三种基因型小鼠繁殖幼仔个数比较,P>0.05。三种基因型小鼠生存率比较,P>0.05(见图1)。

表1 不同周龄、不同LMNA基因型小鼠体质量

表2 不同周龄、不同LMNA基因型小鼠体长
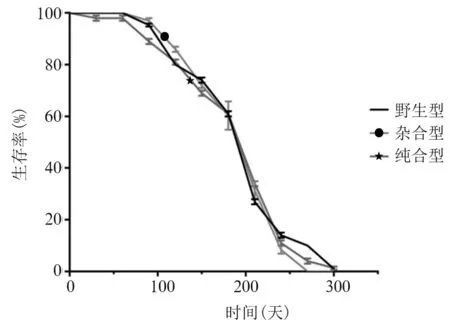
图1 杂合型、纯合型和野生型小鼠生存率比较
2.2 LMNAR527C基因突变小鼠尾组织、皮肤组织及细胞中衰老相关蛋白的表达 ①不同基因型小鼠尾组织、腹部皮肤组织中γH2Ax蛋白水平比较: 设野生型小鼠尾组织γH2Ax蛋白相对表达量为1,纯合突变型、杂合突变型小鼠尾组织γH2Ax蛋白相对表达量分别为2.40±0.043 2、1.72±0.035 3 ,纯合突变型、杂合突变型小鼠高于野生型(P均<0.05);野生型小鼠γH2Ax阳性细胞百分比为17%±1.68%,纯合突变型小鼠γH2Ax阳性细胞百分比为38%±2.25% ,二者比较,P<0. 05。②各组LMNA敲除的293T 细胞中γH2Ax蛋白水平及 LaminA蛋白分布、定位:以空白组细胞中γH2Ax蛋白相对表达量为1,实验组、对照组细胞γH2Ax蛋白相对表达量分别为2.72±0.233、2.9±0.035,对照组及实验组高于空白组,P均<0. 05。实验组细胞Lamin A蛋白发生聚集不连续,容易在核膜聚集,且部分蛋白从核纤层转移至核内(图2)。③纯合型、野生型小鼠肺成纤维细胞中β-半乳糖苷酶活性:纯合型、野生型小鼠肺成纤维细胞中衰老相关β-半乳糖苷酶活性染色细胞阳性率分别为11.0%±1.96%、2.5%±0.78%,二者比较,P<0.05。
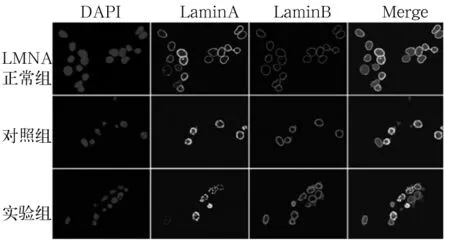
图2 LaminA蛋白的分布及定位(400×)
3 讨论
目前已经建立了较多早老症相关的小鼠模型,以研究LMNA基因突变导致早老症产生的致病机制[9]。但LMNAR527C突变的小鼠模型未见报道,本研究通过购买LMNAR527C杂合型小鼠进行杂交的方式获得LMNAR527C纯合型小鼠。实验中发现,在动物整体水平上,与LMNA野生型小鼠相比,LMNAR527C突变基因型小鼠在体型,体质量,繁殖能力和生存期上差异无统计学意义,说明LMNAR527C纯合型小鼠没有出现儿童早老病的相关临床表型,这可能是因为不同物种间存在差别,LMNAR527C突变基因在衰老中的作用还有待进一步研究。
Sullivan 和Kubben相继在LMNA敲除的小鼠中发现,小鼠出生后出现严重的生长迟缓、肌营养不良和核异常,Lamin A 蛋白缺失使小鼠的组织分化和器官生成能力下降,出生后的小鼠存活期仅为3周[10]。此外,LMNA基因敲除小鼠的PPAPγ和CEBP/α蛋白水平升高,调控其下游基因Wnt-10b、β-catenin蛋白水平下降,从而影响脂肪、肌肉和骨骼的组织分化[11]。研究报道,LMNAM371K突变基因导致小鼠出生率和寿命减少,小鼠出现嗜酸性粒细胞增多、心肌纤维碎裂、核固缩和水肿的疾病表型。Bergo等[12]在小鼠敲除了参与prelaminA蛋白水解过程的Zmptse24金属蛋白酶,Zmptse24敲除的小鼠具有类似儿童早老症的临床表型,发育迟缓,因心功能障碍、脱发和核异常而过早死亡。尽管这些小鼠建模的方式不同,但可发现LMNA基因突变造成的疾病机制普遍存在两个特点,模型小鼠的细胞核结构不完整,突变的LMNA基因造成基因表达异常[13]。根据文献[14]报道,细胞核膜的完整跟基因组的稳定性相关。LMNAR527C突变基因导致核纤层组装发生异常,失去修复细胞核畸形能力。本研究结果显示,LMNAR527C基因突变编码的LaminA蛋白容易在核膜形成点状聚集,部分蛋白定位从核纤层转移至核内。LaminA蛋白分布的改变,可能影响了细胞核膜的结构,导致细胞基因转录调控异常,基因组不稳定[15]。
虽然本研究中的LMNAR527C突变基因小鼠未出现相关疾病临床表型,但我们在对小鼠尾组织和皮肤组织进行γH2Ax蛋白的检测结果显示,LMNAR527C突变基因小鼠皮肤组织γH2Ax蛋白水平增加;同时,在原代培养小鼠的肺成纤维细胞衰老相关β-半乳糖苷酶染色实验发现,LMNAR527C突变基因小鼠成纤维衰老细胞数量百分比增加,实验结果证明LMNAR527C突变基因导致模型小鼠组织和原代培养的肺成纤维细胞DNA损伤增加,基因组不稳定,衰老加速。细胞衰老与个体整体衰老不一致,我们推测,可能是由于体外细胞实验与小鼠整体实验存在环境差异,小鼠出现衰老表型可能需要其他条件,例如紫外照射、免疫系统缺陷的刺激,也有可能小鼠存在另外相关的信号通路修复了DNA损伤,或者LMNAR527C突变基因导致编码的Lamin A蛋白结构功能改变影响其他信号通路的关键蛋白从而改善了LMNAR527C突变基因的不良影响。LMNAR527C突变基因对衰老的影响还有待进一步研究。
本研究通过分子克隆技术,把小鼠LMNAR527C突变基因重组到质粒pEGFP-N1中,通过Lipo2000转染重组质粒到239T LMNA敲除细胞,结果显示转染LMNAR527C基因突变的细胞γH2Ax蛋白水平增加,但与转染LMNA正常基因的细胞相比并未有明显差异,γH2Ax蛋白水平增加可能是由于转染外源基因造成,并非基因突变导致。免疫荧光实验结果表明,转染野生型LMNA能修复LMNA敲除导致的细胞核畸形[16]。在典型儿童早老症临床样本研究中发现,患者成纤维细胞核形态异常、γH2Ax蛋白水平增加、异染色质蛋白水平减少以及组蛋白表观遗传修饰发生改变[17]。LMNAR527C突变基因在LMNA基因敲除细胞中表达的实验结果说明,LMNAR527C突变基因导致细胞的核结构和功能异常与典型儿童早老症相似。
综上所述,LMNAR527C基因突变小鼠表型无明显改变。LMNAR527C突变基因编码的Lamin A蛋白在细胞内聚集不连续,定位从核膜到核内,导致细胞DNA损伤增加,衰老细胞增加,但可能存在其他原因清除了LMNAR527C基因突变造成的不良影响,因此LMNAR527C突变基因模型小鼠整体并未出现相关疾病临床表型。LMNAR527C基因突变小鼠模型为人们了解Lamin A蛋白在不同物种间的生物学功能以及在组织发育过程中的作用提供了宝贵材料。

