Hsp90抑制剂WH-4对肝癌细胞株SK-HEP-1增殖、凋亡及耐药基因表达的影响观察
徐单单,王颖,陈素红
(1广东食品药品职业学院生物技术学院,广州510520;2暨南大学生命科学技术学院;3仲恺农业工程学院食品学院)
肝癌是世界第五大常见肿瘤疾病[1],尽管现代医学取得巨大进步,但是其预后仍较差,5年生存率较低。肝癌的复发、转移与耐药是患者5年生存率降低的主要原因,大约有70%的肝癌患者在治疗5年后会复发[2]。化疗是肝癌治疗的主要手段。Sorafenib是一种多酶抑制剂靶点药物,为常见的肝癌治疗一线药物,主要用于不能进行手术治疗的肝癌患者[3],但是Sorafenib使用后患者会出现明显的耐药或因其不良反应如高血压、恶心、皮肤病以及腹泻等[4]而停药,这些缺点限制了Sorafenib的临床应用。其他肝癌化疗药物,如Regorafenib、Ramucirumab临床效果均不及Sorafenib[5]。所以,研究及开发其他靶点的肝癌治疗药物成为必需。
本课题组之前已深入研究过Hsp90抑制剂SNX-2112,发现其能抑制黑色素瘤、肝癌、乳腺癌细胞的增殖[6~9],但是其水溶性不好。2008年1月至今,本研究在前期研究的基础上,观察了SNX-2112的衍生物WH-4对肝癌细胞SK-HEP-1增殖、凋亡和化疗药物耐药基因ABCB1、ABCG2的影响。
1 材料与方法
1.1 细胞、试剂及仪器 肝癌细胞株SK-HEP-1购自中山大学细胞库,采用1640培养基(10%胎牛血清,1%青霉素链霉素),置于37 ℃、5%二氧化碳培养箱中培养。WH-4由暨南大学王一飞教授实验室合成。17-AAG购自上海蓝木生物公司,MTT粉末购自碧云天生物技术公司,1640培养基购自Gibco公司,胎牛血清购自四季青公司,青霉素链霉素购自广州天骏公司,AnnexinV-APC/7AAD细胞凋亡试剂盒购自南京凯基公司。Bcl2(#4223)抗体、Bcl-xL(#2764)以及Bax(#2774)抗体购自美国Cell Signaling Technology公司。ECL细胞Western blotting发光液购自美国Millipore公司。细胞培养箱购自美国Thermo公司,流式细胞仪购自美国BD公司,PCR仪器购自BIO-RAD公司。
1.2 不同浓度WH-4对肝癌细胞SK-HEP-1增殖的影响观察 ①采用MTT法。将肝癌细胞SK-HEP-1随机分为A、B、C组,每组肝癌细胞SK-HEP-1经胰酶消化后,接种到96孔板,每孔接种5 000个细胞,每组设3个复孔,A组分别加入0.625、1.25、2.5、5、10 μmol/L WH-4,B组分别加入0.625、1.25、2.5、5、10 μmol/L 17-AAG, C组加等量的生理盐水。1640培养基培养24 h、48 h,酶标仪检测450 nm OD值,计算细胞存活率:细胞存活率(%)=实验组OD /对照组OD ×100%(实验组指A组、B组,对照组指C组)②采用BrdU法。将肝癌细胞SK-HEP-1随机分为A1、B1、C1组,分别加入2.3 μmol/L WH-4、2.6 μmol/L 17-AAG组及等量的生理盐水,1640培养基培养48 h,1 500 r/ min离心5 min离心收集收集各组肝癌细胞,按试剂盒说明书操作,最后荧光显微镜观察细胞增殖情况( 药物对细胞有抑制效果,绿色荧光变弱;反之,变强)。③克隆形成率的测算:采用软琼脂平板实验。将肝癌细胞SK-HEP-1随机分为A2、B2、C2组,分别加入2.25 μmol/L WH-4、2.80 μmol/L 17-AAG及等量生理盐水,用含20%胎牛血清的1640培养基(2倍双抗)将各组肝癌细胞SK-HEP-1调整至密度30 000个/mL,按试剂盒说明书操作。显微镜下观察大于50个细胞的结晶紫染色克隆。细胞克隆形成率 = 大于50个细胞的克隆数 / 接种细胞数 × 100%。
1.3 WH-4对肝癌细胞SK-HEP -1凋亡的影响观察 采用流式细胞术。实验分组及处理同克隆能力观察试验。1640培养基培养各组肝癌细胞SK-HEP-1 48 h,弃去培养基上清,胰酶消化细胞,用PBS洗涤细胞3次,收集5×105个细胞;每个样品加入500 μL结合液重悬细胞,锡箔纸包好静置15 min;然后每个样品再加入5 μL的Annexin-APC凋亡试剂,轻轻混匀后静置5 min,再加5 μL的7-AAD凋亡试剂,混匀;室温下避光孵育15~20 min,流式细胞仪测算细胞凋亡率。
1.4 WH-4对肝癌细胞SK-HEP-1凋亡蛋白Bcl2、Bax、Bcl-xL的影响观察 采用Western blotting法。实验分组及处理同同克隆能力观察试验。1640培养基培养48 h,1 500 r/min离心5 min离心收集各组肝癌细胞SK-HEP-1,细胞用含苯甲基磺酰氟(PMSF)的 RIPA 裂解液裂解,金属浴加热裂解细胞到完全溶解。然后使用BCA法测定蛋白浓度,并使用SDS loading buffer上样缓冲液稀释细胞。蛋白样品使用12%的SDS-PAGE 凝胶电泳分离,然后转膜到PVDF膜上。5%脱脂牛奶(0.1%吐温20,TBS缓冲液)室温封闭 1.5 h,TBST缓冲液洗涤膜3次后,一抗与PVDF 膜4 ℃ 杂交孵育过夜。次日,TBST洗涤PVDF膜3次,然后加入相应的二抗,室温1 h,利用化学发光法显影蛋白表达水平。使用GAPDH作为内参蛋白。
1.5 WH-4对多药耐药基因 ABCB1、乳腺癌耐药蛋白(ABCG2)的影响观察 采用qPCR法。将肝癌细胞SK-HEP-1随机分为A3、B3、C3组,分别加入2.30 μmol/L WH-4、2.65 μmol/L 17-AAG及等量生理盐水。1 500 r/ min离心收集上述浓度药物作用48 h后的细胞,弃去上清,提取总RNA,之后进行反转录;反应条件:37 ℃、15 min,85 ℃、5 s,4 ℃保存。反转录获得cDNA用于下一步的qPCR反应过程:ABCB1:F引物:5′-GGGACGCTGGTTCCCGGAAT TTCCGGGCC-3′,R引物:5′-CCGGTTTAAAGGGCCTTGGAACCTTGG-3′。ABCG2:F引物:5′-GGCCAATTGCCTGGGAAGGTTCCGGAACC-3′,R引物:5′-CCCCGGGTTAAGGCCAAGGTTCCGGTTAATT-3′;GAPDH:F引物:5′-TTGAGGTTAAGTGAAC CGGGCCTTAACC-3′,R引物:5′-AATTGGCCCGGTAATGTGGCCAATGGC-3′,反应体积为10 μL,反应步骤为2步法,反应条件:1个循环,95 ℃、5 s,60 ℃、5 s;40 个循环, 95 ℃、15 s ,60 ℃、1 min,用2-ΔΔCt表示目的基因相对表达量。
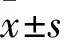
2 结果
2.1 各组肝癌细胞SK-HEP-1增殖抑制率、增殖活性比较 加入0.625、1.25、2.5、5、10 μmol/L WH-4后24 h,A组细胞存活率分别为93.00 %±5.85%、61.82%±3.86%、30.58%±3.25%、28.57%±3.49%、15.35%±3.47%, IC50为(2.35±0.25)μmol/L;48 h后,A组细胞存活率为90.26%±4.18%、61.26%±3.18%、25.61%±2.57%、21.68%±3.15%、10.54%±2.89%,IC50为(2.05±0.25)μmol/L。0.625、1.25、2.5、5、10 μmol/L 17-AAG作用后24 h,B组细胞存活率分别为95.04%±6.45%、66.81%±3.64%、43.61%±3.68%、31.27%±2.89%、23.54%±3.18%,IC50为(2.65±0.18)μmol/L;48 h后,B组细胞存活率分别为95.23%±6.89%、65.31%±3.28%、39.26%±3.27%、31.28%±2.95%、18.21%±3.25%, IC50为(2.45±0.18 )μmol/L。随着WH-4药物浓度的提高以及药物作用时间的延长,细胞存活率降低[R2= 0.647 (48 h),R2= 0.524 (24 h),P均<0.05,见图1、2]。与B1组相比,A1组SK-HEP-1细胞绿色荧光显著性减弱,细胞增殖受到显著性抑制,见图3。A2、B2、C2 组细胞克隆数目分别为(1 523±123)、(3 652±235)、(28 890± 865)个,克隆形成率分别为5.01 %±0.4%、12.17 %±0.7%、96.3±4.72%,A2组、B2组细胞克隆形成率相比,P<0.05,见图4。
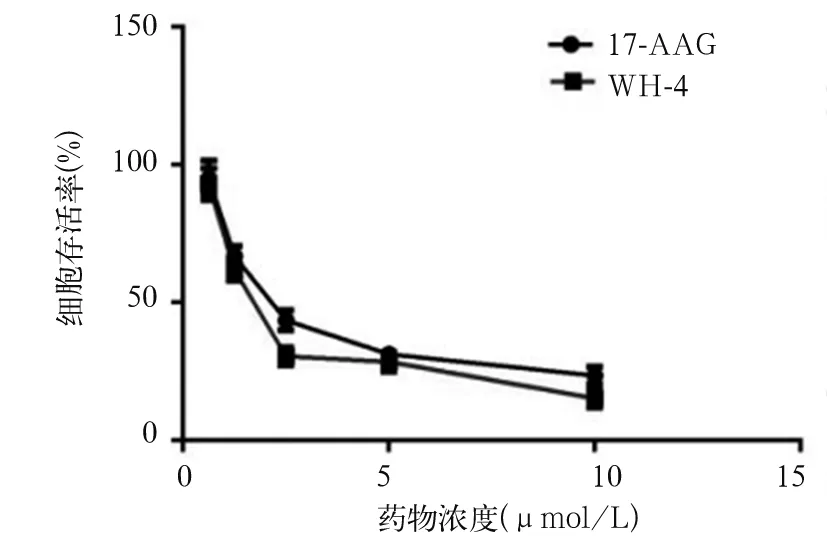
图1 不同浓度WH-4作用24 h后两组细胞存活曲线
图2 不同浓度WH-4作用48 h后两组细胞存活曲线

图3 三组SK-HEP-1细胞的绿色荧光图像

图4 三组肝癌细胞SK-HEP-1克隆形成结果
2.2 各组肝癌细胞SK-HEP-1凋亡率及凋亡蛋白 Bax、Bcl2、Bcl-xL的表达 A2、B2 组细胞凋亡率分别为20.0%±1.25 %、12.2%±1.59%,两组比较,t=0.342,P<0.05。与B2组比较,A2组Bax蛋白相对表达量提高,Bcl-2及Bcl-xL蛋白表达量降低,WH-4诱导细胞凋亡程度明显增加。见图5。
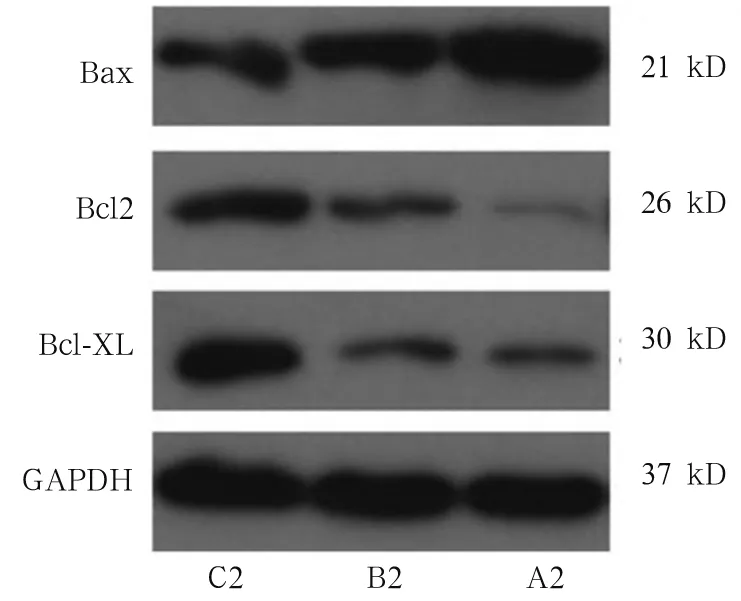
图5 三组肝癌细胞SK-HEP-1凋亡蛋白的表达
2.3 各组肝癌细胞SK-HEP-1耐药基因ABCB1、ABCG2表达比较 A3、B3、C3组ABCB1相对表达量分别为0.38±0.04、0.59±0.05、1.00±0.04, ABCG2分别为0.47±0.03、0.69±0.06、1.00±0.04,A3、B3组ABCB1、ABCG2相对表达量比较,t分别为-8.88、-13.00,P均<0.05。
3 讨论
热休克蛋白是细胞受到应激因素的情况下如热、辐照、饥饿等合成的一组高度保守的蛋白分子,根据同源性及分子量命名为Hsp90、Hsp70、Hsp40、Hsp27等[10]。它是一种高度保守的分子伴侣家族,参与细胞信号的转导、激酶活化、蛋白质转运等生理过程,调控细胞增殖、分化及发育等生理活动[11]。
Hsp90是分子伴侣蛋白,在细胞出现应激的情况下如饥饿、高热等合成的分子,其功能主要是帮助其他的重要分子如激酶达到正确构象,这些激酶等因子称为Hsp90的客户蛋白[12]。Hsp90的客户蛋白还包括其他因子,如细胞因子、转录因子等,这些客户蛋白介导了肿瘤细胞的增殖、存活、血管生成、侵袭、转移、耐药等活动,如Akt、Erk、p38、EGFR、HIF1α等[13~15]。因此,抑制Hsp90功能可导致其多个客户蛋白的生物学功能受到抑制,从而在体内外具有明显的抗肿瘤效果,这使得Hsp90成为有效的抗肿瘤分子靶点。目前研究比较活跃的化合物有geldanamycin、17-AAG、IPI-504、SNX-2112。如临床Ⅱ期研究显示,17-AAG与曲妥珠单抗联合使用治疗Her2+乳腺癌,可有效抑制乳腺癌细胞的存活[16]。IPI-504水溶性更好,具有良好的药物动力学,且肝毒性降低,目前已在临床中进行应用[17, 18]。本研究发现,WH-4能够明显抑制肝癌细胞的增殖,且具有药物浓度依赖性,不管是24 h还是48 h,细胞增殖都受到抑制。但由于细胞在48 h状态不好,因此,48 h后药物对细胞的效果如何还有待进一步研究。
在多种肿瘤细胞发现,Hsp90呈高表达现象,其表达水平与肿瘤患者生存期存在密切关系。近年以Hsp90为分子抗肿瘤靶点的研究很多。首次发现,Hsp90抑制剂格尔德霉素(Geldanamycin)通过结合到Hsp90-ATP结合位点,发挥抗肿瘤细胞增殖活性[19]。经典的Hsp90抑制剂17-AAG抑制胰腺癌I型胰岛素样生长因子受体(IGF1R)、信号转导子与转录激活子蛋白3(STAT3)信号通路,从而达到肿瘤细胞生长抑制的效果[20]。NVP-AUY922对小鼠结肠癌异体移植瘤模型肿瘤细胞具有抑制作用,还发现这种药物本身对小鼠生理活动并没有明显的毒性。Mayor-Lopez等[21]研究发现,Hsp90抑制剂NCT-50具有明显的抗非小肺癌细胞血管新生功能以及细胞毒性,进一步研究[22]发现,NCT-50通过结合到Hsp90的ATP疏水口袋发挥其功能。本研究中的WH-4属于苯甲酰胺化合物,主要针对Hsp90的疏水口袋设计,可干扰Hsp90作为分子伴侣的功能,研究结果显示,随着WH-4药物浓度的提高以及药物作用时间的延长,细胞存活率降低。2.30 μmol/L的WH-4与2.60 μmol/L的17-AAG作用SK-HEP-1细胞48 h,与C组相比,SK-HEP-1绿色荧光显著减弱。提示WH-4对肝癌细胞的增殖具有抑制作用。细胞经WH-4作用后细胞克隆形成数目显著减少,克隆形成率为5.01 %±0.4%,提示WH-4可抑制肝癌细胞的克隆形成。与17-AAG比较,2.25 μmol/L WH-4可使肝癌细胞SK-HEP-1凋亡率升高,Bcl2、Bcl-xL表达水平下调,Bax表达水平上调,提示WH-4对肝癌细胞具有诱导凋亡的效果;qPCR分析结果显示多药耐药基因ABCB1及ABCG2表达水平降低,提示WH-4可能对肝癌细胞的多药耐药性有抑制效果。
综上所述,Hsp90抑制剂WH-4可抑制肝癌细胞SK-HEP-1增殖、诱导其凋亡、抑制其克隆形成,并预防耐药的发生,为肝癌的临床治疗提供了新的思路。本研究的不足之处在于WH-4诱导细胞凋亡的具体途径还不清楚,在体内效果还不明确,有待进一步进行动物及临床实验。

