多功能纳米载体靶向传输Survivin siRNA抑制肝细胞癌增殖
彭 焘,胡 越,李名安,黄明声,姜在波,吴 春
(中山大学附属第三医院介入科,广东广州 510630)
肝细胞癌(hepatocellular carcinoma,HCC)是癌症相关死亡的第三大常见原因[1]。早期肝癌的治疗包括局部切除、肝移植、消融等根治性治疗。然而多数HCC 患者确诊时已是晚期,无法行根治性治疗,且多数晚期HCC 患者对放疗、化疗等姑息性治疗不敏感。为了更好地治疗HCC,基因治疗已被探索。Survivin 蛋白在HCC 中高表达,作为一种凋亡抑制蛋白,它可以抑制肿瘤细胞凋亡,加速肿瘤细胞增殖[2-4]。我们可利用Survivin siRNA在mRNA 水平沉默HCC 中Survivin 基因的表达,下调Survivin 蛋白的分泌,促进肿瘤细胞凋亡,达到抑制肿瘤生长的治疗效果。因此研制可将Survivin siRNA 高效、特异、靶向传输至肝癌细胞的载体十分重要。我们已成功合成多功能纳米载体RGD-PEI-PEI-SPION,体外细胞实验证实它不仅具备高效传输基因至肝细胞癌的能力,而且具备敏感的肝细胞癌MRI 显像能力[5]。基于上述研究基础,本课题组拟制备裸鼠肝癌模型,进一步活体研究RGD-PEG-g-PEI-SPION 靶向传输Survivin siRNA 至肝细胞癌抑制裸鼠肿瘤生长的效应并探讨RGD-PEG-g-PEI-SPION 对裸鼠肝癌的活体MRI 显像功能。
1 材料与方法
1.1 主要实验仪器与材料
RGD-PEG-g-PEI-SPION 按我们之前的报道合成[5];人肝癌细胞株Bel-7402(中国科学院生物化学与细胞生物学研究所提供);磷酸盐缓冲液PBS(美国Gibco公司提供);Survivin siRNA、阴性对照siRNA(siNC)、兔抗人Survivin抗体;凋亡检测试剂盒(德国Roche公司提供);GE 1.5T MRI扫描仪。
1.2 实验动物
裸鼠,体质量350~400 g,由中山大学动物中心提供,批号为SYXK(粤)2012-0081,并通过中山大学实验动物伦理委员会许可。
1.3 裸鼠Bel-7402 肝细胞癌模型
取4周龄雌性BALB/c裸鼠15~20 g。将100 μL含有4×106个细胞的Bel-7402 细胞悬液注入裸鼠右侧大腿皮下,5 d 后,在裸鼠右侧大腿皮下可见局部隆起,裸鼠皮下荷肝细胞癌模型制备成功,皮下肿瘤体积约为18~20 mm3。用游标卡尺测量肿瘤体积,测得肿瘤最大径(a)和最小径(b)。肿瘤体积(V)为:V=0.5ab2。
1.4 肿瘤生长抑制实验
为验证RGD-PEG-g-PEI-SPION 靶向传输Survivin siRNA 至肝癌细胞并抑制肿瘤生长的功效,将皮下荷瘤裸鼠随机分为5 组,每组15 只,分别经尾静脉注射不同的复合物溶液:第1 组为对照组,注射PBS 溶液;第2 组注射RGD-PEG-g-PEI-SPION/siRNA 复合物溶液;第3 组注射RGDPEG-g-PEI-SPION/siNC 复合物溶液;第4 组注射PEG-g-PEI-SPION/siRNA 复合物溶液;第5 组注射PEG-g-PEI-SPION/ siNC 复合物溶液。注射的Survivin siRNA 和阴性对照siRNA(siNC)剂量为1.6 mg siRNA/kg 体质量。所有的复合物均在N/P=10 条件下复合,每隔1 d 注射1 次,直至首次注射后的第25 天测量肿瘤体积。
1.5 苏木素/伊红染色
苏木素/伊红(hematoxylin &eosin,HE)染色步骤如下:①皮下荷瘤裸鼠被断颈处死,剥离皮下移植瘤,置入40 g/L多聚甲醛溶液固定。②60 ℃条件下浸入石蜡。③将肿瘤组织蜡块切成3 μm 厚度的薄片,展片后置入60 ℃烘焙箱烤片。④依次置入不同浓度乙醇溶液浸泡。⑤将肿瘤组织切片依次浸入苏木素溶液、盐酸酒精溶液及双蒸水。⑥将肿瘤组织切片浸入伊红溶液。⑦树脂盖玻片封片,光学显微镜下观察并实时拍照。
1.6 免疫组织化学染色
免疫组织化学染色步骤如下:①同上制备肿瘤组织切片。②将肿瘤组织切片依次浸入二甲苯溶液、不同浓度乙醇溶液。③将切片置入柠檬酸盐缓冲液,微波炉加热,滴加体积分数1% Triton溶液于肿瘤组织切片,再将切片置入过氧化氢酶阻断剂中浸泡,滴加正常山羊血清封闭液、兔抗人Survivin 抗体孵育过夜。④滴加偶联HRP 的山羊抗兔抗体,用二氨基联苯胺染色,将切片浸入苏木素溶液。⑤将切片依次浸入不同浓度乙醇及二甲苯溶液。⑥树脂盖玻片封片,光学显微镜下观察并实时拍照。
1.7 肿瘤细胞凋亡评估
利用过氧化物酶(peroxidase,POD)标记的原位细胞凋亡检测试剂盒对肿瘤组织的细胞凋亡进行评估:①同上制备肿瘤组织切片。②在切片上依次滴加蛋白酶K 溶液、体积分数0.1% Triton溶液、TUNEL 反应溶液、体积分数为3%过氧化氢溶液及Converter-POD 溶液。③在切片上依次滴加二氨基联苯胺溶液及苏木素溶液,室温下静置3 min。④树脂盖玻片封片,光学显微镜下观察并实时拍照。
1.8 肿瘤MRI 扫描
①皮下荷瘤裸鼠随机分为2 组,经腹腔注射体积分数10%水合氯醛(5 μL/g)麻醉,用GE 公司1.5T MRI 扫描仪、小动物线圈行肿瘤MRI 成像。②按组别经裸鼠尾静脉分别注射RGD-PEGg-PEI-SPION 和PEG-g-PEI-SPION 溶液(10 mg Fe/kg 体质量),3 h 后,再次行肿瘤MRI 成像。采集的T2WI 所用参数:TR/TE,2 000/88 ms;视场,70 mm;矩阵320 ×192;层厚1.0 mm。肿瘤T2WI的磁共振信号强度用30 mm2的感兴趣区(region of interest,ROI)进行评估。纳米载体注射后肿瘤MRI 信号强度与注射前肿瘤MRI 信号强度比较,得到标准化信号强度比值。
1.9 统计学分析
所有数据均用SPSS 25.0 统计学软件进行分析,计量资料以表示,两组间比较采用独立样本t检验,所有统计学分析均为双侧检验,以α=0.05 为检验标准,P<0.05 差异有统计学意义。
2 结果
2.1 肿瘤Survivin siRNA 的靶向治疗效果
经皮下荷瘤裸鼠尾静脉注射不同类型复合物,对肿瘤生长抑制情况进行评估,所有的复合物均在N/P=10 条件下复合。在首次注射25 d 后,注射RGD-PEG-g-PEI-SPION/siRNA、PEG-g-PEISPION/siRNA、RGD-PEG-g-PEI-SPION/siNC、PEGg-PEI-SPION/siNC 和PBS 溶液裸鼠的皮下移植瘤体积分别为(mm3):59±8、156±7、202±7、212±9 和220±8。与注射其它复合物裸鼠比较,注射RGDPEG-g-PEI-SPION/siRNA 的裸鼠显示出最佳的肿瘤治疗效果(P<0.05;图1)。这些实验数据不仅说明Survivin siRNA 能够有效的抑制肿瘤生长,而且证实RGD 修饰的复合物在体内也具有高效传输siRNA 至肝癌细胞的能力。
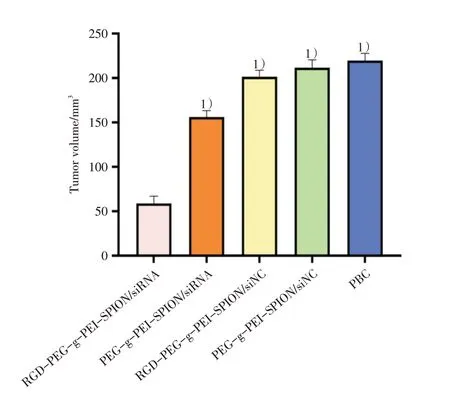
图1 肿瘤生长抑制评估Fig.1 Tumor growth inhibition assessment
2.2 各治疗组肿瘤组织学表现
不同类型复合物治疗组肿瘤的组织学改变经HE 染色进行分析。细胞核呈蓝色,细胞外基质与细胞浆呈红色(图2)。在所有的治疗组中,来源于RGD-PEG-g-PEI-SPION/siRNA 治疗组的肿瘤组织切片呈现出最大范围的肿瘤组织坏死,残存的肿瘤细胞数量相对最少。HE 染色结果与肿瘤生长抑制评估结果是一致的。
2.3 各治疗组肿瘤组织免疫组织化学染色和细胞凋亡表现
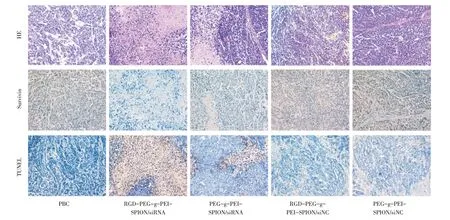
图2 各治疗组肿瘤组织的HE 染色、原位免疫组织化学染色和细胞凋亡评估Fig.2 HE staining,in situ immunohistochemical staining and cell apoptosis(TUNEL)evaluation of tumor tissues in each treatment group
原位免疫组织化学染色和细胞凋亡(TUNEL)评估用来研究不同治疗组肿瘤组织中Bel-7402 细胞凋亡和Survivin 蛋白质表达的关系。在原位免疫组织化学染色中,细胞核呈蓝色,棕褐色代表肿瘤组织中表达的Survivin 蛋白质(图2)。同来源于其它治疗组的肿瘤组织相比较,来源于RGDPEG-g-PEI-SPION/siRNA 治疗组的肿瘤组织切片在蛋白质表达强度和分布范围方面均呈现出最低水平的Survivin 蛋白质表达。在原位TUNEL 评估中,细胞核呈棕褐色的细胞为凋亡细胞。与来源于其它治疗组的肿瘤组织比较,来源于RGDPEG-g-PEI-SPION/siRNA 治疗组的肿瘤组织切片展现出数量最多的凋亡细胞。
2.4 肿瘤MRI 成像
行裸鼠皮下移植瘤的MRI 成像进一步研究载体RGD-PEG-g-PEI-SPION、PEG-g-PEI-SPION对肿瘤的靶向及显像能力。不同的聚合物载体经尾静脉注射入皮下荷瘤裸鼠体内。如图3A 所示:在注射载体前,所有的肿瘤在磁共振T2WI 均呈高强度信号。在尾静脉注射RGD-PEG-g-PEI-SPION 载体3 h 后,肿瘤于磁共振T2WI 可见明显的不均匀低强度信号(白箭头)。与这些结果一致,肿瘤的标准化MRI 信号强度显著下降至原来的51.6%±4.3%(图3B)。相对而言,尾静脉注射PEG-g-PEI-SPION 载体3 h 后,肿瘤于磁共振T2WI 信号强度未见明显改变(图3A),肿瘤的标准化MRI 信号强度仅降至原来的88.5%±3.2%(图3B)。
3 讨论
肝细胞癌是全球第五大最常见的癌症,也是导致癌症相关死亡的第三大原因[1]。近年来因病毒感染、糖尿病、肥胖及过多的酒精摄入,肝细胞癌的全球发病率持续上升。传统的外科治疗方式,如肝癌切除术、肝移植术、射频消融术等对早期的肝细胞癌患者具备良好的疗效。然而,绝大多数肝细胞癌患者由于就诊过晚,在确诊时已处于肝细胞癌晚期,已经无法采用上述治疗方式进行治疗,放疗及化疗对肝细胞癌患者也疗效甚微,基因治疗的发展为肝细胞癌患者带来了一丝曙光[6]。
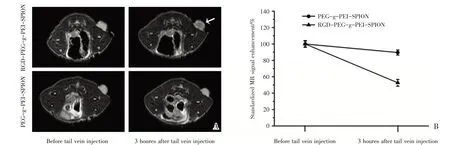
图3 肿瘤MR 成像Fig.3 Tumor MR imaging
作为一种凋亡抑制蛋白,Survivin 蛋白在细胞分裂期调控纺锤体的形成和着丝粒的准确附着,阻断细胞死亡的内源性途径,从而发挥其抑制细胞凋亡的生物学效应。此外,Survivin 蛋白还可以维护新生血管及处于结构重塑期血管的内皮细胞活性[7-8]。Survivin 蛋白在肝细胞癌中大量表达,通过上调Survivin 原癌基因的表达,促进肝癌细胞的增殖[7,9]。然而,在终末分化成熟组织中几乎没有Survivin 蛋白表达。因此,Survivin 蛋白可以作为肝细胞癌治疗的理想靶点。通过RNA 干扰技术,我们利用Survivin siRNA 靶向沉默Bel-7402 细胞中Survivin mRNA,抑制Survivin 蛋白质表达,诱导肿瘤细胞凋亡。如何逾越细胞内、外各种屏障将治疗基因高效的传输至靶细胞内,基因载体的研究是关键[10-11]。
在我们之前的研究中,我们将RGD 作为靶向肝癌细胞的配体,与聚合物载体相偶联,成功合成了靶向肝癌细胞的MRI 可视非病毒载体RGD-PEG-g-PEI-SPION[5]。体外细胞实验表明RGD-PEG-g-PEI-SPION 可以高效的传输治疗基因至肝癌细胞,并取得了令人满意的肝癌细胞MRI 成像效果。这项令人鼓舞的成功激励我们进一步探索肝癌的靶向基因治疗和MRI 定位研究。
在肿瘤生长抑制研究中,与注射其它复合物的裸鼠相比,经尾静脉注射RGD-PEG-g-PEISPION/siRNA 的皮下荷瘤裸鼠取得了最佳肿瘤治疗效果。来源于RGD-PEG-g-PEI-SPION/siRNA治疗组的肿瘤组织切片展示出最大范围的肿瘤组织坏死,残存的肿瘤细胞数目相对最少。体内肿瘤切片的原位免疫组织化学染色和TUNEL 分析进一步证实RGD 修饰的聚合物载体具备靶向高效传输Survivin mRNA 至肝癌细胞的功能。这些研究数据同时也表明传输入肝癌细胞内的Survivin mRNA 引起Survivin 基因表达下调,最终导致了体内高水平的肿瘤细胞凋亡。
因为SPION 能够在磁共振T2WI 产生低信号,因此可以利用MRI 扫描非侵袭性的观察载体RGD-PEG-g-PEI-SPION 对肝癌组织的靶向能力。皮下荷瘤裸鼠经尾静脉注射载体RGD-PEGg-PEI-SPION 后,皮下移植瘤较载体注射前的标准化MRI 信号强度显著降低。而经尾静脉注射载体PEG-g-PEI-SPION 后,较载体注射前皮下移植瘤的标准化MRI 信号强度无明显改变。上述结果表明RGD 修饰的复合物纳米颗粒对肝癌细胞有更高的基因转染效率,且具有良好的MR 显象能力。
我们经活体实验证实RGD-PEG-g-PEI-SPION 可将Survivin siRNA 靶向高效的传输至肝癌组织并取得良好的抗肿瘤疗效,而且具备敏感的肝癌MR 成像能力。RGD 修饰的非病毒载体在临床肝细胞癌的基因治疗方面及作为敏感的MRI 探针早期检测肝脏恶性肿瘤方面都极具广泛的应用前景和科研价值。

