剖宫产瘢痕妊娠期待治疗的不良妊娠结局分析
韩振艳,张 媛,侯红瑛
(中山大学附属第三医院产科,广东 广州 510630)
基于既往较高的剖宫产率,瘢痕子宫再次妊娠后发生瘢痕妊娠和胎盘植入风险的增加逐渐受到重视。剖宫产瘢痕妊娠(cesarean scar pregnancy,CSP)是指受精卵着床于前次剖宫产子宫切口瘢痕处的一种异位妊娠,定义限于早孕期[1-3]。如CSP 继续妊娠至中晚孕期,将发展至严重类型的胎盘植入,部分CSP 可在严密随访的期待治疗中获得活产婴儿。然而,CSP 自然病程常伴有子宫破裂、难治性产后出血、较高的切除子宫率甚至危及生命[3-7]。因此,不是所有的CSP 都适合继续妊娠,目前仍缺乏统一的标准来评估CSP 早期终止妊娠或期待治疗的风险[3,5-6]。本研究通过总结在中山大学附属第三医院诊断并要求期待治疗的3例CSP 的临床特点、超声表现及其不良妊娠结局,探讨CSP 与胎盘植入的关系、CSP 期待治疗的风险评估及穿透性胎盘植入的处理。
1 材料与方法
1.1 研究对象
回顾性收集2014 年1 月至2018 年12 月在中山大学附属第三医院就诊并通过产前超声诊断为CSP 的患者154 例,其中151 例选择终止妊娠,3 例在被充分告知继续妊娠的风险后,拒绝终止妊娠并仍坚决要求期待治疗。选择该3 例期待治疗的CSP孕妇为研究对象,分析其一般临床资料、CSP超声分型、影像学表现及妊娠结局。所有患者签署知情同意书。本研究获本院伦理委员会批准免除申报。
1.2 诊断标准
1.2.1 CSP 的诊断标准 主要依据超声检查,参考《剖宫产术后子宫瘢痕妊娠诊治专家共识(2016)》[1]中的典型超声表现:①宫腔内、子宫颈管内空虚,未见妊娠囊;②妊娠囊着床于子宫前壁下段肌层(相当于前次剖宫产子宫切口部位),部分妊娠囊内可见胎芽或胎心搏动;③子宫前壁肌层连续性中断,妊娠囊与膀胱之间的子宫肌层明显变薄、甚至消失;④彩色多普勒血流显像显示妊娠囊周边高速低阻血流信号。
1.2.2 CSP 的超声分型 根据妊娠囊生长方向及子宫下段前壁肌层厚度[1]分为:①Ⅰ型:妊娠囊部分着床于子宫瘢痕处,部分或大部分位于子宫腔内;妊娠囊与膀胱间的子宫肌层厚度>3 mm。②Ⅱ型:妊娠囊部分着床于子宫瘢痕处,部分或大部分位于子宫腔内;妊娠囊与膀胱间的子宫肌层厚度≤3 mm。③Ⅲ型:妊娠囊完全着床于子宫瘢痕肌层并向膀胱方向外凸;妊娠囊与膀胱之间的子宫肌层明显变薄、甚至缺失,厚度≤3 mm。
1.2.3 胎盘植入的诊断标准 ①术后病理诊断:胎盘绒毛异常侵入子宫肌层。②超声征象:胎盘内弥漫性或局灶性腔隙血流、胎盘后间隙消失、子宫肌层变薄或消失、胎盘床底部及子宫浆膜层血管增生等;当出现子宫浆膜层回声中断或变形、膀胱线(子宫浆膜层与膀胱腔直接的高回声区)中断或消失、胎盘回声突入膀胱腔及胎盘血管延伸至膀胱或其他器官时,往往提示穿透性胎盘植入[1-2]。③术中诊断:胎盘不能自然剥离,徒手剥离胎盘困难或发现胎盘与子宫肌壁粘连紧密无缝隙[7-11]。
2 结果
2.1 CSP 患者的一般临床资料
3 例CSP 患者的年龄29~32 岁;孕次3~6 次,产次1~3 次,既往子宫下段剖宫产次数1~2 次。首次超声诊断CSP 的孕周为6+2~7+4周;临床症状包括:反复阴道流血、血尿及剧烈腹痛(表1)。

表1 三例CSP 孕妇的一般临床资料Table 1 General characteristics of three cases of cesarean scar pregnancy
2.2 影像学结果
2.2.1 CSP 的超声表现和分型 阴道超声检查均提示妊娠囊部分或全部种植于子宫瘢痕处,第1例为Ⅰ型(图1 A),第2 例为Ⅱ型(图1 B),第3 例为Ⅲ型(图1 C)。
2.2.2 早中孕期超声表现 第1 例CSP(Ⅰ型)患者未行11~14 周的超声筛查;第2 例和第3 例CSP(Ⅱ和Ⅲ型)患者在孕12~13 周时彩超结果表现为早期胎盘植入,征象包括:胎盘内多个形态不规则的无回声区、胎盘后间隙消失、子宫肌层变薄或消失、胎盘床底部及子宫浆膜层血管增生等(图2A~C)。中孕期3 例患者的超声检查表现均为胎盘穿透性植入(表2),在上述早期胎盘植入声像的基础上,还出现了浆膜层连续性中断(图2D)、子宫肌层消失(图2E)及胎盘凸向膀胱等征象(图2F)。

图1 三例剖宫产瘢痕妊娠的早期超声分型Fig.1 Ultrasound types of three cases of Cesarean scar pregnancy in the first trimester
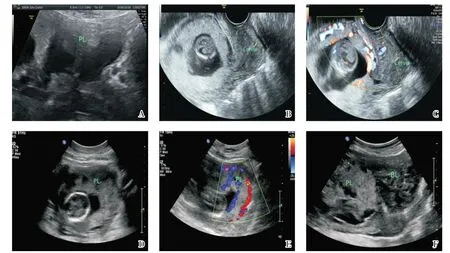
图2 三例剖宫产瘢痕妊娠早中孕期的超声表现Fig.2 Ultrasound findings of three cases of Cesarean scar pregnancy

表2 三例CSP 孕妇的术前中孕期的超声表现Table 2 Ultrasound findings of three cases of Cesarean scar pregnancy in second trimester before surgery
2.2.3 中孕期MRI 表现 第一例CSP 患者(Ⅰ型)在孕24+6周的MRI 表现为子宫中下段前壁局限性凹凸不平,肌层信号不连续,浆膜面模糊;附着该处的胎盘局限性增厚,与肌层分界模糊,并突出子宫轮廓外(图3 A、B)[2]。

图3 中孕期穿透性胎盘植入的MRI 表现Fig.3 Sagittal-section of MRI showing intrauterine pregnancy with placenta percreta
2.3 妊娠结局
2.3.1 终止妊娠的原因及手术方式 3 例CSP 患者均在中孕期出现严重并发症。第1 例患者(CSP Ⅰ型)在孕7+1周~24+1周之间反复出现少量阴道流血,在孕24+4周时阴道流血增加如月经量,予择期行剖宫取胎术+病灶切除+子宫重建修术。第2 例患者(CSP Ⅱ型)从孕23 周开始出现反复血尿,孕24+3周时出现大量血尿并膀胱血块填塞而行急诊剖腹探查+剖宫取胎+子宫次全切除术。第3 例患者(CSP Ⅲ型)在孕16+3周时突发剧烈腹痛,伴头晕、大汗淋漓等休克症状,超声诊断胎盘植入及腹腔内积液,考虑子宫破裂而行急诊剖腹探查+剖宫取胎+病灶切除+子宫修补术。3 例CSP 患者在术中均被证实为穿透性胎盘植入,其中1 例行子宫切除获得术后病理确诊(表3)。
2.3.2 术中止血的方式 1 例CSP 择期手术使用了双侧子宫动脉栓塞,另外2 例急诊手术未行血管介入手术。术中出血均超过2 500 mL,止血方式包括:止血带捆绑子宫下段、子宫局部压迫缝合(方形缝合、环形缝合、半环形缝合)、宫腔填塞及盆腔填塞(表3)。
2.3.3 妊娠结局 3 例CSP 均无活产婴儿,无孕产妇死亡。1 例因盆腔填塞纱布止血需要预留取出窗口至伤口愈合不良,术后第11 天行二期清创缝合。其余均未发现近远期并发症。
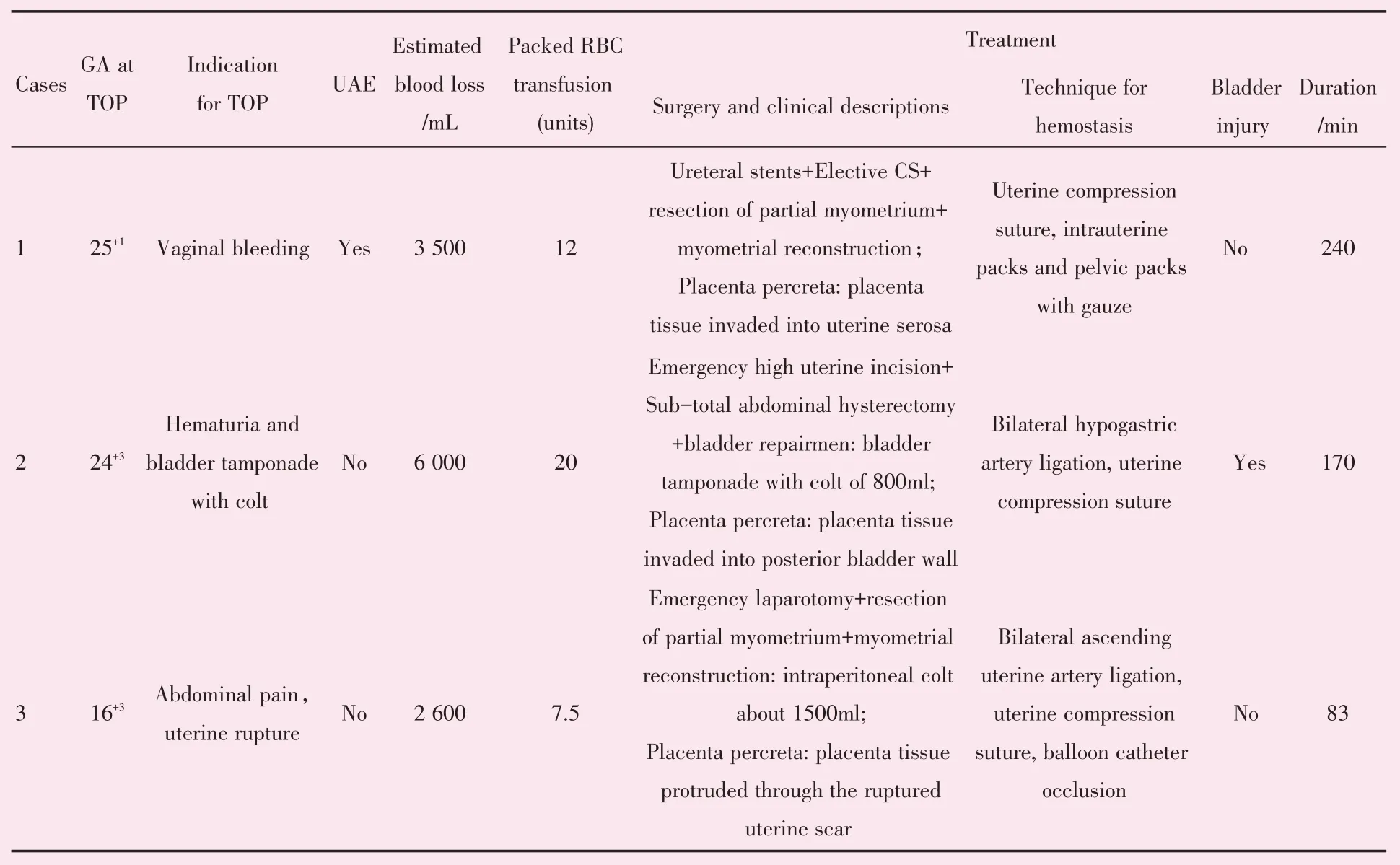
表3 三例CSP 孕妇的妊娠结局[3]Table 3 Outcome of three cases of Cesarean scar pregnancy
3 讨论
3.1 CSP 与胎盘植入的关系
胎盘植入是指胎盘绒毛侵入子宫肌层,根据侵入肌层的深度可分为胎盘粘连(placenta accreta)、胎盘植入(placenta increta)及穿透性胎盘植入(placenta percreta),目前国际上常用胎盘植入性疾病(placenta accrete spectrum disorders,PAS)来涵盖此3 种植入的类型[7,9-11]。PAS 的具体发病机制不明,术后病理表现为底蜕膜受损或缺失及胎盘绒毛直接侵入子宫肌层[7-11]。CSP 是指受精卵着床于前次剖宫产子宫切口瘢痕处,缺少蜕膜的瘢痕往往导致绒毛进一步侵入子宫肌层,发展为PAS[2,12-13]。Timor-Tritsch[12]等总结了37 例CSP 和21 例早期PAS 患者的超声及病理结果,发现CSP与早期PAS 的组织学表现基本一致,均为绒毛侵入子宫肌层并缺乏蜕膜层,并提出CSP 是PAS 的早期表现。
目前,对于CSP 自然病程的了解主要来源于小样本的回顾性病例报道。国内有关CSP 期待治疗的临床研究较少,陈敦金[14]等报道了11 例CSP 患者在中晚期均发生了严重类型的PAS;黄苑铭[15]等报道了6 例CSP 在中孕期通过超声或MR 诊断为PAS。本研究中3 例CSP 的中孕期超声均表现为穿透性胎盘植入,其中2 例被诊断为早期PAS。Cali 等[6]系统性回顾分析了52 例CSP 的期待治疗过程,其中40 例继续妊娠至晚孕期,30 例发生了PAS(包括17 例为穿透性胎盘植入)。因此,CSP 与PAS 的关系密切相关,但由于两者定义所属的孕周不同,从CSP 发展至PAS 是一个动态连续的过程,对于CSP 的期待治疗应更早关注PAS 的风险。
3.2 CSP 期待治疗的风险评估
基于CSP 的不良妊娠结局,国内外指南关于CSP 的诊疗原则仍是早诊断、早治疗及早清除[1,3-4,7,11]。近年来,由于漏诊或患者自身要求继续妊娠至中晚期而获得活产的个案报道增多,有学者建议在患者强烈要求并充分知情同意的条件下,可以谨慎选择低风险类型的CSP 在严密随访中继续妊娠[6,14,16-18]。文献报道,大部分CSP 在期待治疗的过程中进展为严重类型的PAS,最终导致大出血、子宫破裂、周围器官损伤、切除子宫甚至危及生命[3-7,19]。因此,并非所有的CSP 都适合继续妊娠,如何选择适宜期待治疗的CSP 类型是目前研究的焦点。
通过早孕期超声评估妊娠囊、子宫瘢痕及子宫前壁间的相互关系对CSP 的临床处理具有重要的参考价值,然而,目前仍缺乏统一的标准来评估早期终止妊娠或期待治疗的风险。国内专家共识主张根据妊娠囊的生长方向及子宫前壁肌层的厚度分为Ⅰ、Ⅱ及Ⅲ型[1],有研究提出CSPⅠ型和Ⅱ型可能适宜期待治疗[14]。Vial[20]建议根据妊娠囊种植的位置及生长方向分为内生型及外生型,内生型的CSP 可期待治疗至中晚孕期而获得活产,但大出血的风险仍然很高;而外生型的CSP 往往在早孕期即发生子宫破裂。最近亦有学者[16]提出根据妊娠囊前后径、瘢痕及子宫内膜线三者的交叉点来预测CSP 与胎盘植入类型的关系,当2/3 的妊娠囊前后径位于子宫内膜线与瘢痕之间(COS-1 型)时,将有83.3%发生穿透性胎盘植入,其期待治疗的风险较高。根据早孕期超声表现,本研究中3 例CSP 患者分别属于Ⅰ型(内生型)、Ⅱ(外生型)及Ⅲ(外生型),但最终都进展为穿透性胎盘植入,分别导致反复出血、膀胱内大量出血及子宫破裂等不良妊娠结局,其中Ⅲ(外生型)的病例出现并发症的时间更早。因此,无论根据何种分型及分类方式,都很难准确预测CSP 继续妊娠的结局,应充分告知患者及其家属期待治疗的风险及预测手段的局限性,进行个体化处理,不可盲目的期待继续妊娠。
3.3 穿透性胎盘植入的处理
文献报道[6-7,11],超过一半的CSP 在期待治疗的过程中将发展为穿透性胎盘植入,而穿透性胎盘植入是PAS 中风险最大的一种类型,常合并难治性大出血,孕产妇死亡率可高达7%[7,11]。穿透性胎盘植入的处理需要多学科协作团队进行全面的术前评估、术中合作及术后随访,并配备必要的紧急预防措施,以最大限度的降低手术风险及减少远期并发症[7-11,21-23]。
胎盘原位保留的子宫切除是目前国际指南推荐的穿透性胎盘植入的处理方式,也称非保守手术[7,10-11]。借助术中超声选择避开胎盘及血窦的剖宫产切口,娩出胎儿后不剥离胎盘,在胎盘插入处结扎脐带。之后,根据切除子宫的时机,分为剖宫产术中即刻子宫切除和剖宫产术后延期子宫切除。穿透性胎盘植入的子宫下段更薄,血窦更丰富,加上盆腔大量的深部新生血管,使剖宫产术中切除子宫更加复杂而艰难。短期的胎盘原位保留可以减少胎盘及子宫的血供,缓解盆腔充血,从而降低子宫切除的难度及手术并发症。同时,延期子宫切除也推荐用于术中意外发现胎盘植入而需要转运至有经验的中心的情况。然而,即使延期子宫切除有很多理论上的优势,但由于大部分穿透性胎盘植入术中出血较多,目前文献报道仍以剖宫产术中切除子宫为主[7,9-11,24-25]。
对于强烈要求保留生育能力的女性,在条件允许下可选择保留子宫的保守手术方式,包括胎盘原位保留术和子宫局部病灶(胎盘植入部分)切除及修补术[7-11,21,26]。胎盘原位保留是指等待其自行吸收或剥离,也称为期待治疗,可用于胎盘广泛穿透性植入、术中出血少并愿意接受密切随访治疗的患者。对于植入范围不大的患者,可以谨慎剥离非植入部分的胎盘,再局部切除植入的子宫壁甚至部分膀胱组织,最后重建子宫及膀胱。多个中心报道了不同的手术步骤,包括“一步法”[7]、“3-P 法”(triple-P procedure)[27]和“逐步法”(stepwise approach)[28]等,需要根据手术者的经验及患者的具体情况而谨慎选择。保守手术最大挑战是剥离胎盘后开放的血窦及薄弱的子宫下段导致的难治性大出血。目前常用的止血方式包括止血带捆绑子宫下段、局部缝合、血管结扎、血管球囊阻断或栓塞、宫腔填塞等[7-8,10-11,21,24]。本研究中3 例穿透性胎盘植入患者均要求保留子宫,术中剥离胎盘导致出血较多,其中1 例保守手术成功;1 例因为胎盘广泛植入膀胱而无法保留子宫;1 例术后宫腔内活动性出血,二次进腹予以宫腔填纱及盆腔填纱联合止血,最终保留了子宫。宫腔填纱联合盆腔填纱可以内外双重压迫子宫创面,其止血效果比单独使用宫腔填塞更确切,但文献鲜有报道,可作为保守手术出现难治性大出血的一种止血方式。
综上所述,CSP 的自然病程常合并严重的不良妊娠结局,由于缺乏统一的风险评估标准,不可盲目的选择期待治疗。CSP 与PAS 关系密切,在期待治疗的过程中应警惕早期PAS 的发生。对于穿透性胎盘植入的处理,需要建立多学科协作团队做好围手术期的管理,根据术中情况谨慎选择手术方式及止血方法,以最大限度的降低不良妊娠结局的发生率。

