房颤患者中性粒细胞CD11b变化及与左房内径的相关性
袁桂仪,周淑娴,农美丹,张玉玲,黄波水
(1.中山大学孙逸仙纪念医院心内科,广东广州 510120;2.柳州市人民医院心内科,广西柳州 545000)
心房颤动(atrial fibrillation,AF)是临床上最常见的心律失常,其发生发展与众多因素有关[1]。房颤可引起血流动力学障碍和血栓栓塞事件,增加心力衰竭及脑卒中的发生。近年发现炎症[2]可能参与了房颤的发生与维持,亦可能参与了房颤血栓的形成,白细胞激活是炎症反应的重要标志,推测房颤中存在白细胞激活。CD11b 是白细胞激活的表面标志,白细胞激活后CD11b 表达上调,同时CD11b 可介导白细胞与内皮细胞结合,促进白细胞穿越内皮细胞层迁移至炎症部位引起组织损伤[3]。目前房颤患者外周血白细胞CD11b 表达变化的研究尚少,中性粒细胞CD11b 表达变化国内尚未见相关报道。
1 材料与方法
1.1 研究对象
2017 年3 月至2018 年3 月中山大学孙逸仙纪念医院心血管内科住院病人,既往或入院期间心电图或24 h 动态心电图(Holter)证实存在心房颤动患者纳入房颤组;同期于心血管内科住院无房颤发作史,入院后经心电图或Holter 检查再次证实的窦性心律患者纳入窦律组。排除采血样时体温大于37.5 ℃或近1 月内有感染、近3 月内发生急性冠脉综合征或急性血栓栓塞性疾病、心肌病、先天性心脏病、慢性炎症性疾病、自身免疫结缔组织疾病、血液系统疾病、甲亢、恶性肿瘤、严重肝肾功能损害、左室射血分数小于50%、心功能(NYHA分级)Ⅲ或Ⅳ级、心脏外科手术史、近2 月内有严重外伤或手术史、近1 月内用过糖皮质激素患者。本研究获中山大学孙逸仙纪念医院伦理委员会批准,已取得患者知情同意。
1.2 研究方法
1.2.1 收集患者的人口学和合并症资料 包括年龄、性别、吸烟、血脂、体质量指数(body mass index,BMI,kg/m2)、高血压、糖尿病、冠心病、心脏瓣膜病、脑梗塞史、抗血小板药、他汀类药物、华法林、血管紧张素转化酶抑制剂/血管紧张素受体拮抗剂(ACEI/ARB)使用情况。按照2006 年《心房颤动治疗指南》[4]分类方法将房颤分为三种类型,包括阵发性房颤:房颤发作能自行终止,多数发作持续时间≤7 d;持续性房颤:房颤发作持续时间>7 d,不能自行终止,药物复律或电复律后能终止;永久性房颤:多数房颤发作时间>1 年,药物复律及电复律未成功或复律后24 h 内复发或未曾考虑复律。计算非瓣膜性房颤卒中危险CHA2DS2-VASc积分[5]:年龄≥75岁、卒中/TIA/血栓栓塞史(符合一项为2 分);年龄65~74 岁、慢性心衰、高血压、糖尿病、女性、血管疾病(符合一项为1 分),根据CHA2DS2-VASc 积分分为低危组(0 或1分)、中危组(2或3分)和高危组(4或4分以上)。
1.2.2 采血时间 所有入选研究病人入院后次日空腹于肘静脉处分别予0.2%EDTA 抗凝管抽血2 mL,共两管,待测CD11b 及血细胞数;再予干燥管抽血4 mL,6 h 内以1 500 ×g离心20 min,分离血清,-80 ℃冰箱保存,待测hs-CRP。阵发性房颤病人若住院期间房颤发作,再次于房颤发作时及发作终止24 h 内采血。
1.2.3 检测方法 采用流式细胞仪(FACSCalibar,美国BD 公司)测定中性粒细胞CD11b 表达水平。采血后4 h 内行流式检测。在流式专用试管中分别加入10 μL PE 标记的鼠抗人CD11b 抗体(美国BD 公司)和小鼠IgG 同型对照抗体(美国BD公司),并每管加入抗凝血50 μL,室温避光孵育20 min,加1 mL 红细胞裂解液裂解红细胞10 min后,1 500×g离心5 min,弃上清,加2 mL PBS 再洗涤1 次,弃上清后重悬细胞上机检测。依据前向及侧向散射光,圈粒细胞设R1 门,圈单核细胞设R2 门。以PE 标记的小鼠IgG 同型对照管为对照。用Cell Quest 软件分析结果,每管收集1 万个细胞,结果以平均荧光强度表示;所有入选病人住院期间常规超声心动图检查,测量左室收缩末期左心房前后径;应用芬兰Orion 诊断公司hs-CRP试剂盒及免疫透射比浊法(immunoturbidimetric assay,ITA)测定血清hs-CRP 水平。
1.3 统计学方法
正态分布资料以均数±标准差描述,非正态分布资料以中位数及四分位数间距M(P25~P75)描述。服从正态分布且方差齐性的计量资料使用两独立样本的t检验,不服从正态分布的计量资料采用秩和检验。两组定性资料比较使用卡方检验计算卡方值或采用Fisher 确切概率。服从正态分布且方差齐性的多组计量资料比较采用方差分析法,方差分析中两两比较采用LSD-t法,方差不齐时采用秩和检验。多组定性资料比较采用卡方检验。房颤影响因素采用多因素Logistic 回归分析。相关性分析采用Spearson 相关,等级资料的相关分析采用Spearman 秩相关。用SPSS 23.0 软件进行统计分析,双侧检验,P<0.05 为差异有统计学意义。
2 结果
2.1 一般情况
共纳入房颤组85 例,年龄37~82 岁,男性35例(41.2%),女性50 例(58.8%),阵发性房颤36 例(42.3%),持续性房颤26 例(30.5%),永久性房颤23 例(27.1%);窦律组57 例,年龄35~78 岁,男性21 例(36.8%),女性36 例(63.2%);心功能(NYHA分级)Ⅰ~Ⅱ级。所有房颤患者心脏彩超均未见左房血栓。房颤组心脏瓣膜病比例(31.8%)高于窦律组(1.8%)(P<0.01),高血压病比例(58.8%)高于窦律组(38.6%)(P<0.05),余资料无统计学差异(表1)。
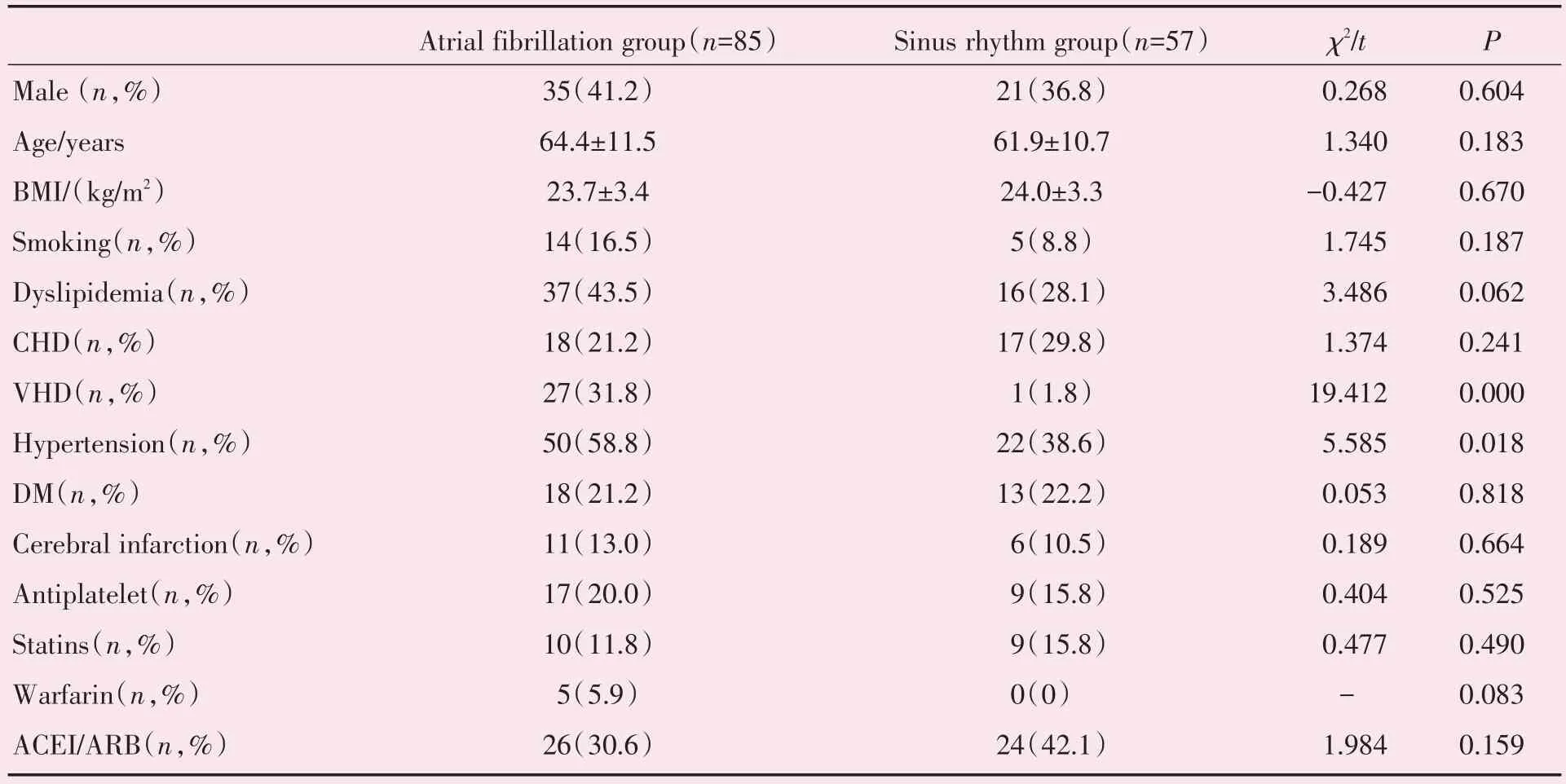
表1 房颤组与窦律组患者临床特点Table 1 Clinical characteristics of atrial fibrillation group and sinus rhythm group
2.2 房颤组与窦律组白细胞数、中性粒细胞数、单核细胞数、血小板数、hs-CRP、中性粒细胞CD11b 及左房内径的比较
房颤组hs-CRP 水平、中性粒细胞CD11b 表达均高于窦律组(P均<0.01);左房内径大于窦律组(P<0.01)。房颤组与窦律组白细胞数、中性粒细胞数、单核细胞数、血小板数均无统计学差异(表2)。
2.3 多因素Logistic 回归分析
将是否为房颤做因变量,心脏瓣膜病、高血压病、hs-CRP、中性粒细胞CD11b、单核细胞CD11b及左房内径做自变量引入Logistic 回归方程,结果示心脏瓣膜病、中性粒细胞CD11b、hs-CRP 及左房内径是房颤的独立影响因素(表3)。
2.4 房颤亚组及窦律组临床特点
本研究阵发性房颤36 例,持续性房颤26 例,永久性房颤23 例,窦律组57 例。永久性、持续性、阵发性房颤心脏瓣膜病的比例高于窦律组(P均<0.01),永久性房颤心脏瓣膜病的比例高于持续性及阵发性房颤(P均<0.01),余资料四组间无统计学差异(表4)。
2.5 阵发性房颤(未发作时)、持续性、永久性房颤及窦律组间中性粒细胞CD11b及左房内径的比较
中性粒细胞CD11b 水平在永久性房颤组高于窦律组及阵发性房颤组(P均<0.05);在持续性房颤组高于窦律组及阵发性房颤组(P均<0.05);
永久性与持续性房颤、阵发性房颤与窦律组间中性粒细胞CD11b 表达水平无统计学差异。永久性、持续性、阵发性房颤左房内径均大于窦律组(P均<0.05),永久性房颤左房内径大于阵发性及持续性房颤(P均<0.05),持续性房颤左房内径大于阵发性房颤(P<0.05;表5)。超声心动图显示房颤患者左心房增大(图1)。
表2 房颤组与窦律组白细胞数、中性粒细胞数、单核细胞数、血小板数、hs-CRP、中性粒细胞CD11b 及LAD 的比较Table 2 Comparison of leukocyte,neutrophil,monocyte,platelet,hs-CRP,PMN-CD11b,LAD between atrial fibrillation group and sinus rhythm group [,median(IQR)]
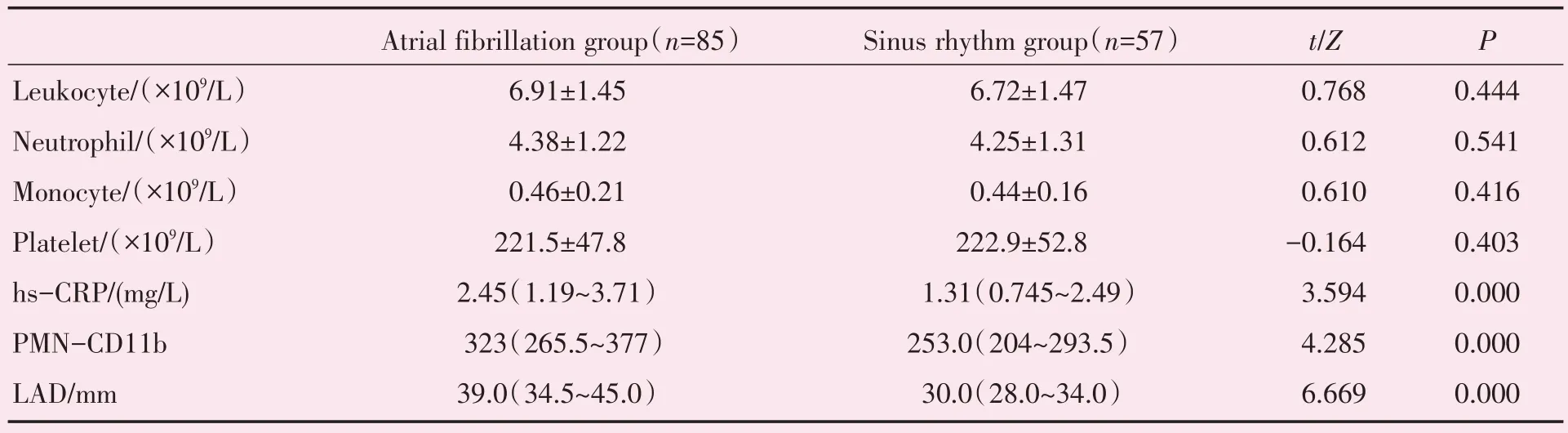
表2 房颤组与窦律组白细胞数、中性粒细胞数、单核细胞数、血小板数、hs-CRP、中性粒细胞CD11b 及LAD 的比较Table 2 Comparison of leukocyte,neutrophil,monocyte,platelet,hs-CRP,PMN-CD11b,LAD between atrial fibrillation group and sinus rhythm group [,median(IQR)]
hs-CRP:high sensitive C-reaction protein;PMN-CD11b:Neutrophil CD11b;LAD:left atrium diameter
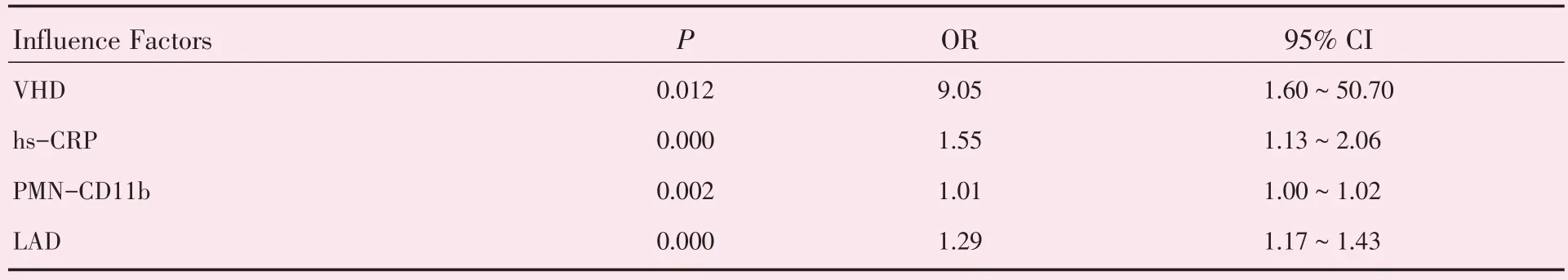
表3 房颤影响因素多因素Logistic 回归分析Table 3 Logistic regression analysis of atrial fibrillation
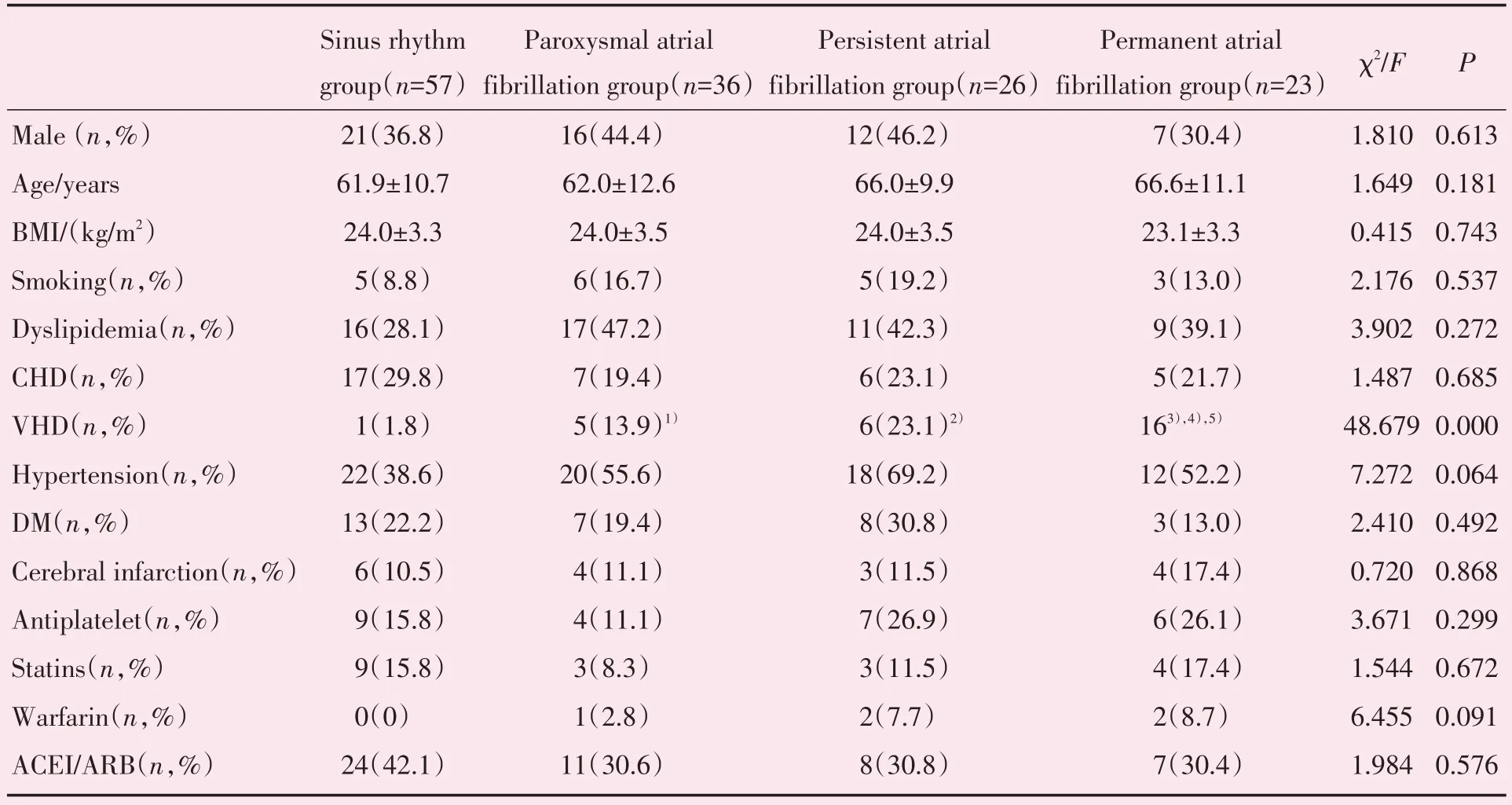
表4 阵发性、持续性、永久性房颤及窦律组临床特点Table 4 Clinical characteristics of paroxysmal atrial fibrillation,persistent atrial fibrillation,permanent atrial fibrillation
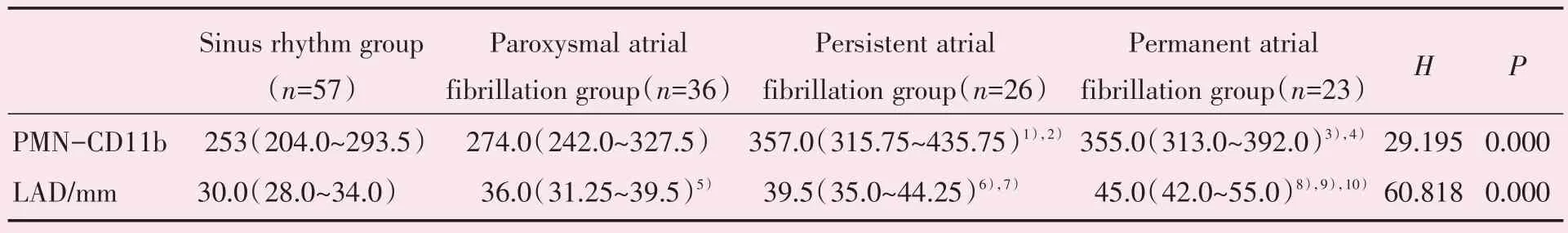
表5 阵发性、持续性、永久性房颤及窦律组中性粒细胞CD11b 及LAD 的比较Table 5 Comparison of PMN-CD11b and LAD in paroxysmal atrial fibrillation,persistent atrial fibrillation,permanent atrial fibrillation
图1 超声心动图显示房颤患者左心房增大Fig.1 Increase of left atrium diameter in patients with atrial fibrillation by ultrasonic cardiogram
2.6 房颤患者中性粒细胞CD11b 与左房内径相关性
房颤患者中,中性粒细胞CD11b 与左房内径存在相关性(r=0.449,P<0.01)。
2.7 房颤患者根据CHA2DS2-VASc 积分判定脑栓塞风险低危、中危、高危组间中性粒细胞CD11b比较
CHA2DS2-VASc 积分低危组30 例(35.3%),中危组34 例(40.0%),高危组21 例(24.7%);高危组中性粒细胞CD11b 表达高于中危组及低危组(P均<0.05),中危组及低危组间无统计学差别(表6)。
3 讨论
3.1 CD11b 与房颤的关系
白细胞激活是炎症反应的重要标志,白细胞激活表现之一为其表面CD11b 的表达及活性增加。CD11b 属于整合素家族,是介导细胞粘附所必需的粘附分子,主要参与细胞粘附、炎症、细胞的伸展和移动、血栓的形成、细胞介导的细胞毒作用,在机体的炎症、免疫反应中起重要作用。

表6 CHA2DS2-VASc 积分低危、中危、高危组间中性粒细胞CD11b 比较Table 6 Comparison of PMN-CD11b in low risk,intermediate risk,high risk by CHA2DS2-VASc
目前有研究发现房颤的发生与白细胞激活有关。Lamm 等[6]研究253 例冠脉搭桥或心脏瓣膜换瓣术患者,术后99 例出现房颤,两组术前白细胞数无差别,术后房颤组的白细胞数高于窦律组,且房颤组出现房颤及白细胞高峰时间均为术后第2 天,多因素回归分析发现心脏外科手术后白细胞数的升高为术后房颤发生的独立预测因素。Abdelhadi 等[7]研究了72 例心脏外科手术患者,26 例术后出现房颤,房颤组围手术期间中性粒细胞数及单核细胞数高于窦律组,且房颤组单核细胞CD11b水平明显高于窦律组,而中性粒细胞CD11b水平与窦律组无明显统计学差异(P=0.057)。作者认为该研究未能发现中性粒细胞CD11b 水平升高可能由于中性粒细胞激活后,高表达的CD11b介导中性粒细胞粘附于血管内皮细胞并浸润血管外炎症组织,从而使循环中高表达CD11b 的中性粒细胞减少,亦可能由于该研究样本量不够大尚不足于发现两组间的差异。此外,有研究[8]发现肺静脉隔离术(PVI)后6 个月房颤未复发的患者中性粒细胞及单核细胞CD11b 表达相比术前1 天明显下降,而同样行PVI 但房颤复发患者未发现CD11b 下降。同时研究显示房颤发作时各种炎症因子基因表达增强[9-10]。
本研究发现房颤组中性粒细胞CD11b 表达水平明显高于窦律组,多因素分析发现中性粒细胞CD11b 是房颤的独立影响因素,提示房颤患者存在白细胞激活,与既往的研究一致。
3.2 CD11b 在房颤亚组间的变化
目前关于房颤亚组中炎症水平的变化,研究结果不完全一致。Gedikli 等[11]研究了30 例新发的阵发性房颤患者,24 例持续性房颤患者及31 例永久性房颤患者,发现三组的CRP 及IL-6 水平均高于对照组,而三组间的CRP 及IL-6 水平无统计学差异。Pfluecke[12]发现不管是持续性房颤还是处于窦性心律的阵发性房颤合并主动脉瓣狭窄的患者中,单核细胞表达的CD11b 是窦性心律患者的两倍。本研究发现持续性及永久性房颤中性粒细胞CD11b 水平高于阵发性房颤(房颤未发作时)及窦律组,持续性及永久性房颤两组间中性粒细胞CD11b 水平无差别,阵发性房颤(房颤未发作时)与窦律组中性粒细胞CD11b 水平无明显差别,提示房颤发作与炎症密切相关。本研究样本例数有限,且存在一定的基础心脏疾病的影响,因而结果有待增加样本量进一步研究。
3.3 CD11b 与左房内径的关系
本研究发现房颤患者左房内径大于窦律者,阵发性、持续性及永久性房颤的左房内径逐渐增大,且各组间存在统计学差异。房颤患者左房增大,提示存在心房结构重构,左房增大是房颤发生与维持的独立危险因素[13]。房颤心动过速时,左室射血分数下降,左房压增加,反复发作的房颤可以导致心房电重构、结构重构,引起“房颤致房颤”效应[14],同时房颤存在的基础器质性心脏病亦参与心房结构重构[15]。本研究进一步分析发现房颤患者中性粒细胞CD11b 水平与左房内径存在相关性,提示炎症与房颤心房结构重构相关。
研究发现房颤心房组织中存在炎症,同时存在心房组织的变化。Frustaci 等[16]在12 名阵发性孤立性房颤患者的心房肌活检中,发现存在单核细胞浸润,心肌细胞坏死、纤维化。研究[17]发现房颤心房组织中IL-6 及TNF-α蛋白表达量高于对照组。Todd 等[18]对14 例孤立性房颤患者的心房组织活检中,亦发现心房组织存在心肌细胞肥大,肌细胞内肌丝溶解,细胞间质减少,细胞核的肿胀等改变。炎症与房颤左房内径的相关性进一步为以上研究所证实。
炎症反应的最重要功能是将炎症细胞输送到炎症局部,白细胞浸润是炎症反应最重要的特征。房颤患者外周血中性粒细胞CD11b 水平升高,同时房颤心房组织中存在中性粒细胞及单核细胞浸润,考虑中性粒细胞及单核细胞在外周血中激活后,通过Mac-1 介导与内皮细胞表面ICAM-1 粘附并穿越内皮层,在炎症趋化因子作用下迁移到心房组织中。国内郭志祥等[19]研究提示心脏瓣膜病伴房颤患者心房组织中CD11b 基因表达水平高于对照组亦支持此观点。活化的中性粒细胞到达心房组织后,合成并分泌趋化因子和细胞因子,招募巨噬细胞、T 细胞及中性粒细胞本身等到达炎症部位,同时释放弹性蛋白酶和氧自由基等造成组织损伤,引起心房结构改变,活化的单核细胞到达心房肌组织后可转化为巨噬细胞,参与心房组织慢性炎症反应。
3.4 CD11b 与房颤血栓形成的关系
CHA2DS2-VASc 积分是房颤血栓栓塞的危险分层,CHA2DS2-VASc积分越高,提示房颤患者将来发生血栓栓塞事件的风险越大。Maehama 等[20]分析了165例非瓣膜性心房颤动患者,发现CHA2DS2-VASc 积分高危组CRP 水平高于中危及低危组,而CHA2DS2-VASc 积分高危组左房血栓发生率高于中危及低危组,提示CRP 可能与房颤血栓形成有关。Crandall 等[21]研究亦发现CHA2DS2-VASc 积分越高CRP 水平越高。同时发现单核细胞与中性粒细胞CD11b 表达增加与房颤患者左心房血栓形成有关[22]。
本研究发现CHA2DS2-VASc 积分高危组中性粒细胞CD11b 表达高于中危组及低危组,提示炎症水平对房颤血栓栓塞危险分层可能有一定指导意义。有研究提示房颤患者CRP与纤维蛋白原、IL-6 与组织因子存在相关性,提示炎症可能通过促进凝血因子激活而促进房颤血栓前状态的形成[23]。本研究发现CHA2DS2-VASc 积分高危组中存在中性粒细胞激活,而激活后的中性粒细胞可产生血管活性物质,加速氧化应激过程,促进纤维蛋白原沉积等多种生物效应而参与血栓形成。
房颤与炎症密切相关,炎症可能参与了房颤的发生与维持,而抗炎治疗能缩短房颤的发作持续时间及降低房颤的复发率。目前,房颤的抗心律失常药物治疗效果欠佳,存在一定的副作用,且房颤的射频消融术治疗存在一定的复发率,因而房颤的炎症作用机制可能为将来房颤的治疗提供一个新的潜在治疗靶点[24]。目前抗炎治疗是否能减少房颤患者的发作及复发尚缺乏随机、对照、双盲、大规模的临床试验研究,而足够剂量的他汀类药物是否能抑制心房电重构及结构重构亦有待进一步研究。

