p16基因缺失在成人ph阴性急性B淋巴细胞白血病中的临床意义
李玉玲,刘晓力,许娜,唐加明,陆紫媛△
细胞周期性激酶抑制因子A(CDKN2A)位于9p21.3 区域,是重要的抑癌基因,其编码p16(INK4a)和p14(ARF)两种周期抑制蛋白。其中p16通过抑制CDK4/6-cyclinD 复合物激酶活性,使视网膜母细胞瘤(Rb)蛋白呈持续高磷酸化的活化状态,从而抑制细胞由G1期进入到S期,导致细胞周期停滞[1]。目前已在食管鳞状细胞癌、肝癌、膀胱癌等恶性肿瘤中发现p16基因缺失,p16基因缺失同时也是急性B淋巴细胞白血病(B-ALL)中最常见的拷贝数改变(CNAS)[2]。有研究证实p16基因缺失是B-ALL的独立不良预后因素[3],p16基因缺失影响费城染色体(Ph)阳性B-ALL对酪氨酸激酶抑制剂(TKI)的治疗敏感性,使Ph阳性B-ALL患者的预后变差[4]。Ph阴性B-ALL 与Ph 阳性B-ALL 具有很大的异质性,但目前尚少见p16 基因缺失对成人Ph 阴性B-ALL患者预后影响的相关报道。本研究通过大样本量分析p16 基因缺失的成人Ph 阴性B-ALL 患者的临床特征、免疫分型特点及预后。
1 资料与方法
1.1 一般资料 选择2011年1月—2018年6月在广州医科大学附属第三医院和南方医科大学南方医院血液内科确诊为Ph阴性的B-ALL患者。纳入标准:(1)初诊时行骨髓细胞形态学、细胞化学、免疫分型、细胞遗传学检查确诊为急性B-ALL患者。(2)细胞遗传学检查为Ph阴性。排除标准:(1)未接受规律治疗者。(2)中途失访者。(3)由于个人原因未行所有检查者。按上述标准最终纳入210例患者(广州医科大学附属第三医院78例,南方医院132例)为研究对象,其中男125 例,女85 例,年龄 18~63 岁,中位年龄为 32.5 岁。根据初发时检测的p16基因状态分为p16基因缺失组(61例)和无缺失组(149例)。
1.2 方法
1.2.1 临床资料收集 查阅患者初次诊断时血常规、肝脾B超结果,收集血常规中白细胞计数(WBC)及B超中肝脾肿大情况、骨髓细胞形态学结果中的骨髓原始细胞比例、免疫分型、细胞遗传学等临床资料。
1.2.2 免疫分型检测 采用直接免疫荧光法,3 种荧光抗体荧光素异硫氰酸荧光素(FITC)/红蛋白(PE)/多甲藻叶绿素蛋白(PerCP)、红细胞裂解液、鞘液(PBS)均购自美国Bection Dickinson 公司,使用FACSCantoⅡ流式细胞仪(480 nm 氩离子为激发光源,美国Bection Dickinson公司)进行检测。所检测抗原包括:白细胞抗原34(CD34)、人白细胞分化抗原DR(HLA-DR)、CD45、末端脱氧核苷酸转移酶抗原(TdT)、CD117、CD10、CD19、CD20、CD22、CD13、CD14、CD15、CD33、CD2、CD3、CD7、CD56、CD64、CD11b、胞浆髓过氧化物酶抗原(cMPO)及白细胞胞浆抗原79a(cCD79a)。取肝素抗凝的白血病患者骨髓血2 mL,对每一份标本设对照管和试验管。分别加入肝素抗凝全血100 μL,3种荧光标记抗体各20 μL,室温避光孵育约15 min,再加入2 mL 红细胞裂解液,震荡后置室温10 min,离心后弃上清,用PBS 洗涤2 次,加入15 mL PBS,上机待检。所有结果分析均参照白血病分型欧洲组标准(EGIL)[5]。
1.2.3 多探针荧光原位杂交(FISH) 采集患者新鲜的骨髓细胞,用间期荧光原位杂交技术检测p16基因缺失、E2A与前B细胞白血病转录因子1(E2A-PBXl)融合基因、混合系白血病(MLL)断裂基因、E26 白血病转录因子与急性髓系白血病基因1(TEL-AMLl)融合基因、前癌基因c-ABL与断裂点簇集区BCR(BCR-ABL)融合基因、多倍体检测、MYC断裂基因及IGH 断裂基因,8 个探针按设计组合标记固定于一张检测玻片,按试剂盒(英国Cytocell)操作说明进行操作。所有结果的分析均采用人类细胞遗传学国际命名体制(ISCN)2009 标准[6],每份间期核标本计数200 个细胞。针对p16 缺失的探针组包括:覆盖9p21 区域101 kb 的红色探针,9 号染色体质控探针(绿色)。正常细胞的荧光原位杂交信号为2红2绿,1红2 绿表明p16 基因从1 条染色体中缺失,即杂合性缺失,0红2绿为纯合性缺失,杂合性缺失与纯合性缺失均定义为缺失,见图1。

Fig.1 The p16 gene deletion detected by fluorescence in situ hybridization图1 间期荧光原位分析p16基因缺失
1.2.4 危险分组、治疗方案及疗效评估 根据2014NCCN 指南[7],具有以下任一危险因素均定义为高危患者:(1)Ph阳性或BCR-ABL 基因阳性;(2)MLL 基因重排;(3)初诊时WBC≥30×109/L;(4)低二倍体数(染色体数<44 条)。其余则为标危组。210 例患者初次确诊后住院接受规律治疗,首先予标准的VILP(长春新碱、去甲氧柔红霉素、左旋门冬酰胺酶、泼尼松)或VDLP(长春新碱、柔红霉素、左旋门冬酰胺酶、泼尼松)方案进行诱导缓解,缓解后予Hyper CVAD A(环磷酰胺、长春新碱、阿霉素、地塞米松)和Hyper CVAD B(大剂量甲氨蝶呤和阿糖胞苷)方案交替进行巩固治疗,所有患者均行腰椎穿刺并前鞘内注射预防中枢神经系统白血病。97 例患者在巩固2~5个疗程后接受异基因造血干细胞移植,治疗方案详见参考文献[4],其余患者因经济、无合适供者或并发症等原因只行单纯化疗。
疗效评估:完全缓解(CR)定义为化疗后患者骨髓中原始细胞≤0.050,外周血中性粒细胞≥1.5×109/L,血小板计数(PLT)≥100×109/L,白细胞分类中无白血病细胞,且无髓外白血病。复发定义为获得完全缓解患者骨髓中原始细胞≥0.050或者发生髓外侵犯。
1.2.5 随访 对患者从确诊后每3 个月进行1 次电话随访,随访截止日期为2018年12月31 日。总生存时间(OS)定义为初次确诊日期至死亡日期或末次随访日。无病生存时间(DFS)定义为CR 至白血病复发或在CR 期间死亡或末次随访日。
1.3 统计学方法 应用SPSS 17.0 进行统计学分析,符合正态分布的计量资料以均数±标准差(±s)表示,2 组间比较采用t检验;不符合正态分布的计量资料以M(P25,P75)表示,2组间比较采用Mann-WhitneyU检验。计数资料组间比较采用Pearsonχ2检验、校正χ2检验或Fisher 确切概率法。采用Kaplan-Meier 法绘制生存曲线,并采用Log-rank 检验比较生存率。P<0.05为差异有统计学意义。
2 结果
2.1 p16基因缺失与无缺失患者的临床基本特征比较 p16基因缺失组与无缺失组间性别、年龄、初诊时WBC、骨髓中原始细胞比例、肝脾肿大及高危患者比例差异均无统计学意义(均P>0.05),见表1。
2.2 p16基因缺失与无缺失患者免疫表型及细胞遗传学比较 210例患者中有75例(35.7%)CD20抗原表达阳性(CD20抗原表达>20%),其中p16基因缺失组中伴CD20 表达者所占比例明显高于无缺失组(P<0.05),2 组患者间其余免疫表型分布差异无统计学意义,见表2。p16基因缺失组与无缺失组间细胞遗传学分布差异无统计学意义,见表3。
2.3 p16 基因缺失与无缺失患者的疗效及预后比较 (1)疗效。p16 基因缺失组造血干细胞移植率和完全缓解率与无缺失组差异均无统计学意义,复发率明显高于无缺失组(χ2=12.027,P<0.05),见表4。79 例复发患者中,4 例患者初发时未检测出p16基因缺失,而复发时检测出p16基因缺失,复发患者p16 基因缺失率明显高于初发患者(χ2=9.254,P=0.002)。(2)预后。对210例患者进行随访,中位随访时间为30(1~87)个月,p16 基因缺失组(61 例)中位OS和中位DFS分别为23个月和15个月,p16基因无缺失组(149 例)中位OS 和中位DFS 分别为40 个月和38个月,p16基因无缺失组患者OS和DFS明显优于 p16 基因缺失组(Log-rankχ2分别为 16.715、21.237,P<0.05),见图2、3。p16基因缺失组中接受造血干细胞移植患者中位OS 及中位DFS 分别为38个月和27 个月,接受化疗患者中位OS 及中位DFS分别为17个月和10个月,接受造血干细胞移植患者的OS和DFS明显优于接受化疗者(Log-rankχ2分别为25.316、20.637,P<0.05),见图4、5。

Tab.1 Comparison of clinical characteristics between two groups of patients表1 伴p16基因缺失组与无缺失组患者临床特征的比较
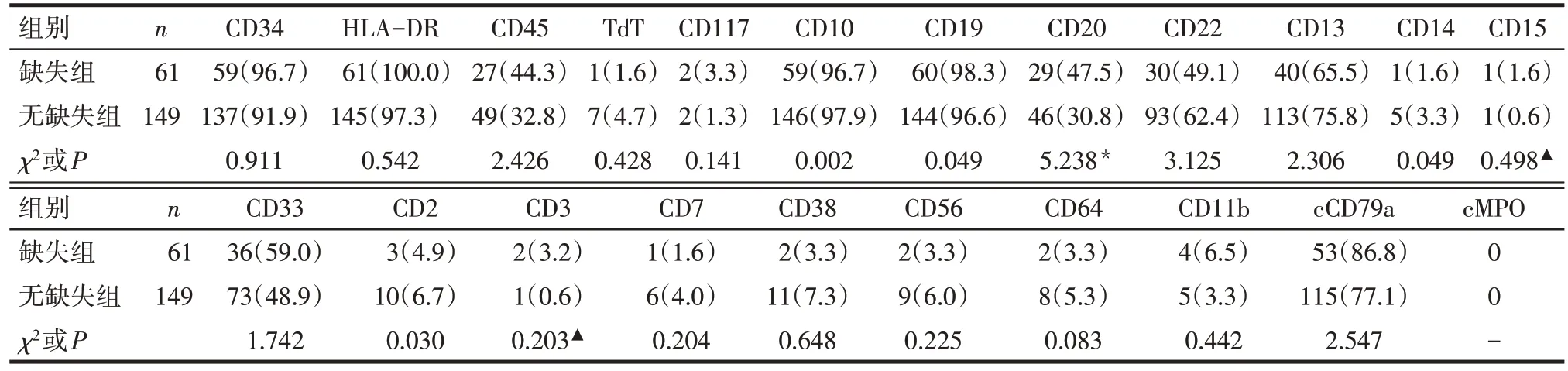
Tab.2 Comparison of the immunophenotypes between two groups of patients表2 伴p16基因缺失与无缺失急性ph阴性B-ALL患者免疫表型的比较 [例(%)]
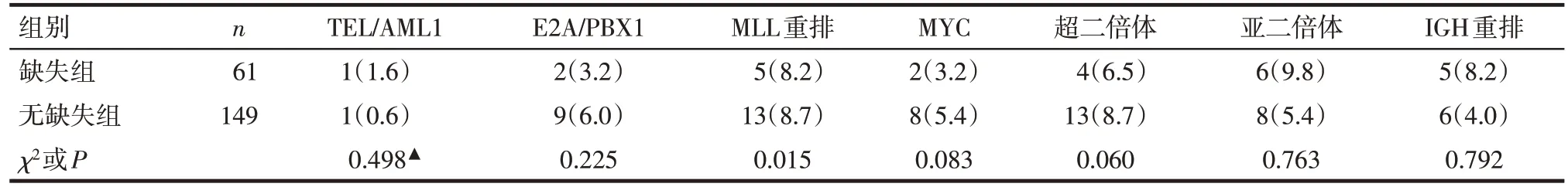
Tab.3 Comparison of cytogenetics between two groups of patients表3 伴p16基因缺失与无缺失急性ph阴性B-ALL患者细胞遗传学的比较 [例(%)]

Tab.4 Comparison of the therapeutic efficacy between two groups of patients表4 伴p16基因缺失与不伴p16基因缺失急性ph阴性B-ALL患者治疗疗效的比较 [例(%)]
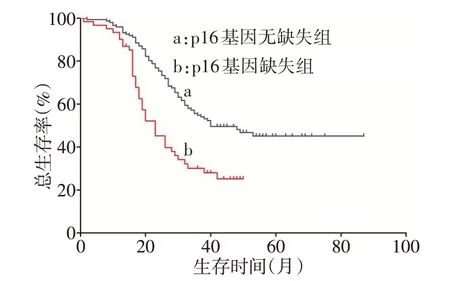
Fig.2 Kaplan-Meier survival curves for overall survival in two groups of patients图2 p16基因缺失组与无缺失组患者OS比较

Fig.3 Kaplan-Meier survival curves for disease free survival in two groups of patients图3 p16基因缺失组与无缺失组患者DFS比较
2.4 伴CD20 阳性表达的p16 基因缺失与无缺失患者预后比较 p16基因缺失组CD20阳性、CD20阴性以及无缺失组CD20阳性、CD20阴性患者的中位OS分别为 19 个月、29 个月、35 个月及 48 个月,中位DFS 分别为 11 个月、21 个月、32 个月及 38 个月。p16 基因缺失组 CD20 阳性患者 OS 和 DFS 均明显低于缺失组CD20阴性者(OS:Log-rankχ2=7.782;DFS:Log-rankχ2=5.733;均P<0.05)、无缺失组 CD20 阳性者(OS:Log-rankχ2=13.731;DFS:Log-rankχ2=17.450;均P<0.05)及无缺失组CD20 阴性者(OS:Log-rankχ2=32.163;DFS:Log-rankχ2=34.372;均P<0.05),无缺失组中CD20阳性者与阴性者间差异无统计学意义(OS:Log-rankχ2=0.289 6;DFS:Logrankχ2=0.074 2;均P>0.05),见图6、7。

Fig.4 Kaplan-Meier survival curves for overall survival in patients received Allo-HSCT treatment and chemotherapy treatment图4 p16基因缺失移植组与化疗组患者OS比较
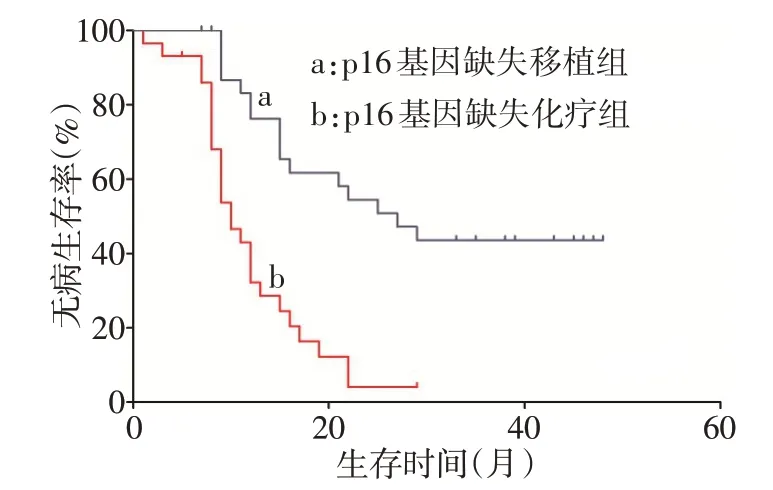
Fig.5 Kaplan-Meier survival curves for disease free survival in patients received Allo-HSCT treatment and chemotherapy treatment图5 p16基因缺失移植组与化疗组患者DFS比较

Fig.6 Kaplan-Meier survival curves for overall survival in patients with different status of p16 gene and CD20图6 p16基因缺失组CD20阳性、CD20阴性以及无缺失组CD20阳性、CD20阴性患者OS比较
2.5 伴p16 基因缺失的MLL 重排B-ALL 患者预后分析 5 例伴p16 基因缺失的MLL 重排患者中有3例复发;4 例患者在2年之内死亡,仅1 例接受造血干细胞移植患者截至随访日止仍存活,其发病后生存时间为28个月。

Fig.7 Kaplan-Meier survival curves for disease free survival in patients with different status of p16 gene and CD20图7 p16基因缺失组CD20阳性、CD20阴性以及无缺失组CD20阳性、CD20阴性患者DFS比较
3 讨论
p16 基因缺失是成人ALL 最常见的细胞遗传学改变之一,目前多数研究认为p16 基因缺失是ALL患者预后不良的独立危险因素之一。本研究结果显示,与无缺失组比较,p16 基因缺失组患者复发率高、2年OS和DFS率较低,与Braun等[8]的报道一致。本研究发现p16基因缺失率在复发患者中高于初发患者,有4 例患者初发时p16 基因无缺失,而复发时出现p16基因缺失,与Mullighan等[9]的报道一致,其研究发现部分ALL 复发患者出现基因拷贝缺失,其中56%为p16 基因缺失。对p16 基因缺失患者治疗效果进行分析发现,造血干细胞移植能明显改善预后,与以往研究结果一致[3]。根据以上结果推测p16基因缺失与成人Ph 阴性B-ALL 患者的复发及进展有关,造血干细胞移植能改善患者的预后。
本研究对患者的免疫分型进行分析发现,p16基因缺失患者CD20 阳性率明显高于无缺失患者,p16基因缺失伴CD20阳性患者的预后明显差于p16基因缺失伴CD20 阴性患者;而在无p16 缺失患者中,CD20阳性与CD20阴性组患者预后无明显差异。目前关于CD20阳性表达对于B-ALL预后的影响仍具有争议,有研究认为CD20 表达阳性对成人BALL预后无影响[10],而多数研究认为CD20是ALL患者预后不良的独立危险因素之一,CD20阳性ALL患者的3年持续缓解率及3年OS 率均明显低于CD20阴性者[11],CD20阳性Ph阴性ALL患者3年累积复发率较CD20阴性者明显升高[12]。有研究表明,利妥昔单抗联合标准化疗较单纯化疗能明显提高CD20 阳性ALL患者的预后[13-14]。
MLL重排是ALL患者预后不良的重要的遗传学异常之一。目前关于p16基因缺失对MLL重排ALL患者预后影响的研究尚少见。Ohnishi 等[15]研究表明,示MLL 重排患者中p16 基因缺失率为19%,且p16基因缺失提示MLL重排患者预后较差。本研究结果显示,18 例 MLL 重排 ph 阴性 B-ALL 患者中,5例伴p16 基因缺失(27.7%),且其中4 例均于发病2年内死亡,与Ohnishi等[15]的研究一致。有研究表明p16基因在MLL重排白血病细胞增殖及凋亡中起关键性作用,不同的上游基因,均通过抑制p16基因的表达,从而促进MLL重排白血病细胞的增殖和抑制其凋亡[16-17]。
综上所述,p16 基因缺失是成人Ph 阴性ALL 患者预后不良的危险因素,其在白血病的复发及进展中起重要作用,造血干细胞移植能明显改善该部分患者的预后。伴p16基因缺失患者CD20阳性率高,这部分患者预后较差。在诊断时明确p16基因缺失状态对于指导疾病危险分层及选择合适的治疗方案具有重要意义。

