17β-雌二醇通过SOCS3抑制泡沫细胞形成的机制初探
殷艳蓉,袁 炜,贺 明,田雨灵,乌宇亮,袁祖贻,梁 潇
(西安交通大学第一附属医院心血管内科,西安 710061)
男性和绝经后女性冠心病的发病率明显高于绝经前女性,提示雌激素对动脉粥样硬化具有保护作用[1-2]。既往的人群和动物实验[3-4]均提示雌激素有助于延缓动脉粥样硬化的进展。
流行病学研究和动物实验证明,雌激素除了降低胆固醇活性外还可以减少平滑肌细胞增殖、白细胞黏附,增加一氧化氮的合成[5]。既往研究证实雌激素能够增加肝脏和肠道水平的ATP结合盒转运蛋白A1(ATP-binding cassette transporter A1,ABCA1)的表达[6-7]。然而,雌激素是否通过增加ABCA1的表达来调节胆固醇的转运平衡及其相关的分子机制仍不清楚。
雌激素是一种炎症调节因子,斑块内泡沫细胞的形成由特殊的细胞因子调节[8-9]。细胞因子信号转导抑制因子3(Suppressor of Cytokine Signaling 3,SOCS3)在动脉粥样硬化中具有抗炎的作用[10-11]。SOCS3主要在janus激酶/信号转导和转录激活子(JAK/STAT)通路中发挥作用[12]。雌激素调控泡沫细胞形成过程可延缓动脉粥样硬化,但目前SOCS3在其中作用的研究尚不足。
本研究旨在探索是否雌激素可通过上调ABCA1表达来影响胆固醇流出,调控动脉粥样硬化进展,以及这种动脉粥样硬化的保护作用是否与SOCS3调节相关。
1 材料与方法
1.1 动物该动物研究获西安交通大学动物实验机构伦理委员会批准(2018-243)。载脂蛋白E(Apolipoprotein E,ApoE)-/-小鼠(B6.129P2- ApoEtm1Unc)获赠于加州大学伯克利分校Edward教授。小鼠在第3周断奶并普通饮食喂养3周。第6周开始,以含有21%脂肪和0.15%胆固醇的高脂饮食继续喂养。
实验小鼠随机分为3组。在性成熟期(第5周),对麻醉后小鼠进行双侧卵巢切除术(OVX,n=16)或假卵巢切除术(Sham组,n=8)。从第6周开始,将卵巢切除的小鼠分为2组:OVX+E2组(n=8)小鼠皮下注射溶于丙酮的E2 5 μg/d(Sigma公司),OVX组(n=8)注射丙酮作为对照。在第14周收集其血液和主动脉。
1.2 方法
1.2.1 血清脂质和血糖水平的检测 根据试剂盒说明检测血清总胆固醇(Total Cholesterol,TC)、甘油三酯(Triglyceride,TG)和血糖(Glucose,GLU)水平。每个样品重复测试3次。
1.2.2 免疫组织化学和组织学染色 将小鼠主动脉根切除并以OCT包埋冷冻,以8 μm的厚度进行连续冷冻切片。使用油红O染色检测斑块中的脂质。用抗体进行免疫组织化学染色法鉴定Mac3,SOCS3和ABCA1。
1.2.3 细胞培养 RAW264.7细胞(ATCC公司)培养基为高糖Dulbecco′s Modified Eagle Medium(DMEM)(Gibco公司)中加10%胎牛血清(杭州四季青生物制品有限公司),青霉素(100 U/mL)和链霉素(80 U/mL)。培养环境37℃,5%CO2。E2(Sigma公司),雌激素受体α拮抗剂MPP(Sigma公司)和雌激素受体β拮抗剂PHTPP(Santa Cruz公司)溶于二甲基亚砜中。RAW264.7细胞分别被MPP(200 nM),PHTPP (200 nM)或这两者一起预处理2 h后,用E2处理(100 nM)12 h。
将γ-干扰素(IFN-γ)(Peprotech公司)溶于0.01 M无菌磷酸盐缓冲盐水(Phosphate-Buffer Saline,PBS)中,将JAK2磷酸化抑制剂AG490(Sigma公司)溶于二甲基亚砜中。用IFN-γ(100 μg/L)处理RAW264.7细胞12 h和/或AG490(30 μM)再处理12 h。每次实验重复3次。
1.2.4 RNAi SOCS3的小片段干扰核糖核酸(Small Interfering RNA,siRNA)(GenePharma公司)序列为5′-GAGAGCUUACUACAUCUAU-3′,用于抑制内源性SOCS3表达;对照序列为5′-AATCAGTCACGTTAATGGTCG-3′。用IFN-γ (100 μg/L)预处理RAW264.7细胞(≥105/mL)12 h以刺激其内源SOCS3表达,然后使用转染试剂2000(Invitrogen公司)将SOCS3 siRNA或对照序列转染12、24、36或48 h。序列5′-CACUCAAGAU-
UGUCAGCAATTUUGCUGACAAUCUUGAGU-
GAG-3′被用于抑制内源性GAPDH表达以阳性对照。细胞培养6 h后,将培养基更换为DMEM,接着进行下一部分实验。
1.2.5 质粒转染 SOCS3质粒(SOCS3-pcDNA3.0)由Akihiko Yoshimura教授(Keio大学,东京,日本)惠赠。RAW264.7用SOCS3质粒或由Tuberfect (Fermentas公司)对照(pcDNA3.0质粒),分别转染12、24、36或48 h。
1.2.6 RNA提取和定量PCR 用Trizol试剂(Invitrogen公司)分离总RNA。将所得的RNA逆转录并用SYBR PrimeScript TM RT-PCR试剂盒[宝日医生物技术(北京)有限公司]进行定量PCR分析。引物序列见表1。
1.2.7 蛋白质印迹分析 硝酸纤维素膜中的蛋白质在4℃下分别与抗SOCS3,抗ABCA1,抗ABCG1,抗-CD36,抗LXRα,抗JAK2,抗pJAK2,抗STAT3,抗pSTAT3或抗体-GAPDH培养,并使用辣根过氧化物酶偶联的抗兔二抗和增强化学发光底物检测。
1.2.8 细胞胆固醇负荷和流出 用不同的试剂处理RAW264.7细胞,然后用3-己酰基-NBD胆固醇(1 μg/mL,Cayman,CA,USA)平衡6 h。绿色NBD-胆固醇负载细胞经荧光成像计数系统(Olympus公司)计数后,用PBS漂洗。在37℃下进行胆固醇流出12 h,其反应条件为:(1)0.2%牛血清白蛋白(BSA);(2)0.2%BSA和15 μg/mL无脂质的人apoA1(Sigma公司);(3)0.2%BSA和50 μg/mL人HDL(北京联合-生物学有限公司)。从细胞释放到培养基中的NBD-胆固醇通过多标记计数器(BioTek公司)测量。培养基中胆固醇可被荧光标记,计算其荧光量与荧光总量(细胞和培养基)的百分比,表示胆固醇流出的程度。如前所述,每个组有3个样本,每次重复3次。

表1 引物序列

2 结果
2.1 E2对ApoE-/-小鼠血脂、血糖水平的影响Sham组和OVX+E2组小鼠的子宫重量均高于OVX组(P<0.01)。与OVX组相比,Sham组和OVX+E2组血清总胆固醇和甘油三酯水平均下降,差异有统计学意义(P<0.01~0.05),3组小鼠的体质量和血糖水平无明显差异(表2)。

表2 E2对ApoE-/-小鼠血脂、血糖水平的影响
2.2 E2对ApoE-/-小鼠动脉粥样硬化斑块进展的影响油红O染色显示,斑块中的脂质沉积分别下降20.57%和30.36%(两者P均<0.01,图1A)。Mac3的免疫组织化学染色显示,3组小鼠斑块中的巨噬细胞数量无明显差异(图1B)。与OVX组相比,Sham组和OVX+E2组斑块面积分别减少22.03%和21.84%(P均<0.01)。这些结果表明,E2在不改变斑块中巨噬细胞数量的情况下,降低斑块面积和脂质沉积,这表明雌激素可抑制ApoE-/-小鼠的动脉粥样硬化斑块进展。
2.3 E2干预对斑块中ABCA1表达的影响ABCA1是胆固醇的主要调节因子,通过测量斑块中的ABCA1表达水平可反映胆固醇转运情况。免疫组织化学染色表明斑块中ABCA1阳性面积百分比在Sham组中比在OVX组中高1.61倍,在OVX+E2组中比在OVX组中高1.57倍,与OVX组相比差异均有统计学意义(P均<0.01,图1C)。与OVX组相比,主动脉ABCA1 mRNA表达分别增加2.09倍和2.43倍(两者P均<0.01)。
2.4 JAK/STAT通路对RAW264.7细胞ABCA1表达的影响本研究证实JAK/STAT活化可下调ABCA1表达以及E2干预可逆转ABCA1被下调的情况。在未处理的RAW264.7细胞中,通过Western印迹几乎检测不到JAK2和STAT3的磷酸化。用IFN-γ刺激后JAK2/STAT3的磷酸化程度显著增加,ABCA1的表达明显下调(P<0.05)。相比之下,用JAK2磷酸化抑制剂AG490阻断JAK/STAT激活逆转了ABCA1表达的下调(P<0.01,图2)。

注:A,不同组ApoE-/-小鼠斑块面积和主动脉瓣总面积比率。B,不同组ApoE-/-小鼠斑块内脂质沉积和巨噬细胞表达及和斑块面积的比率。C,不同组斑块中ABCA1的表达及其与斑块面积比率。图中比例尺为200 μm,放大倍数为×40(ORO)和×100(Mac3)。*P<0.05,**P<0.01。图1 E2干预对ApoE-/-小鼠斑块面积、脂质沉积和巨噬细胞、ABCA1的影响

注:不同组ApoE-/-小鼠斑块内ABCA1表达情况及和斑块面积的比率。图中比例尺为200 μm,放大倍数为×100。*P<0.05,**P<0.01。图2 JAK/STAT通路对RAW264.7细胞ABCA1表达的影响
2.5 SOCS3对E2调节ABCA1表达的影响E2处理后检测体内和体外的SOCS3表达:Sham组和OVX+E2组的ApoE-/-小鼠斑块中SOCS3阳性面积的百分比分别比OVX组的高1.41和1.51倍(P<0.05)。主动脉中的SOCS3 mRNA表达呈现出相同的趋势(图3A)。在未处理的RAW264.7细胞中,SOCS3的表达几乎不能被Western blot检测到,但在进行E2处理后SOCS3的表达显著增加(P<0.01)。E2上调的SOCS3表达被MPP(ERα拮抗剂)抑制,但不被PHTPP(ERβ拮抗剂)抑制(图3B)。E2处理和SOCS3过表达抑制JAK/STAT通路激活并上调ABCA1表达,SOCS3 siRNA转染组细胞SOCS3的表达下降,并且几乎抵消了E2处理对JAK/STAT途径激活和对ABCA1表达的上调(图4)。这些结果表明,E2通过雌激素受体α调节ABCA1表达,该调节过程取决于SOCS3表达的上调。
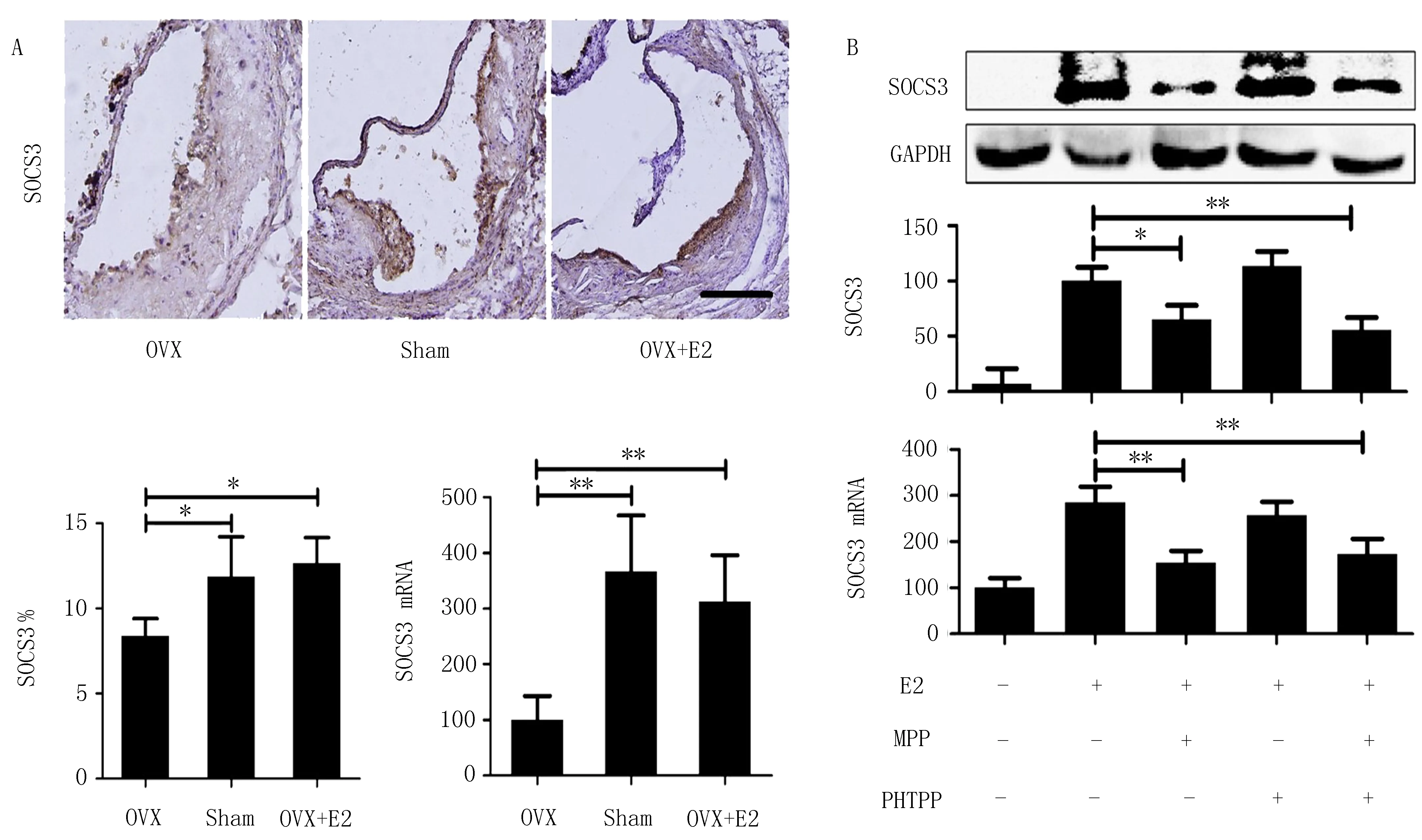
注:A在ApoE-/-小鼠中,用E2处理后,SOCS3蛋白在斑块和mRNA中的表达水平升高。放大倍率×100,bar =100 μm;B在RAW264.7细胞中,E2通过ERα增加SOCS3的蛋白质和mRNA表达。*P<0.05,**P<0.01。图3 E2在体内和体外增加SOCS3的表达

注:用SOCS3-pcDNA3.0质粒和/或SOCS3特异性siRNA转染后,用IFN-γ(100 μg/L,12 h)和/或E2(100 nM,12 h)处理RAW264.7细胞。IFN-γ用于激活JAK/STAT途径。GAPDH被检测为内参基因。*P<0.05,**P<0.01。图4 E2增加ABCA1蛋白表达依赖于SOCS3水平
2.6 E2对RAW264.7细胞胆固醇外流的影响本研究对E2处理后的RAW264.7细胞胆固醇流出情况进行了检测。图5显示了绿色荧光NBD的强度代表细胞内胆固醇水平。E2和pcDNA-SOCS3转染均降低了RAW264.7细胞中的NBD胆固醇残留,而E2加siRNASOCS3与对照组相比,胆固醇含量无明显差异。IFN-γ处理抑制了胆固醇流出到ApoA-1[胆固醇流出:对于IFN-γ为(15.80±3.77)%,对照组为(22.86±3.19)%,P<0.05)],而E2治疗可使增加胆固醇流出到ApoA-1[胆固醇含量:E2为(22.86±3.19)%,对照组为(28.66±1.76)%,P<0.05)]。SOCS3过表达也增加了胆固醇流出到ApoA-1[(32.40±3.22)%,P<0.01)]。siRNA的SOCS3表达的变低几乎抵消了E2处理对ApoA-1胆固醇的影响[(16.44±2.36)%,P<0.05)]。上述处理对HDL的表达没有影响。
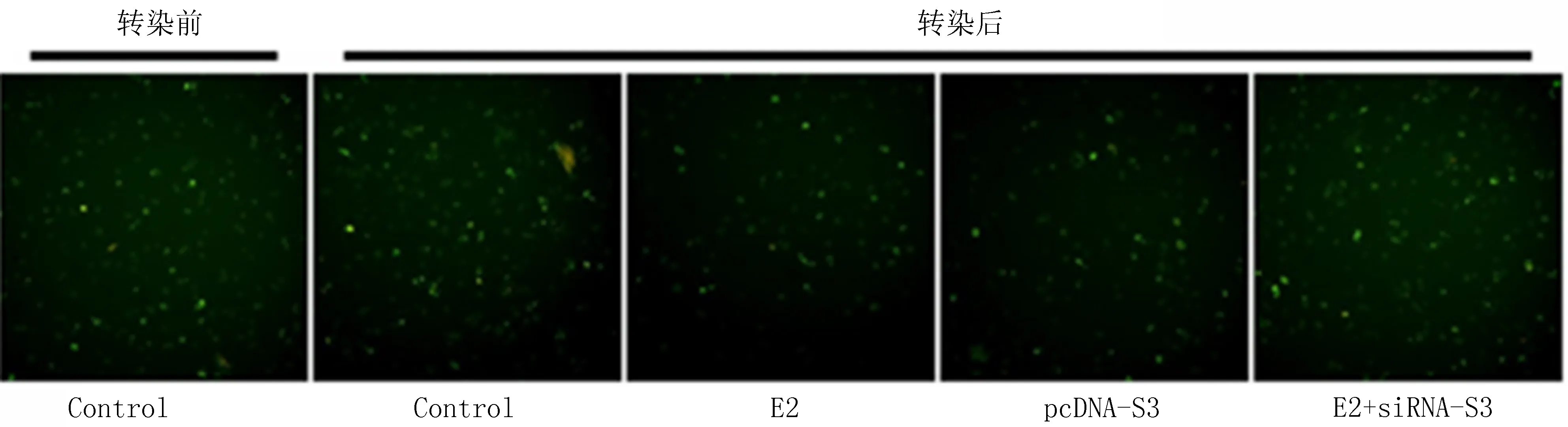
注:用SOCS3-pcDNA3.0质粒或SOCS3特异性siRNA转染后的RAW264.7细胞中的胆固醇浓度和效率,其通过NBD胆固醇(1 μg/ml)的绿色荧光强度进行测量。放大倍数40。胆固醇流出率表示为相对于荧光总量(细胞和培养基)在培养基中荧光的百分比。图5 E2促进胆固醇流向ApoA-1取决于SOCS3
3 讨论
本研究中证实E2处理显著抑制动脉粥样硬化斑块中的泡沫细胞形成,并改善了ApoE-/-小鼠的动脉粥样硬化进程。该效应至少部分地与SOCS3表达上调,JAK/STAT磷酸化的抑制和ABCA1表达下调的逆转相关。
既往人群和动物的研究表明,E2处理改善了血清脂质水平,这似乎是E2的主要的抗动脉粥样硬化作用[13-14]。本研究也显示E2具有同样的降低总胆固醇和甘油三酯水平的效果。在本研究中主要关注E2独立降脂机制外的作用,如E2对动脉粥样硬化斑块调节胆固醇转运的作用。本研究结果显示,E2减少了脂质负荷的巨噬细胞的数量,并抑制了泡沫细胞的形成,这可能有助于减缓动脉粥样硬化的进程。
Lundholm等[15]的结果表明,皮下注射2~3 μg E2 10 h后,小鼠脂肪组织中LXRα,ABCA1和ABCG1 mRNA的表达水平均降低,这证实了E2增加了皮下脂肪的积累。本研究结果表明E2增加了动脉粥样硬化斑块中的ABCA1表达,可能起到抗动脉粥样硬化的作用。据此可推测E2在调节ABCA1表达中具有组织特异性,以实现不同的效果。
Hao等[16]发现JAK/STAT通路的激活在THP-1细胞中负调节ABCA1的表达。然而,Frisdal等[17]发现通过IL-6处理激活的JAK/STAT在THP-1细胞中上调ABCA1表达,并且通过AG490抑制JAK/STAT活化降低了ABCA1的表达。本研究结果显示ABCA1表达在RAW264.7巨噬细胞中被JAK/STAT激活下调,使用JAK2抑制剂(AG490)治疗培养的巨噬细胞时,ABCA1表达显著增加。这些研究的结果互相冲突的原因仍不清楚。
促炎JAK/STAT途径在调节动脉粥样硬化的起始/进展中起重要作用。Gharavi等[18]证明内皮细胞STAT3-/-小鼠具有较小的动脉粥样硬化病变。可能是由于CP-690,550对脂质代谢的副作用,尽管ApoE-/-小鼠持续4周给予CP-690,550未能显示出明显的动脉粥样硬化保护作用,但JAK抑制剂治疗对动脉粥样硬化进展的影响仍需进一步研究。
既往研究表明SOCS3表达是由多种细胞因子诱导的。在本研究中,内源性和外源性雌激素可以增加体内和体外SOCS3的表达。Leung等[19]也发现了雌激素通过293GHR,HuH7和T-47D细胞中的SOCS蛋白来抑制由生长激素诱导的JAK2和STAT3磷酸化。在本研究中,E2通过ERα增加巨噬细胞中的SOCS3表达,提示SOCS3参与雌激素介导的对JAK/STAT的抑制过程。
SOCS3通过抑制JAK/STAT的激活来影响一些炎症性疾病的发展,但其在动脉粥样硬化起始和发展中的作用仍有争议。在本研究中,E2增加SOCS3表达,同时减少动脉粥样硬化斑块大小。此外,SOCS3的过表达在体外促进了胆固醇的积累。
综上,本研究数据表明E2处理通过ERα在动脉粥样硬化斑块中上调SOCS3表达。上调的SOCS3抑制JAK/STAT的激活,并逆转了ABCA1的下调,这增加了巨噬细胞中的胆固醇流出,并导致了泡沫细胞形成的抑制和动脉粥样硬化的改善。

