高一化学教学中与量有关的离子方程式书写技巧
易先明
(湖北省钟祥市第一中学,湖北 钟祥 431900)
例题1:氢氧化钠与二氧化碳
初中学生学过氢氧化钠与二氧化碳的反应方程式2NaOH+CO2=Na2CO3+H2O也应该会写其离子方程式:2OH-+CO2=CO32-+H2O在此基础上提问:如果在产物中继续通二氧化碳,会不会再反应呢?引导学生归纳多元弱酸正盐与多元弱酸会生成弱酸酸式盐:Na2CO3+H2O+CO2=2NaHCO3其离子方程式为CO32-+H2O+CO2=2HCO3-进一步说明,该离子反应能够发生是因为生成了难电离的碳酸氢根离子,如果把两个方程式相加就得到:2NaOH+2CO2=2NaHCO3约简为:NaOH+CO2=NaHCO3第一个反应的产物碳酸钠是第二个反应的反应物,即生成的碳酸钠又消耗掉了,此类反应可看成连续反应,若碳酸钠消耗完,则两方程式可以相加。再引导学生找出与量有关的反应方程式的书写规律:开始二氧化碳量少,方程式中二氧化碳计量系数为1,氢氧化钠的计量系数为2,即量少的物质的计量系数一般定为1,但随着二氧化碳不断通入直至过量,二氧化碳的计量系数也变为2,但方程式计量系数有公约数2可以约简,就得到方程式NaOH+CO2=NaHCO3其离子方程式为:OH-+CO2=HCO3-此方法即为定少议多法。
例题2:小苏打与石灰水
知识准备:NaOH+NaHCO3=Na2CO3+H2O对应离子方程式为:OH-+HCO3-=CO32-+H2O HCl+NaHCO3=NaCl+CO2↑+H2O 对应离子方程式为:H++HCO3-=CO2↑+H2O这是学生很容易搞混淆的知识点,告诉学生碳酸是二元酸,可以依次被一个氢氧化钠中和为碳酸氢钠,被两个氢氧化钠中和为碳酸钠,碳酸氢钠若遇到盐酸,则生成碳酸,继而分解为二氧化碳和水。
例题分析:小苏打中只有一个氢,氢氧化钙中有两个氢氧根,故小苏打少量时只中和一个氢氧根,过量时可中和两个氢氧根,故存在少量与过量的不同,方程式如下:Ca(OH)2+NaHCO3=H2O+CaCO3↓+NaOH 产物中若继续加入碳酸氢钠则发生:NaHCO3+NaOH=Na2CO3+H2O两式相加得到:Ca(OH)2+2NaHCO3=2H2O+CaCO3↓+ Na2CO3同样可得到规律:不足的物质化学计量系数为1,其离子方程式分别为:Ca2++OH-+HCO3-= CaCO3↓+H2O OH-+HCO3-=CO32-+H2O Ca2++2OH-+2HCO3-=CaCO3↓+2H2O+CO32-
例题3:碳酸氢钙与氢氧化钠
分析:一个氢氧化钠只能中和一个碳酸氢根,少量氢氧化钠和过量氢氧化钠与碳酸氢钙反应方程式应不同:
方程式如下:Ca(HCO3)2+NaOH=H2O+CaCO3↓+NaHCO3继续加入氢氧化钠则发生:NaOH+NaHCO3=Na2CO3+H2O 两式相加得到:Ca(HCO3)2+2NaOH=2H2O+CaCO3↓+Na2CO3其离子方程式分别为:Ca2++OH-+HCO3-=CaCO3↓+H2O Ca2++2OH-+2HCO3-=CaCO3↓+2H2O+CO32-
例题4:碳酸氢钙与石灰水
分析:两者阴离子个数均为2,无论谁过量,离子方程式均一样,其化学方程式为:Ca(HCO3)2+Ca(OH)2=2CaCO3↓+2H2O其离子方程式为:Ca2++OH-+HCO3-= CaCO3↓+H2O
例题5:碳酸氢铵与氢氧化钠
分析:当氢氧化钠少量时,应先与碳酸氢根反应,当氢氧化钠过量时再与铵根反应,因为水是比一水合氨更弱的电解质,故先生成水,再生成一水和氨,方程式如下:2NH4HCO3+2NaOH=(NH4)2CO3+2H2O+Na2CO3(NH4)2CO3+2NaOH=2NH3·H2O+Na2CO3NH4HCO3+2NaOH=NH3·H2O+H2O+Na2CO3
离子方程式分别为:OH-+HCO3-=CO32-+H2O NH4++OH-=NH3·H2O
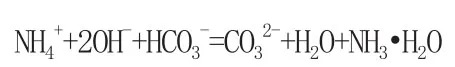
例题6:碳酸氢镁与氢氧化钠
分析:当氢氧化钠较少时,应先中和碳酸氢镁中的氢,生成水、碳酸镁、碳酸钠。即使生成碳酸根,也不会与镁离子双水解,因为碳酸镁微溶,不会像三价铁那样与碳酸根双水解。其化学方程式为:Mg(HCO3)2+NaOH==MgCO3↓+NaHCO3+H2O 离子方程式为:Mg2++HCO3-+OH-=MgCO3↓+H2O 但当氢氧化钠的量逐渐增多时,微溶的碳酸镁可转化为难溶物的氢氧化镁,其化学方程式为: Mg(HCO3)2+4NaOH=Mg(OH)2↓+2Na2CO3+2H2O离子方程式为:Mg2++2HCO-+4OH-=Mg(OH)↓+2HO+2CO2-3223
综上所述,当生成物还可以继续与某种反应物反应时,该反应物的用量就有少量和过量之分,离子方程式就与量有关,相反则无关,解题方法为定少议多。为了巩固这一技巧,可以让学生练习书写:硫酸氢钠与氢氧化钡反应的化学方程式和离子方程式
(1)硫酸氢钠少量。
(2)硫酸氢钠过量。
(3)向氢氧化钡中滴加硫酸氢钠至恰好呈中性。
参考答案:(1)和(2)的化学方程式分别为:NaHSO4+Ba(OH)2=BaSO4↓ +H2O+NaOH;
NaHSO4+NaOH=Na2SO4+H2O;相加得2NaHSO4+Ba(OH)2=BaSO4↓+2H2O+Na2SO4离子方程式分别为:Ba2++OH-+H++SO42-=BaSO4↓+H2O; OH-+H+=H2O;Ba2++2OH-+2H++SO42-=BaSO4↓+2H2O
(3)即当硫酸氢钠的物质的量为氢氧化钡的物质的量两倍的情况:化学方程式为:2NaHSO4+Ba(OH)2=BaSO4↓+2H2O+Na2SO4离子方程式分别为:Ba2++2OH-+2H++SO42-=BaSO4↓+2H2O

