辣椒疫霉菌葡聚糖酶抑制蛋白的原核表达、纯化及结晶
王会征 兰玉彬


摘要:葡聚糖酶抑制蛋白(GIP)是辣椒疫霉菌在病理环境下诱导产生的一类蛋白,是病原菌抗性蛋白的一种。本研究根据辣椒疫霉菌全基因组序列,通过生物信息学分析、序列比对获得葡聚糖酶抑制蛋白全长基因序列。以辣椒疫霉高致病菌株SD33全基因组为模板扩增GIP基因cDNA,并对其进行相关生物信息学分析。基因经测序验证后与载体pET28a(+)连接,构建好的重组质粒转化大肠杆菌(Escherichia coli Rosetta),用IPTG诱导表达重组蛋白6×His-GIP。重组蛋白在5 mol/L尿素变性环境下进行亲和层析纯化,对纯蛋白进行透析、复性、浓缩后进行分子排阻层析纯化,并对获得的纯蛋白进行蛋白结晶试验,为进一步阐明GIP作用机理奠定基础。
关键词:辣椒疫霉菌;葡聚糖酶抑制蛋白(GIP);原核表达;纯化;结晶
中图分类号:S432.4+4:Q78 文献标识号:A 文章编号:1001-4942(2019)10-0111-06
Prokaryotic Expression, Purification and Crystallization of Glucanase
Inhibitor Protein (GIP) from Phytophthora capsica
Wang Huizheng, Lan Yubin
(College of Agricultural Engineering and Food Science, Shandong University of Technology/National Sub-center
for International Collaboration Research on Precision Agricultural Aviation Pesticide Spraying Technology, Zibo 255000, China)
Abstract Glucanase inhibitory protein (GIP) is a kind of resistant protein induced by Phytophthora capsici in pathological environment. Based on the whole-genome sequence data of P. capsici, a full-length gene sequence of GIP was obtained by bioinformatics analysis and sequence alignment. The whole genome of highly pathogenic strain P. capsici SD33 was extracted and used as temple for polymerase chain reaction to amplify cDNA of the GIP gene, and related bioinformatics analysis was performed. The gene was verified by sequencing and ligated with the vector pET28a(+), and the constructed recombinant plasmid was transformed into Escherichia coli Rosetta to express the recombinant protein 6×His-GIP by IPTG induction. The recombinant protein was purified by affinity chromatography in 5 mol/L urea denaturing environment. The purified protein was dialyzed, renatured and concentrated, and then subjected to molecular exclusion chromatography purification. The crystallization experiment using pure protein was carried out, which could provid a basis for clarifying the mechanism of GIP.
Keywords Phytophthora capsici; Glucanase inhibitor protein(GIP); Prokaryotic expression; Purification; Crystallization
從病原菌接触植物到寄主发病,是病原菌解除寄主防御及寄主抵抗病原菌入侵和繁殖相互斗争和协同进化的过程,包含各种信号的传递和寄主在细胞、组织、形态、生理、生化及分子等水平下复杂的变化过程。研究表明病原菌与寄主互作过程中分泌的细胞壁降解酶等致病酶和致病酶抑制蛋白产生于整个侵染过程中[1,2]。
在受到病原微生物侵染时,寄主植物分泌内切-β-1, 3-葡聚糖酶,以分解来自于真菌和卵菌等病原物细胞壁的β-1, 3-葡聚糖聚合物,是寄主防卫机制的一种[3,4]。面对内切-β-1, 3-葡聚糖酶的攻击,疫霉菌等卵菌通过分泌葡聚糖酶抑制蛋白(glucanase inhibitor protein, GIP)表现出抗性[5]。相对于病原物在与寄主互作过程中分泌的葡聚糖酶抑制蛋白,研究更多的是寄主植物产生的β-1, 3-葡聚糖酶[6-8],它通过降解病原物的细胞壁,产生寡聚糖和寡糖激发子,进而增强寄主植物的抗病性[9]。
近年来研究较多的是疫霉属等卵菌病原物中的GIP,如对樟疫霉GIP序列的扩增及不同侵染期表达量的差异性研究等[10]。基因转录、翻译形成的蛋白空间结构是功能基因编码的蛋白质行使生物功能的基础,蛋白质各种功能特性均受其空间结构的调控,不同功能基因均编码特异空间结构的蛋白质,由此决定了生命现象的多样性。因此立足蛋白结构生物学研究,更易于探明特异功能基因遗传本质与调控机理。对GIP蛋白结构的研究最早在致病疫霉上[11],从GIP三维结构上阐明了不同基因作用模式的不同。对毕赤酵母GIP结构的研究阐明了其活性丧失的三维结构基础特征[12]。
对辣椒疫霉菌GIP的研究相对较少,尤其是通过蛋白纯化、晶体生长进而解析其三维结构的研究目前还未见报道[13]。本研究通过原核表达获得辣椒疫霉菌GIP纯蛋白,进而尝试进行蛋白质结晶,以期获得蛋白晶体进而解析其三维结构,为研究辣椒疫霉菌GIP作用机理提供参考。
1 材料与方法
1.1 材料与试剂
辣椒疫霉菌高致病性菌株SD33,山东农业大学真菌及真菌资源利用研究室分离获得并保存;表达载体pET28a(+)(Novagen公司);大肠杆菌菌株(Escherichia coli) BL21 (DE3)、E. coli Rosetta、pEASY-T3载体、限制性内切酶BamHⅠ、EcoRⅠ等,购自北京全式金生物技术有限公司;T4 DNA连接酶、rTaq酶、dNTP、卡那霉素、DNA Marker、蛋白Marker等,购自宝生物工程(大连)有限公司;Tris、NaCl、咪唑等蛋白纯化及晶体生长所需超纯生化试剂,购自上海Sigma公司; IPTG、SDS、乙醇、盐酸等其它试剂为国产分析纯。
1.2 基因GIP的生物信息学分析
通过比对、分析辣椒疫霉菌基因组(JGI: http://genome.jgi-psf.org/Phyca11/Phyca11.home.html)全序列信息获得葡聚糖酶抑制蛋白基因GIP序列信息,利用https://web.expasy.org/protparam/在线分析GIP基因编码蛋白的氨基酸组成、理论分子量和等电点等;蛋白质序列的跨膜区分析和信号肽分析分别利用TMHMM Server v. 2.0(http://www.cbs.dtu.dk/services/TMHMM/)和SignalP 4.0 Server(http://www.cbs.dtu.dk/services/SignalP-4.0/)在线软件进行分析;利用Protean软件对GIP二级结构组成、亲疏水性等性质进行预测及分析。
1.3 基因克隆及原核表达载体构建
通过获得的葡聚糖酶抑制蛋白基因GIP核苷酸序列信息设计引物,正向引物为GIP-F:5′- CGCGGATCCGAACACGTTGAACGTCAGCTT-3′(下划线部分为BamHⅠ酶切位点),反向引物为GIP-F:5′- CCGGAATTCTTATTTCGTGACGGAGTTGAT -3′(下划线部分为EcoRⅠ酶切位点)。基因克隆载体为pEASY-T3载体,原核表达载体为pET28a(+),以辣椒疫霉高致病菌株SD33全基因组为模板扩增GIP基因的cDNA,基因克隆与原核表达载体构建具体步骤参照文献[14]。
1.4 重组质粒pET28a/GIP的鉴定及诱导表达
采用PCR扩增、酶切验证筛选阳性克隆重组质粒pET28a/GIP,由济南博尚生物技术有限公司进行测序验证。将测序验证后的阳性克隆提取质粒转化E. coli Rosetta菌株,过夜培养后挑取单菌落用5 mL含50 mg/L卡那霉素的LB培养基于37℃、200 r/min振荡培养至OD600值达0.4~0.6。菌液分别加入终浓度为0、0.1、0.2、0.4、0.6、0.8、1.0 mmol/L的IPTG,于16℃、150 r/min振荡培养20 h,SDS-PAGE电泳检测重组蛋白表达情况,确定最佳诱导条件并进行大量诱导表达含有6个组氨酸标签的重组蛋白6×His-GIP,收集菌液备用。
1.5 重组蛋白6×His-GIP的纯化
在普通重悬缓冲液A(20 mmol/L Tris,pH 8.5;150 mmol/L NaCl)并添加一定的超声辅助缓冲液B[10%(V/V)甘油,5 mmol/L β-巯基乙醇,0.5%(V/V)Tween-20]下重组蛋白为包涵体,更换含有尿素的缓冲液C(缓冲液A+5 mol/L尿素)重悬沉淀即可使沉淀溶解,4℃、15 000 r/min离心30 min,取上清按照Ni-NTA蛋白纯化试剂盒操作说明对重组蛋白6×His-GIP进行纯化。其中洗杂液为缓冲液D(缓冲液C+20 mmol/L咪唑),洗杂500 mL左右;洗脱液为缓冲液E(缓冲液C+500 mmol/L咪唑),洗脱20 mL左右;对洗脱液进行低温过夜透析,透析液分别为缓冲液A+3 mol/L尿素、缓冲液A+1 mol/L尿素、缓冲液A,直至除去尿素,对重组纯蛋白进行复性。
对亲和层析纯化后复性纯蛋白进行分子排阻层析纯化,纯化所用缓冲液为缓冲液A+5 mmol/L DTT,所用层析柱为Superdex-75。
1.6 重组蛋白6×His-GIP的结晶
对层析纯化后的重组蛋白6×His-GIP采用气相扩散、坐滴法进行蛋白结晶尝试,选用Hampton Research試剂盒Crystal ScreenⅠ和Ⅱ、PEG/Ion ScreenTM、Salt RxTM1等进行晶体生长条件初筛,蛋白浓度选用2、5、10 mg/mL,温度选用20℃。
2 结果与分析
2.1 GIP的理化性质及生物信息学分析
辣椒疫霉菌葡聚糖酶抑制蛋白基因GIP序列全长为777 bp,最大开放阅读框 (ORF) 长774 bp,ORF编码一个含258个氨基酸残基的蛋白质,预测编码产物大小约为24.7 kD,无跨膜区,信号肽含有20个氨基酸残基,5个半胱氨酸,等电点为4.85。基本理化性质见表1。
对GIP的二级结构组成、亲疏水性等性质进行预测与分析。由图1可知,组成GIP的二级结构主要为β折叠,α螺旋和不规则卷曲较少;疏水性区域相对较多,这和后续蛋白纯化过程中GIP较难溶相吻合。
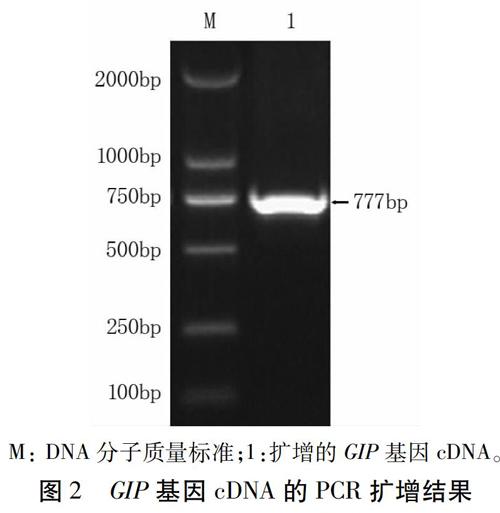
2.2 GIP基因cDNA的PCR扩增
GIP基因PCR扩增产物经琼脂糖凝胶电泳,获得与预期结果一致的条带(图2),大小约777 bp。扩增基因测序结果与公布的辣椒疫霉菌全基因组GIP基因比对,发现存在12个碱基位点的差异,翻译成氨基酸后的序列存在3个位点的差异,可能是由于菌株小种专化型不同造成的。
2.3 GIP基因cDNA的原核表达
将测序验证后的GIP基因cDNA与表达载体pET28a(+)连接转化E. coli Rosetta表达菌株,菌液经不同浓度IPTG诱导,以空载体原核表达产物为阴性对照,通过SDS-PAGE电泳检测重组蛋白6×His-GIP表达情况,发现在28 kD左右出现一条明显的蛋白条带(图3),不同IPTG浓度对重组蛋白表达量影响不大。最终确定诱导条件为0.1 mmol/L的IPTG 16℃下诱导20 h左右收集菌液,1 L菌液中大约收集3 g的菌体。
2.4 重组蛋白6×His-GIP的纯化及复性
重组蛋白在普通缓冲液A或添加增溶剂B下均以包涵体的形式存在,在缓冲液中添加尿素至5 mol/L时目标蛋白溶解,因重组蛋白含有His标签,所以使用Ni柱进行亲和层析纯化。蛋白经挂柱、洗杂、洗脱后以单一条带出现在SDS-PAGE蛋白凝胶上(图4)。挂柱后的流穿液仍有较多重组蛋白,可能与Ni柱的有效载量或变性后的蛋白亲和层析特异性较低、相对容易被洗杂液洗脱下来等因素有关。
对洗脱蛋白采取低温过夜透析、逐渐降低尿素浓度的方法进行复性,复性后的重组蛋白6×His-GIP以可溶形式存在于普通缓冲液A中,利于下游试验,但蛋白浓度有所下降(图4),即目标蛋白在复性过程中有所损失,部分蛋白复性未成功而形成沉淀。对亲和层析纯化后复性纯蛋白浓缩后进行分子排阻层析纯化,并对单一峰值下的蛋白进行收集并浓缩以进行下游结晶试验。分子排阻层析纯化后的重组蛋白6×His-GIP为单一峰,但对峰值下的蛋白收集浓缩后经SDS-PAGE分析出现紧邻的两条条带(图5),此蛋白在高浓度下可能发生了寡聚化作用或生成了二硫键。
2.5 纯蛋白6×His-GIP的结晶
对纯蛋白6×His-GIP进行酶活性测定(相关结果另文发表),显示纯蛋白6×His-GIP具有活性。对蛋白进行结晶尝试,发现形成了一定大小的晶核(图6),但至今未生长出质量较好的蛋白晶体,目前正在继续优化结晶条件。
3 讨论与结论
葡聚糖酶抑制蛋白GIP是与病程相关蛋白类似的一种抗性蛋白,研究较多的是存在于寄主植物上且能引发寄主防卫反应的GIP分泌蛋白[3,4],而产生于病原菌的GIP与寄主植物的区别在于此蛋白为病原菌本身在病理或病理相关环境下诱导产生的一类蛋白,是病原菌对寄主植物抗性反应表现出来的自身抗性反应。
2008年辣椒疫霉菌全基因组序列草图由美国能源部基因研究所公布于众(http://genome.jgi-psf.org/Phyca11/Phyca11.home.html)并不断更新完善。通过生物信息学分析,越来越多人们感兴趣的基因被发现进而为揭示其相关功能并被人们利用提供了便利。通过生物信息学分析我们首次从高致病性辣椒疫霉菌菌株SD33上克隆到GIP基因,与公布的基因组序列存在微小差异,可能是因为测序菌株与本试验所用菌株小种专化型的不同造成的,并不影响基因的功能特性。
近年来,借助基因组学和分子遗传学技术,开展了系列植物病原菌致病因子功能特性及其致病机制研究,取得了若干有价值的研究结果,但对病原菌抗病因子的研究资料匮乏。本研究选取抗病因子GIP为研究对象,试图解析其三维结构即从原子水平探明其遗传本质与调控机理,其基础就在于获得GIP纯蛋白并生长出蛋白晶体。
本研究利用pET系统构建了GIP原核表达体系,在试用E. coli BL21 (DE3)菌株未表达出重组蛋白时改用E. coli Rosetta菌株成功表達出目的蛋白,为表达真核基因尤其是含稀有密码子的基因提供了借鉴。对表达出的重组蛋白采用低浓度诱导剂、低温长时间诱导的策略使重组蛋白充分折叠以免形成包涵体,但表达出的重组蛋白6×His-GIP在普通缓冲液或添加增溶剂下均以包涵体的形式存在。综合考虑蛋白回收率及后期蛋白复性、结晶等因素,我们选择在5 mol/L尿素浓度下进行纯化及复性,并通过分子排阻层析进行再纯化,但浓缩后的蛋白可能发生了寡聚化作用或生成了二硫键,即蛋白的均一性不够高,这也是在后续结晶试验时只能形成晶核但未成功培养出较好晶体的原因之一。在后续试验中我们将通过提高蛋白纯度及均一性或尝试真核表达得到较高纯度及均一性GIP蛋白,进而培养出适宜解析其三维结构的蛋白晶体,以期从更深层阐明GIP作用机理。
参 考 文 献:
[1]Kikot G E, Hours R A, Alconada T M. Contribution of cell wall degrading enzymes to pathogenesis of Fusarium graminearum: a review[J]. Journal of Basic Microbiology, 2009, 49(3): 231-241.
[2]Kamoun S. A catalogue of the effector secretome of plant pathogenic Oomycetes[J]. Annual Review of Phytopathology, 2006, 44(1): 41-60.
[3]Kauffmann S, Legrand M, Geoffroy P, et al. Biological function of pathogenesis-related proteins: four PR proteins of tobacco have 1, 3-beta-glucanase activity[J]. EMBO Journal, 1987, 6(11): 3209-3212.
[4]Stintzi A, Heitz T, Prasad V, et al. Plant ‘pathogenesis-related proteins and their role in defense against pathogens[J]. Biochimie, 1993, 75(8): 687-706.
[5]Ham K S, Wu S C, Darvill A G, et al. Fungal pathogens secrete an inhibitor protein that distinguishes isoforms of plant pathogenesis-related endo-1, 3-glucanases[J]. The Plant Journal, 2002, 11(2): 169-179.
[6]趙爽, 杨柳, 杨亮, 等. 烟草β-1, 3-葡聚糖酶的蛋白序列分析[J]. 天津农业科学, 2018, 24(10): 6-9.
[7]马世明, 罗家佐, 王德勋, 等. 烟草β-1, 3-葡聚糖酶的生物学分析[J]. 安徽农业科学, 2018, 46(17): 96-97, 116.
[8]管翠萍, 王俊文, 王丽娟, 等. 枸杞LbXEGIP1基因的克隆与生物信息学分析[J]. 分子植物育种, 2018, 16(19): 6235-6241.
[9]蒋选利, 李振岐, 康振生. β-1, 3-葡聚糖酶与植物的抗病性[J]. 西北农业学报, 2005, 14(4): 135-139.
[10]Martins I M, Martins F, Belo H, et al. Cloning, characterization and in vitro and in planta expression of a glucanase inhibitor protein (GIP) of Phytophthora cinnamomi[J]. Molecular Biology Reports, 2014, 41(4): 2453-2462.
[11]Damasceno C M B, Bishop J G, Ripoll D R, et al. Structure of the glucanase inhibitor protein (GIP) family from Phytophthora species suggests coevolution with plant endo-beta-1, 3-glucanases[J]. Molecular Plant-Microbe Interactions, 2008, 21(6): 820-830.
[12]Scarafoni A, Consonni A, Pessina S, et al. Structural basis of the lack of endo-glucanase inhibitory activity of Lupinus albus γ-conglutin[J]. Plant Physiology and Biochemistry, 2016, 99: 79-85.
[13]George K J, Babu O R, Kumar I P V, et al. Interplay of genes in plant-pathogen interactions: in planta expression and docking studies of a beta 1, 3 glucanase gene from Piper colubrinum and a glucanase inhibitor gene from Phytophthora capsici[J]. Physiology & Molecular Biology of Plants An International Journal of Functional Plant Biology, 2016, 22(4): 567-573.
[14]Zhang X G, Li F, Wang H Z. Comparison of expression, purification and characterization of a new pectate lyase from Phytophthora capsici using two different methods[J]. BMC Biotechnology, 2011, 11(32): 1-7.
收稿日期:2019-07-12
基金项目:山东省引进顶尖人才“一事一议”专项经费资助项目;淄博市科技发展计划资助项目(2018kj010073)
通讯作者:王会征(1984—),男,博士,讲师,研究方向为植物病害及其致病机理。E-mail: hzwang@sdut.edu.cn

