铜冶炼烟尘碱浸除砷试验研究
吴星琳,罗仁昆,李 涛,陈 杭,葛素志,衷水平,王俊娥
(1.厦门紫金矿业技术有限公司,福建 厦门 361115;2.紫金铜业有限公司,福建 龙岩 364204;3.固体废弃物资源化利用福建省高校工程研究中心,福建 龙岩 364000)
铜冶炼烟尘的处理,早期以火法为主。国外,如俄罗斯和日本的铜冶炼企业采用回转窑、反射炉或电弧炉处理铜冶炼烟尘[1],而国内企业主要采取直接返炉熔炼处理,这不仅降低产能,也会造成砷的恶性循环累积,影响整个冶炼系统[2-3]。熔炼过程中产生的含砷挥发物(As2O3)会与铜形成亚砷酸铜和砷酸铜,溶于熔体中,严重腐蚀炉体耐火材料,而且对人体健康也有极大危害;过量的砷随烟气进入烟气净化阶段,会导致制酸系统钒触媒中毒,降低SO2转化率,增大废酸处理工序砷脱除压力及成本;过量的砷随阳极板进入电解工序会导致电解液中砷浓度增大,溶液电阻增大,槽电压升高,直流电耗增加;另外,砷易与锑、铋等杂质形成漂浮阳极泥,黏附在阴极上,易引发阴极铜表面不光滑、条纹深、长粒子等现象,且会使短路率和残极率增大,严重影响电解铜产量和质量[4-6]。
目前,烟尘中砷的湿法处理主要分为酸浸工艺[7-10]和碱浸工艺[11-13]。酸浸工艺多采用硫酸作浸出剂,在此过程中砷、铜、锌等具有明显的分散性,浸出液沉砷时伴随有价金属夹带损失;碱浸工艺相对酸浸工艺具有较优的选择性,但碱度较低时砷浸出率低,而碱度较高时铜、铅等金属会大量溶出,使回收成本增加。
试验研究在特定NaOH浓度(控制pH)条件下,烟尘中的砷与铜、铅、锌等元素之间不同的浸出特性,并提出二级逆流碱浸除砷,控制浸出终点碱质量浓度,以实现砷的高效浸出,同时有效抑制铜、铅、锌等元素的浸出。
1 热力学分析
1.1 As-H2O系E-pH关系
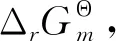
砷离子浓度1 mol/L、温度298 K、压力101 kPa条件下的As-H2O系E-pH关系如图1所示,其中,a为氢线,b为氧线。
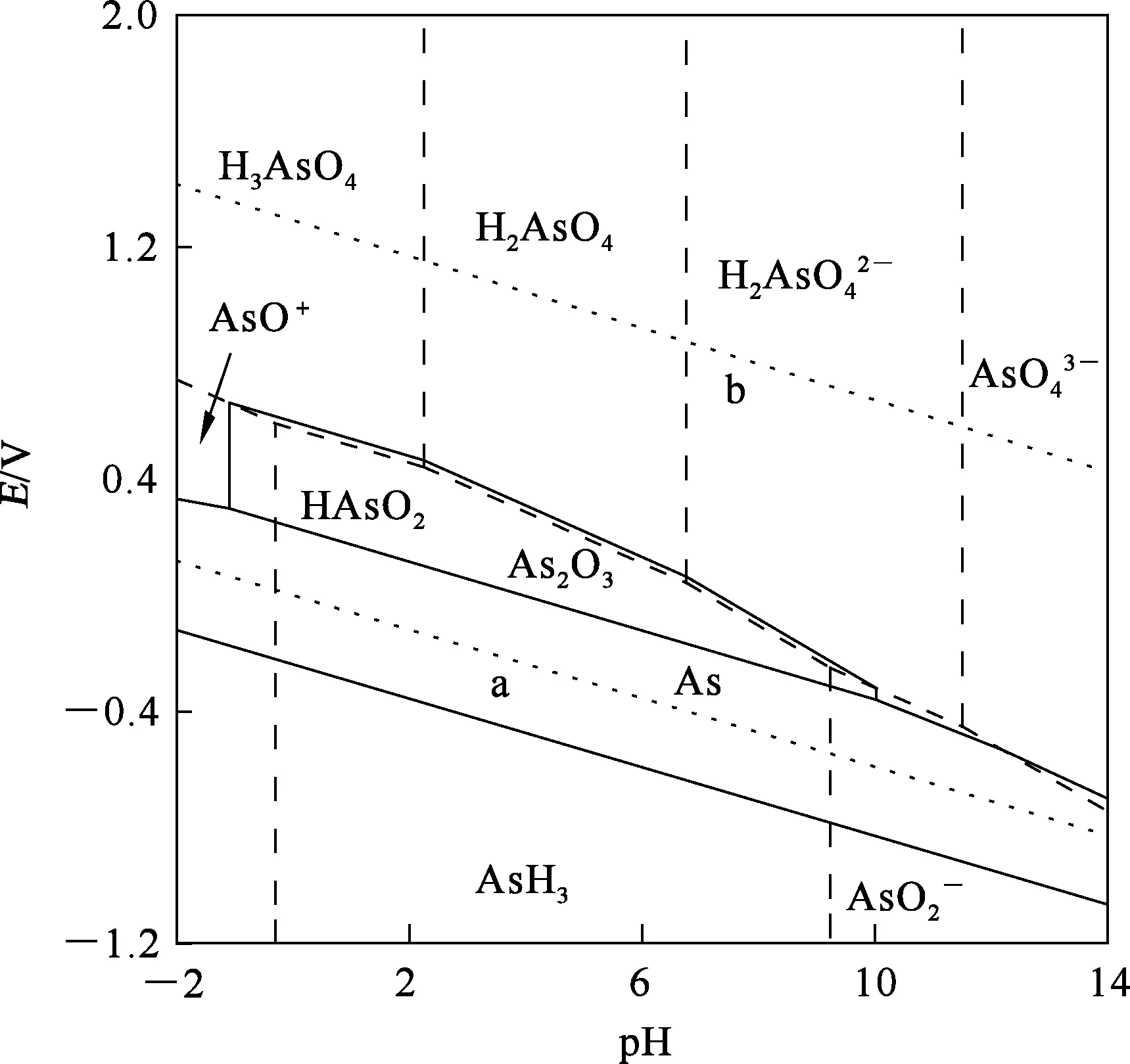
图1 298 K条件下的As-H2O系E-pH关系
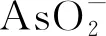
根据As-H2O系E-pH关系及砷在烟尘中的存在形式,推断砷在氢氧化钠氧化浸出过程中可能发生如下反应,即含砷化合物与NaOH反应,最终以Na3AsO4和NaAsO2形式溶于溶液中。

(1)

(2)

(3)
1.2 Cu、Pb配合物的物种分布
在一定条件下,碱性溶液中,Cu2+、Pb2+可与
OH-反应生成金属配离子,而游离金属离子及配离子浓度可用金属累积稳定常数计算,计算时以浓度替代活度。
(4)
(5)
则溶液中金属离子总浓度[Me]T为
(6)
即
β2[OH-]2+…+βn[OH-]n}。
(7)
式中:Ksp(Me(OH)z)—298 K条件下金属氢氧化物的溶度积;βn—累积稳定常数。溶液中各种配合物金属浓度与金属总浓度之比(质量分数,wi),计算公式为
(8)
由式(8)可知:溶液中每种金属物种的质量分数与积累稳定常数和游离氢氧根浓度有关,根据不同金属的积累稳定常数和游离配体浓度,可绘制金属物种分布与游离配体浓度之间的关系曲线,同时可以计算不同氢氧根浓度条件下金属离子在溶液中的总浓度。
在298 K和离子强度c=0条件下,铜、铅氢氧化物各级积累稳定常数见表1[22]。

表1 铜、铅氢氧化物各级积累稳定常数(c=0)
在碱性溶液中,Cu、Pb可与OH-发生配位反应而溶解。根据式(7)(8)计算结果,绘制溶液中总铜、总铅浓度随OH-浓度的变化曲线及溶液中各种配合离子分布随OH-浓度的变化曲线,分别如图2、3所示。可以看出:随[OH-]增大,溶液中[Cu]T、[Pb]T增大,且Cu2+、Pb2+配合物的配
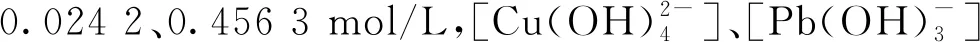
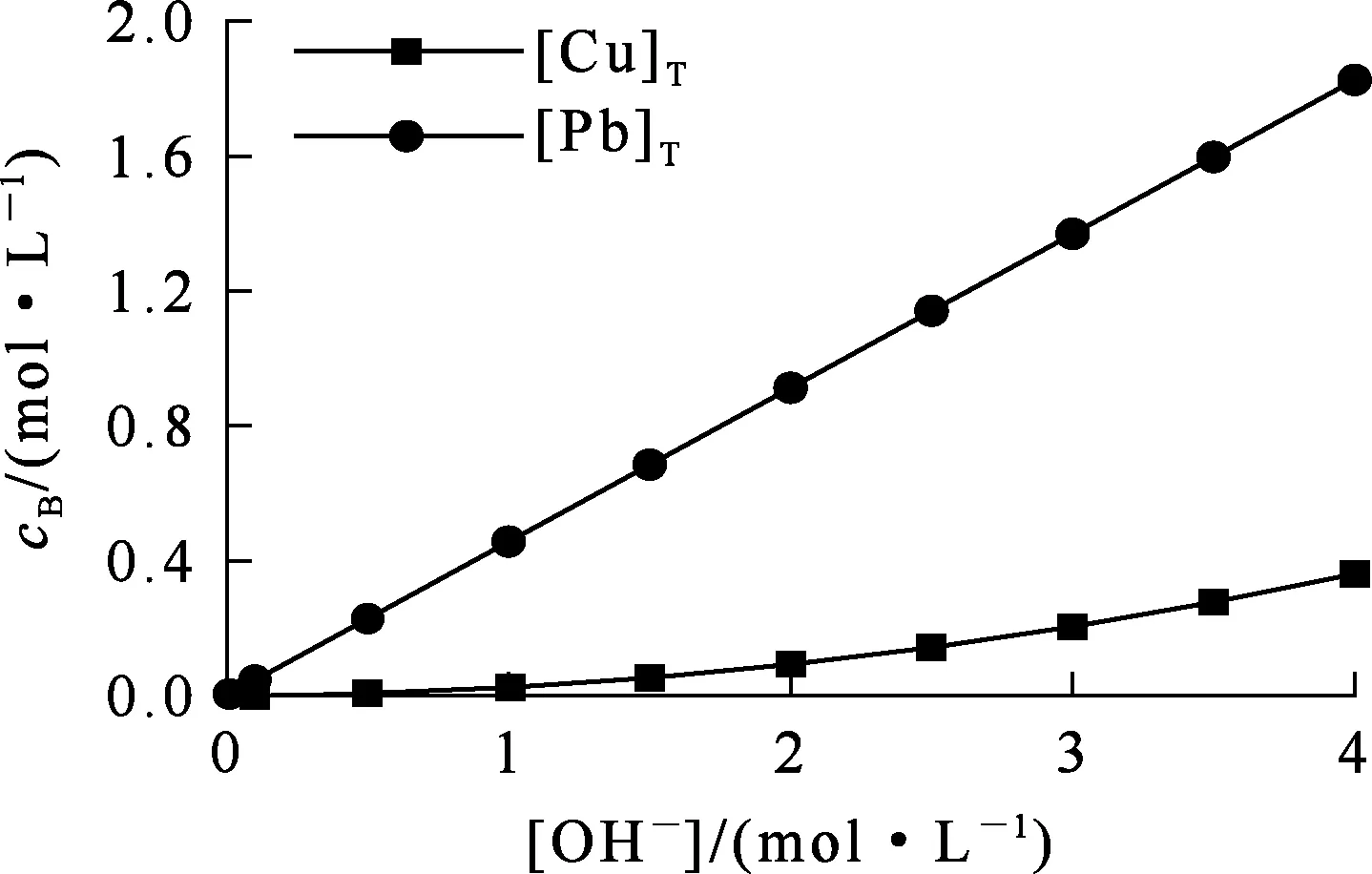
图2 总铜、总铅浓度随OH-浓度的变化曲线
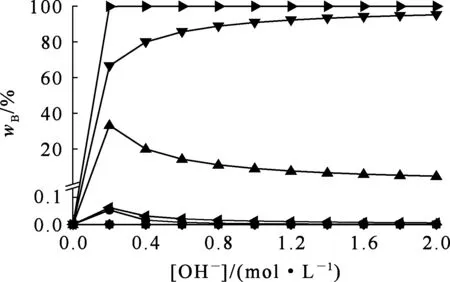
—■—[Cu(OH)+];—●—[Cu(OH)2];—▲—▼◆—[Pb(OH)+];
2 碱性体系中砷的脱除
2.1 试验原料、试剂及仪器
试验用铜冶炼烟尘取自福建某铜冶炼企业。烟尘呈灰黑色,光滑细粉状,经105 ℃鼓风干燥,研磨过80目筛。铜冶炼烟尘的XRD物相分析结果如图4所示,多元素化学分析结果见表2。可以看出:烟尘主要含有铜、铁、砷、铅、锌等,铜、铁、砷质量分数分别为20.05%、14.86%和7.38%;各主要元素分别以铁酸铜、砷酸盐(铅、锌、铜、铁)及硫酸铜等形式存在。
试验所用试剂主要是分析纯NaOH。
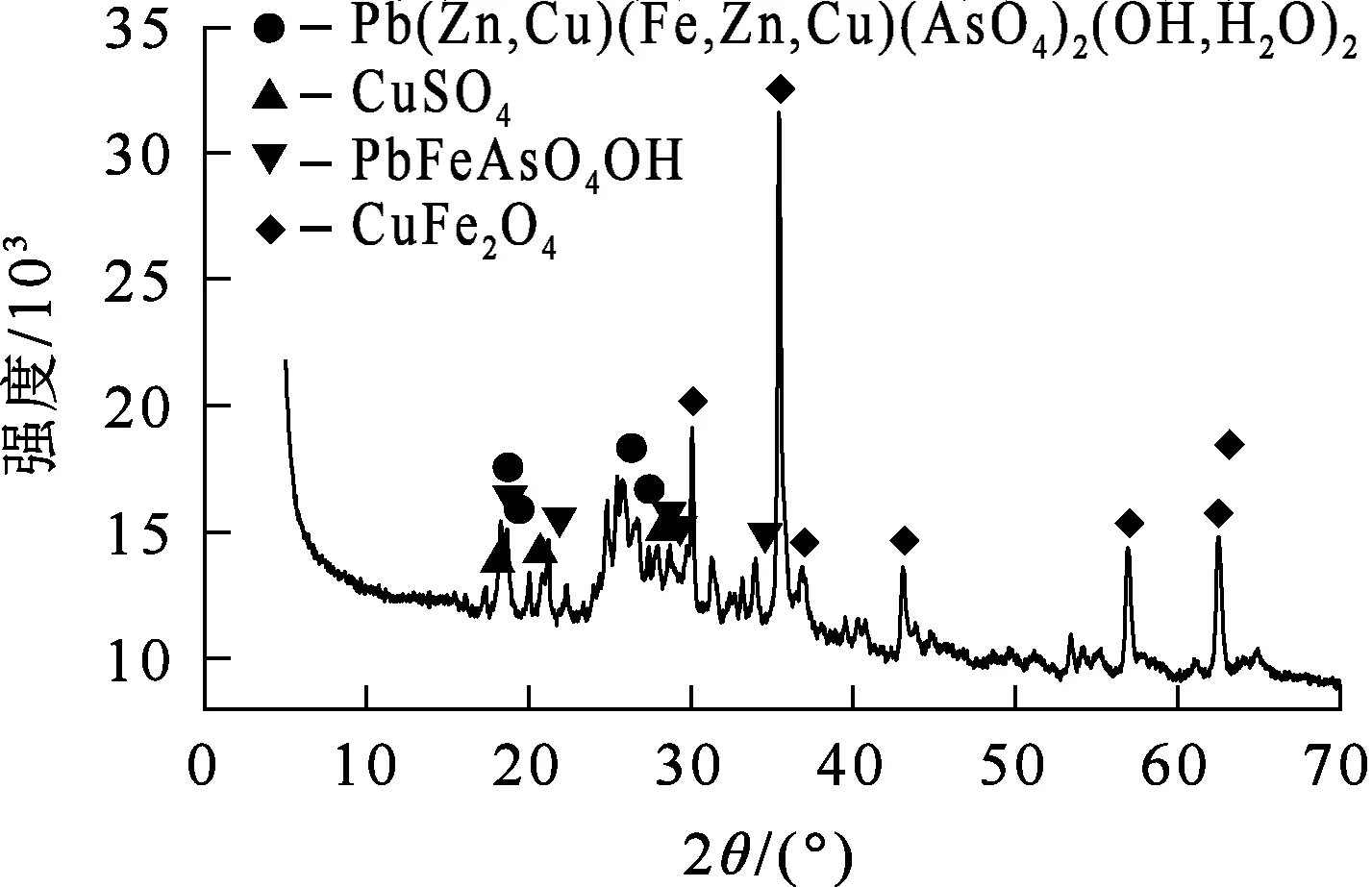
图4 铜冶炼烟尘的XRD物相分析结果

表2 铜冶炼烟尘的多元素化学分析结果 %
试验用主要仪器有XMTH-2C型恒温电热套,DGS-Ⅲ型原子发射光谱仪,X′Pert Pro MPD型X射线衍射仪。
2.2 试验方法
取一定量、一定浓度NaOH溶液于烧瓶中,然后将烧瓶置于恒温电热套中;打开搅拌,在一定搅拌速度及温度下加入一定质量烟尘,同时计时;反应一定时间后,取出反应物料,真空抽滤;滤渣烘干并称重,分析滤液及滤渣中各金属含量,计算各金属浸出率。
2.3 试验结果与讨论
2.3.1 温度对烟尘浸出的影响
烟尘质量100 g,碱初始质量浓度100 g/L,液固体积质量比5∶1,反应时间2 h,温度对烟尘浸出的影响试验结果如图5所示。可以看出:砷、锌浸出率随温度升高而提高,在80 ℃时,分别达85.23%、24.38%;但温度超过80 ℃后,砷、锌浸出率增幅趋缓。这是由于随温度升高,分子活化运动加剧,分子间有效碰撞概率增大,使得金属浸出率提高。铜、铅浸出率先增大后降低,这是因为温度升高有利于铜、铅与OH-配合,但由于终点碱质量浓度不断下降,使得铜、铅配合反应受到抑制。综合考虑,确定浸出时适宜温度为80 ℃。
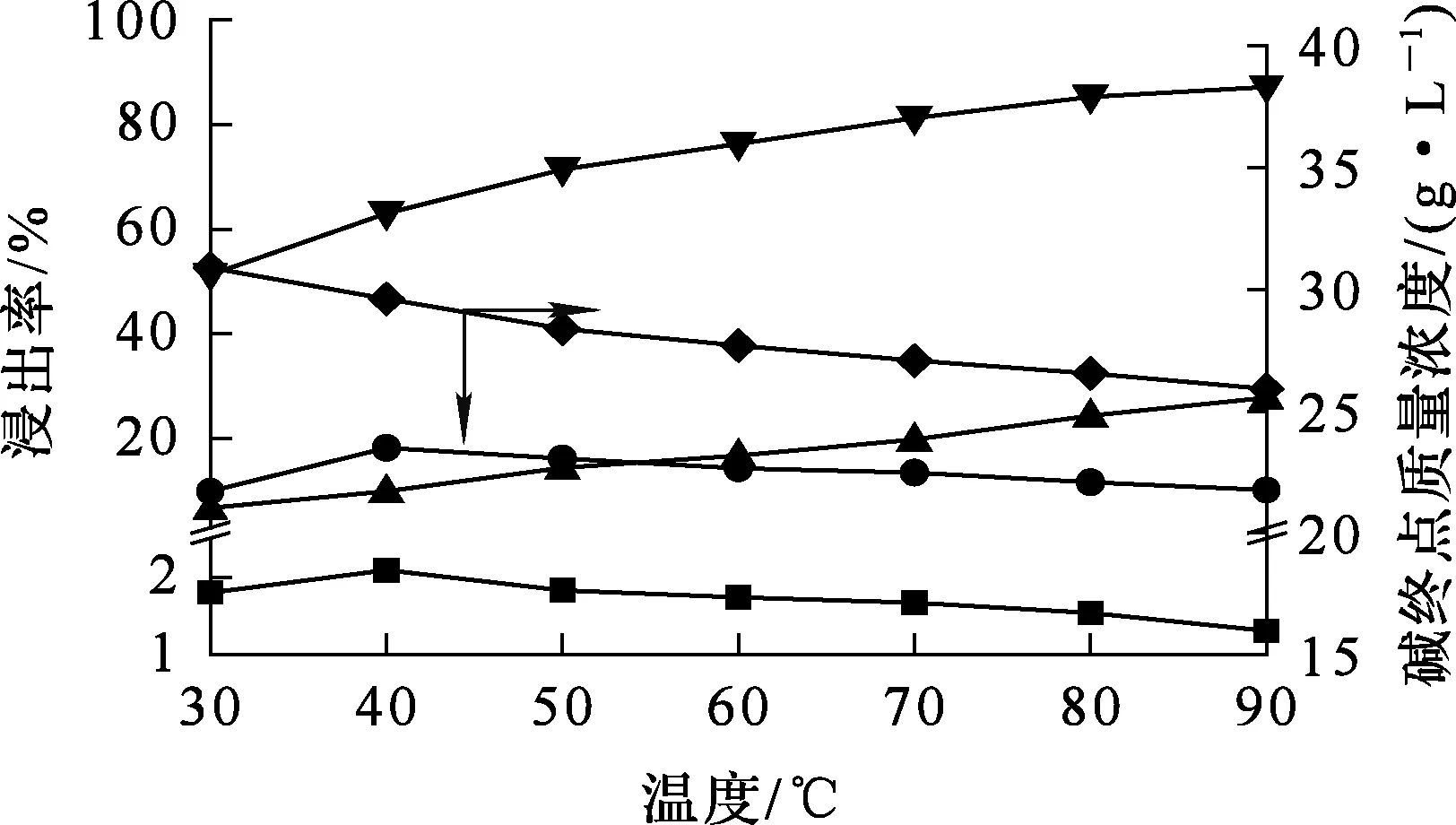
浸出率/%:—■—Cu;—●—Pb;—▲—Zn;—▼—As。
2.2.2 碱初始质量浓度对烟尘浸出的影响
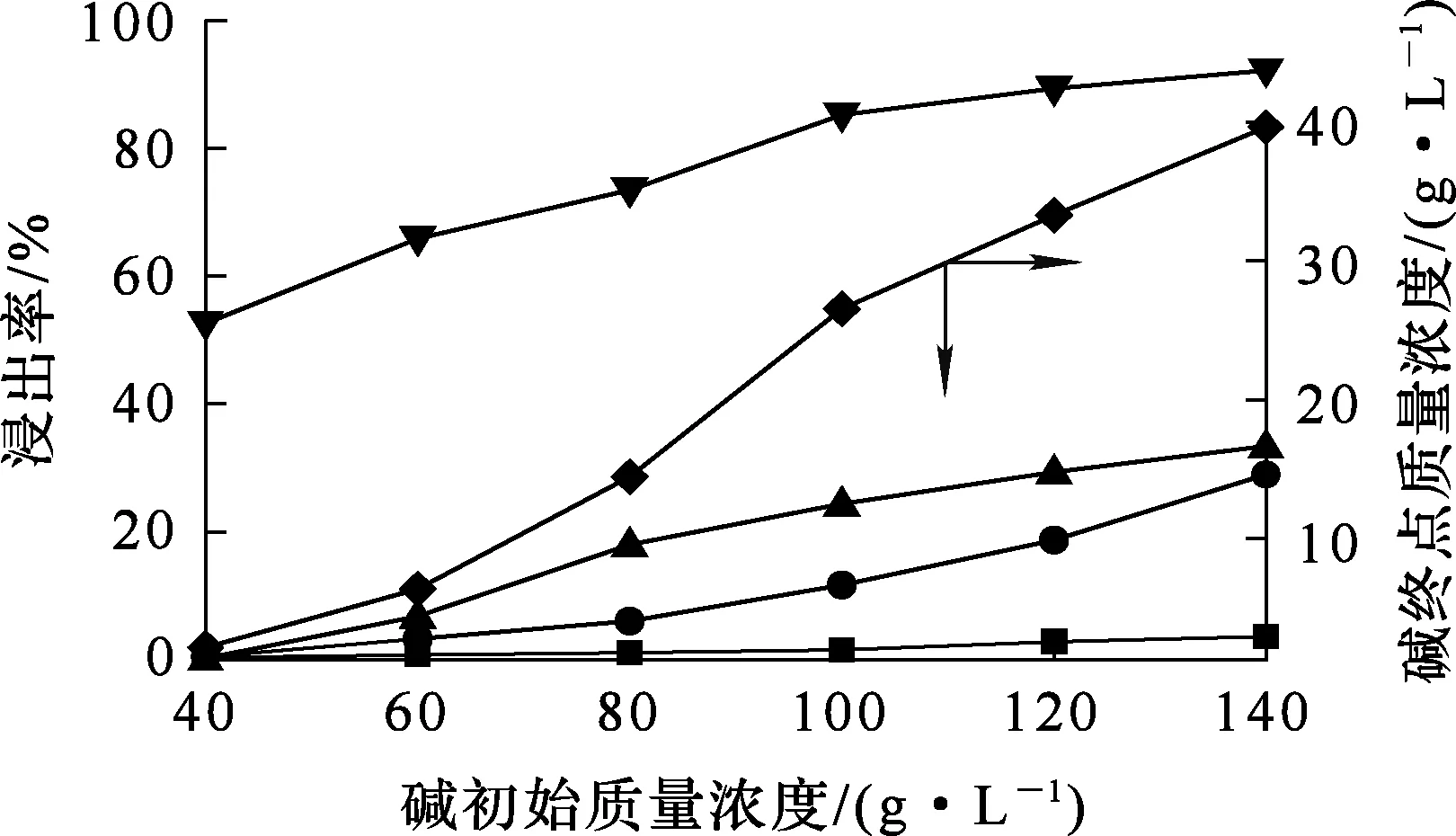
烟尘质量100 g,温度80 ℃,液固体积质量比5∶1,反应时间2 h,碱初始质量浓度对烟尘浸出的影响试验结果如图6所示。
浸出率/%:—■—Cu;—●—Pb;—▲—Zn;—▼—As。
由图6看出:砷、锌、铜、铅浸出率都随碱初始质量浓度增大而提高;砷、锌浸出率在碱度超过100 g/L后,提高幅度较小。这是因为氢氧化钠浓度较低时,浸出反应不完全;随氢氧化钠浓度增大,反应驱动力提高,反应趋向完全;碱初始质量浓度由40 g/L增大至140 g/L时,烟尘周围OH-浓度处于饱和状态,使得化学反应趋于平衡。为降低有价金属损失率,确定碱初始质量浓度以100 g/L为最佳。
2.2.3 液固体积质量比对烟尘浸出的影响
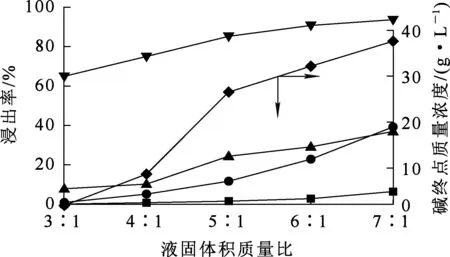
烟尘质量100 g,温度80 ℃,碱初始质量浓度100 g/L,反应时间2 h,液固体积质量比对烟尘浸出的影响试验结果如图7所示。
浸出率/%:—■—Cu;—●—Pb;—▲—Zn;—▼—As。
由图7看出,砷、锌、铜、铅浸出率均随液固体积质量比增大而提高:随液固体积质量比增大,在碱质量浓度一定条件下,碱的量增加,溶液中离子扩散驱动力增大,有利于溶解反应正向进行;但液固体积质量比超过5∶1后,烟尘中的铜、铅生成配合物,溶解量增大。因此,确定液固体积质量比以5∶1为宜。
2.2.4 反应时间对烟尘浸出的影响
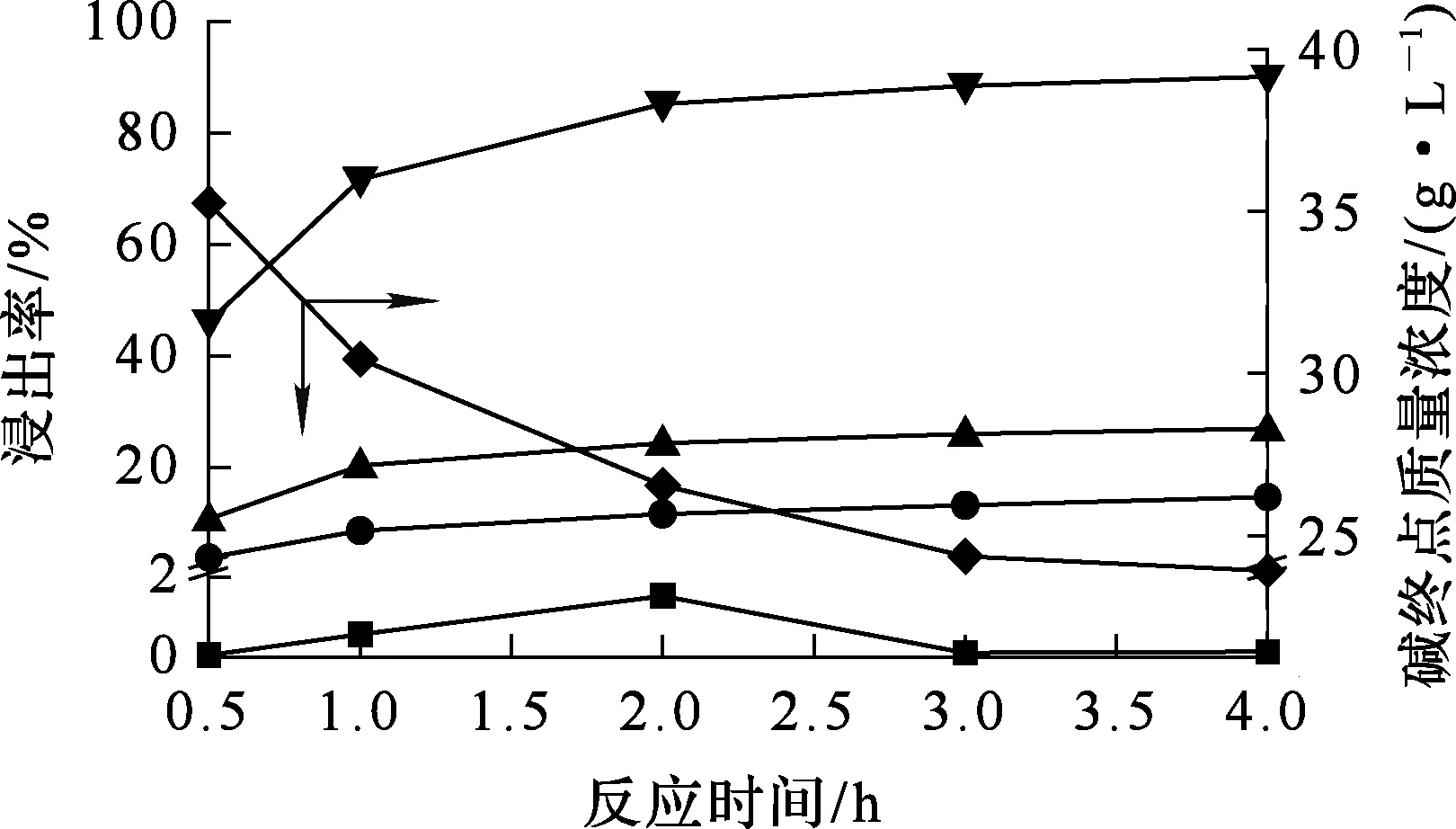
烟尘质量100 g,温度80 ℃,碱初始质量浓度100 g/L,液固体积质量比5∶1,反应时间对烟尘浸出的影响试验结果如图8所示。
浸出率/%:—■—Cu;—●—Pb;—▲—Zn;—▼—As。
由图8看出:随反应时间延长,砷、锌、铜、铅浸出率均有所提高;反应时间超过2 h后,各元素浸出率均趋于稳定。所以,适宜浸出时间为2 h。
2.2.5 二级逆流浸出
为降低浸出液中铜、铅质量浓度,减少烟尘有价金属损失,在优化条件(碱初始质量浓度100 g/L,浸出温度80 ℃,液固体积质量比5∶1,反应时间2 h)下,进行二级逆流碱浸试验,工艺流程如图9所示。体系经过2次平衡,再进行5次浸出,试验结果见表3~5。将1#~5#浸出渣进行混合,混合浸出渣的XRD分析结果如图10所示。
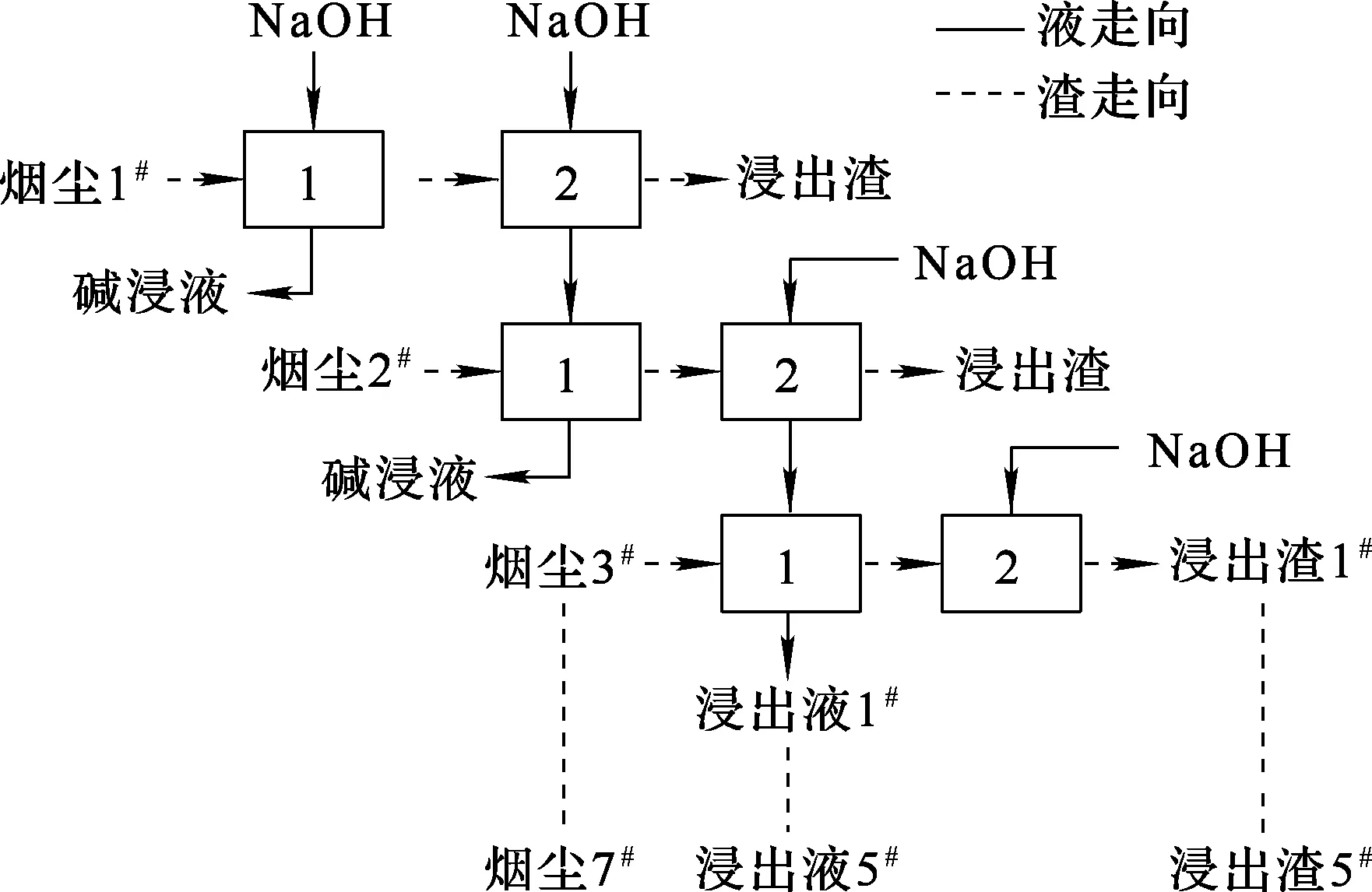
图9 二级逆流碱浸试验工艺流程
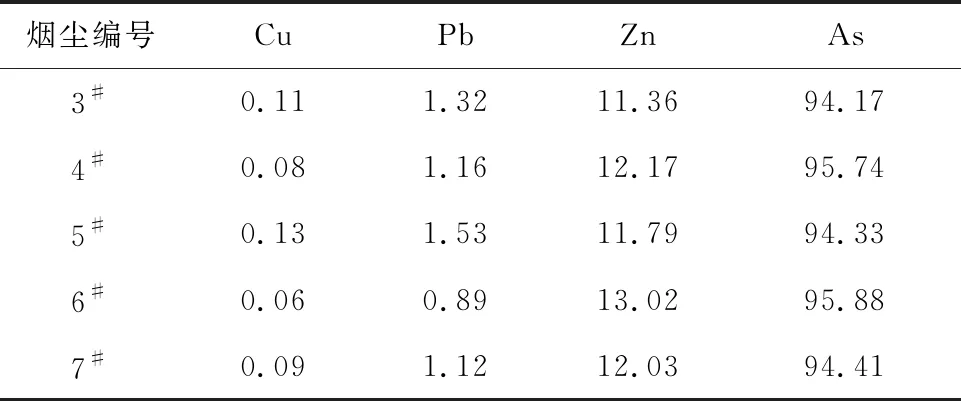
表3 二级逆流碱浸后烟尘中各元素浸出率%
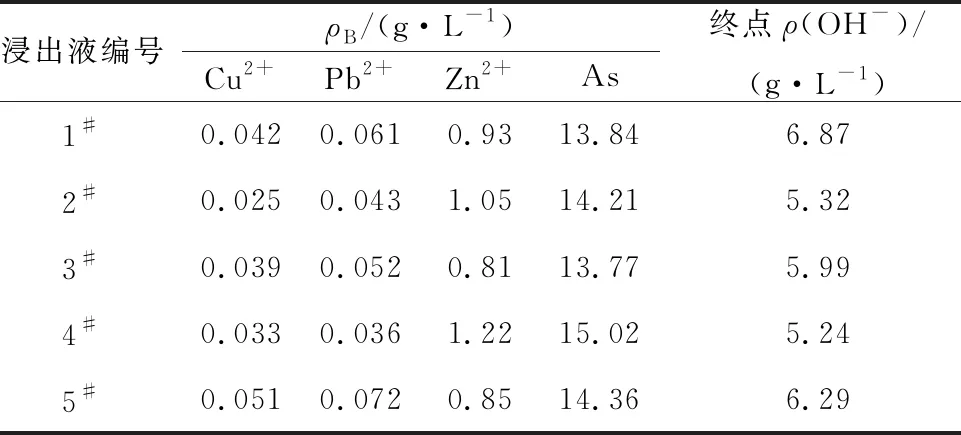
表4 浸出液中各元素质量浓度
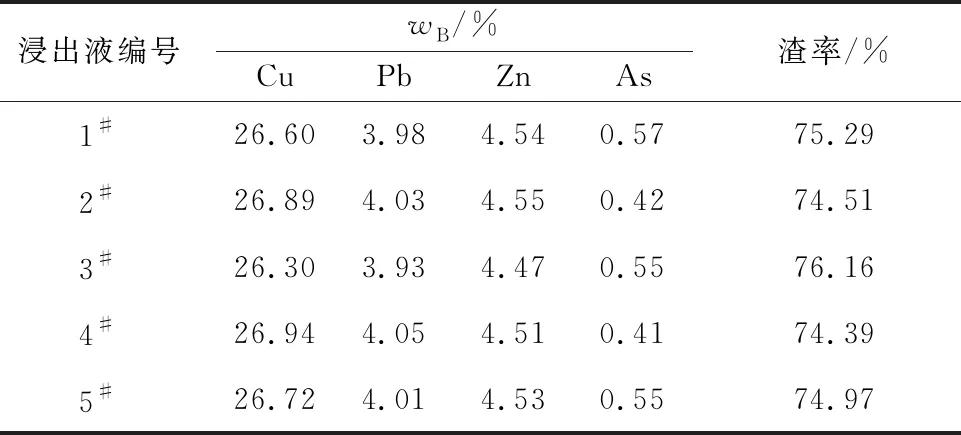
表5 浸出渣中各元素质量分数
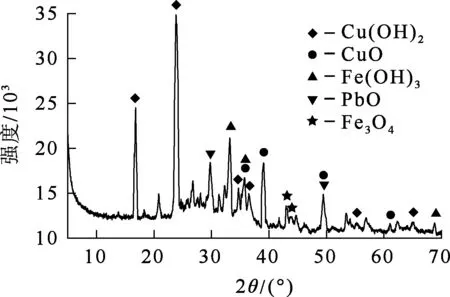
图10 1#~5#混合浸出渣的XRD分析结果
由表3看出:最佳条件下,采用二级逆流浸出,As浸出率由85.25%提升至94%以上,且铜、铅溶出率大幅减小;溶液中Cu2+、Pb2+质量浓度分别由0.62、0.71 g/L降至0.03、0.05 g/L,实现了烟尘选择性强化除砷。浸出渣中存在的物相主要为Cu(OH)2、CuO、Fe(OH)3、PbO等,其中CuO、PbO可能是由Cu(OH)2、Pb(OH)2受热分解而产生。
3 结论
铜冶炼烟尘中含有铜、砷、铁、铅、锌等元素,采用碱液溶解可以去除砷。热力学分析及浸出试验结果表明,在碱初始质量浓度100 g/L、浸出温度80 ℃、液固体积质量比5∶1、反应时间2 h条件下,砷浸出率为85.23%。
在最优化条件下进行二级逆流浸出,浸出体系经2次平衡,随后的5次浸出结果可使砷浸出率达94%以上,开路浸出液中,铜、铅质量浓度分别降至0.03、0.05 g/L,实现了选择性高效脱砷。

