磷酸银/二硫化钼对碘离子的吸附性能试验研究
钟玮鸿,韩雪雯,刘 畅,崔耿堃,黄 剑,孙艳兵,刘云海,柳玉辉
(东华理工大学 核科学与工程学院,江西 南昌 330013)
放射性废物对人类健康和生态环境具有潜在威胁。如何安全高效地去除和回收放射性核素受到高度重视[1-5]。放射性碘是核裂变不可避免的产物之一。核试验释放、核电站运行和重大核事故泄露是放射性碘的主要来源[6-9]。碘有多种同位素,已知的碘同位素有37种,其中127I是稳定同位素,其余均具有放射性。碘的放射性同位素由裂变核素(特别是铀-235)的裂变产生,它们的半衰期从大约8 d(131I)到1.6×107年(129I)不等。由于碘同位素具有相同的电子结构,因此在许多情况下它们的物理和化学性质难以区分。放射性碘可存在于水、土壤和大气中,其中主要存在于水溶液中。放射性碘由于具有半衰期长、毒性大等特点,易对环境造成污染,而且易被人体吸收富集,使人受到较大剂量的持续照射[10]。
碘离子总量大,易迁移,被认为是最难处理的放射性核素之一[11]。目前对于去除溶液中的碘离子主要有溶剂萃取法、化学沉淀法、膜分离法、吸附法等[12-15]。然而,溶剂萃取法和化学沉淀法操作成本高,去除率低,易产生二次污染物;而膜分离法的仪器复杂、价格相对昂贵,并且易于结垢,结垢或膜降解都影响去除率;吸附法则因为具有原料易得、工艺简单、污染小、能耗低等优点而受到广泛关注。常见的碘离子吸附剂有银基材料[16-17]、铋基材料[18]、铜基材料[19]、铅基材料[20]等。但这些材料存在合成复杂、污染大、吸附容量低、吸附速率慢等缺点。因此,非常迫切需要一种合成简单、吸附效率高的碘吸附材料。
目前,二维材料因其具有独特的结构与性质引起了广大研究者的关注。MoS2是典型的二维材料,与石墨烯和六方氮化硼结构类似,具有六方层状结构,层内由共价键结合,层与层之间由范德华力结合,是一种典型的半导体材料。MoS2分子层之间的间距为0.62 nm,自由为间距0.30 nm,其中每层由2层六方紧密堆积的硫原子与中间1层钼原子形成三明治结构[21-24]。MoS2因具有独特的物理化学性质、机械性质、光学性质、电学性质等,已在催化、电子学、生物医学、能源等领域得到了实际应用,预计在环境领域也会得到发展与应用。目前,已有关于MoS2用于含重金属离子废水处理方面的应用研究[25-26]。
采用流程简单、晶体性良好的熔盐电解法制备二硫化钼,对熔盐电解质温度、组分和电流密度进行调控,可以实现调控二硫化钼晶体结构和堆垛方式目的[27]。银基材料对碘有较好的吸附性能,因此,研究了采用沉淀法制备Ag3PO4和Ag3PO4@MoS2复合材料,采用XRD、FT-IR和SEM等对2种材料的结构和性质进行表征。并考察了Ag3PO4和Ag3PO4@MoS2对碘的吸附性能,进一步探讨二者吸附碘的机制和规律。
1 试验部分
1.1 主要试剂与仪器
LiCl、KCl、(NH4)6Mo7O24、KSCN,均为分析纯,购于上海三爱司化学试剂有限公司;AgNO3、Na2HPO4、KI,均为分析纯,购于上海阿拉丁生化科技股份有限公司。以上试剂均直接使用未进一步纯化。
主要仪器:电子分析天平(BS124S,北京赛多利斯仪器系统有限公司),SEM(Nova Nano 450,荷兰FEI公司),pH计(PB-10,上海精密科学仪器有限公司),紫外可见分光光度计(723PC,上海析普仪器有限公司),XRD(D8 ADVANCE,德国Bruker AXS公司),红外光谱仪(FTS-65A,美国Bio-RAD公司),Zeta电位仪(Stabino PMX 400,美国Microtrac公司)。
1.2 二硫化钼(MoS2)的制备
采用熔盐电解法制备二硫化钼。熔盐电解是一个将电能转化为化学能的过程。熔融态金属盐类作为电解质,通电之后,体系内部发生电化学反应,得到目的产物。
试验用熔盐体系为LiCl-KCl体系。将35 g LiCl和35 g KCl的混合物真空干燥除去过量水,置于坩埚中;将4 g(NH4)6Mo7O24和6 g KSCN混合粉末加入坩埚中;用钼丝(直径1 mm,纯度99.99%)作为工作电极,玻璃碳作为辅助电极,在2.0 A恒电流条件下进行电解,得到二硫化钼。
1.3 磷酸银(Ag3PO4)的制备
将3 g硝酸银固体加入水溶液中超声溶解。在50 ℃水浴中搅拌条件下,将配置好的磷酸氢二钠水溶液逐滴加入到硝酸银溶液中,滴加完成后遮光搅拌70 min,使混合均匀并充分反应。反应后的产物洗涤干燥,即得Ag3PO4。
1.4 Ag3PO4@MoS2复合材料的制备
去离子水中加入制备的二硫化钼0.1 g,超声30 min使分散均匀,得到二硫化钼水溶液;再将3 g硝酸银固体加入到二硫化钼水溶液中,超声使分散均匀;后续步骤与磷酸银制备相同。最后将反应产物洗涤干燥,即得Ag3PO4@MoS2复合材料。
1.5 吸附碘
因为放射性碘有毒,所以试验均采用无放射性的K127I溶液作为模拟吸附对象。利用单因素试验法考察材料对碘吸附的影响。精确称取0.010 g吸附材料于锥形瓶中,取50 mL用0.1 mol/L NH3·H2O和HNO3溶液调节pH和浓度的碘溶液转入锥形瓶中,于恒温振荡箱中振荡一段时间,之后取溶液进行离心,用紫外分光光度法测上清液中碘离子质量浓度,根据式(1)计算吸附量qe。
(1)
式中:ρ0—吸附前碘离子质量浓度,mg/L;ρe—吸附后碘离子质量浓度,mg/L;V—碘化钾溶液体积,L;m—Ag3PO4或Ag3PO4@MoS2质量,g。
1.6 产物表征
1.6.1 SEM-EDS分析
用扫描电镜(SEM)观察Ag3PO4、Ag3PO4@MoS2材料形貌及粒径大小,结果如图1、2所示。

图1 Ag3PO4的SEM和EDS照片

图2 Ag3PO4@MoS2的SEM和EDS照片
由图1看出,Ag3PO4颗粒呈不规则球状团聚在一起,颗粒大小不均匀,粒径在0.1~1.0 μm之间,Ag、P、O分布均匀。由图2看出,所合成材料中有球状和片状物质聚集在一起,Ag、P、O主要分布在球状物中,Mo、S元素主要分布在片状物质中。可以推断,片状物质是MoS2,球状物质是Ag3PO4,表明Ag3PO4@MoS2成功制备。
1.6.2 FTIR分析
Ag3PO4和Ag3PO4@MoS2的FT-IR分析结果如图3所示。可以看出:在4 000~500 cm-1范围内,2种物质均于3 400 cm-1和1 665 cm-1处附近出现吸附水中O—H伸缩振动峰;在1 360 cm-1处出现水分子中H—O—H弯曲振动峰;1 070、950、540 cm-1处的吸收峰为Ag3PO4的特征吸收峰,其中位于1 070 cm-1处的是P—O的伸缩振动峰,位于950 cm-1处的是[PO4]3-结构特征伸缩振动吸收峰,位于540 cm-1处的是O—P—O弯曲振动吸收峰[28]。未发现MoS2特征吸收峰的原因有两个:一是制备过程中掺杂的MoS2含量少;二是MoS2特征吸收峰与Ag3PO4特征吸收峰位置相近而被掩盖。

图3 Ag3PO4和Ag3PO4@MoS2的FT-IR分析结果
1.6.3 XRD分析
Ag3PO4和Ag3PO4@MoS2的XRD分析结果如图4所示。可以看出,Ag3PO4的衍射峰和体心立方相Ag3PO4衍射峰相吻合(PDF#06-0505),无任何杂质衍射峰出现,且衍射峰均较为尖锐。这表明所制备的Ag3PO4纯度高,晶化度高。Ag3PO4@MoS2的衍射峰与Ag3PO4基本一致,说明MoS2的掺杂未改变Ag3PO4结构。2θ在14°附近出现了1个强烈衍射峰,与MoS2标准卡片(PDF#37-1492)上(002)晶面衍射峰相吻合,表明Ag3PO4@MoS2具有良好的结晶度。
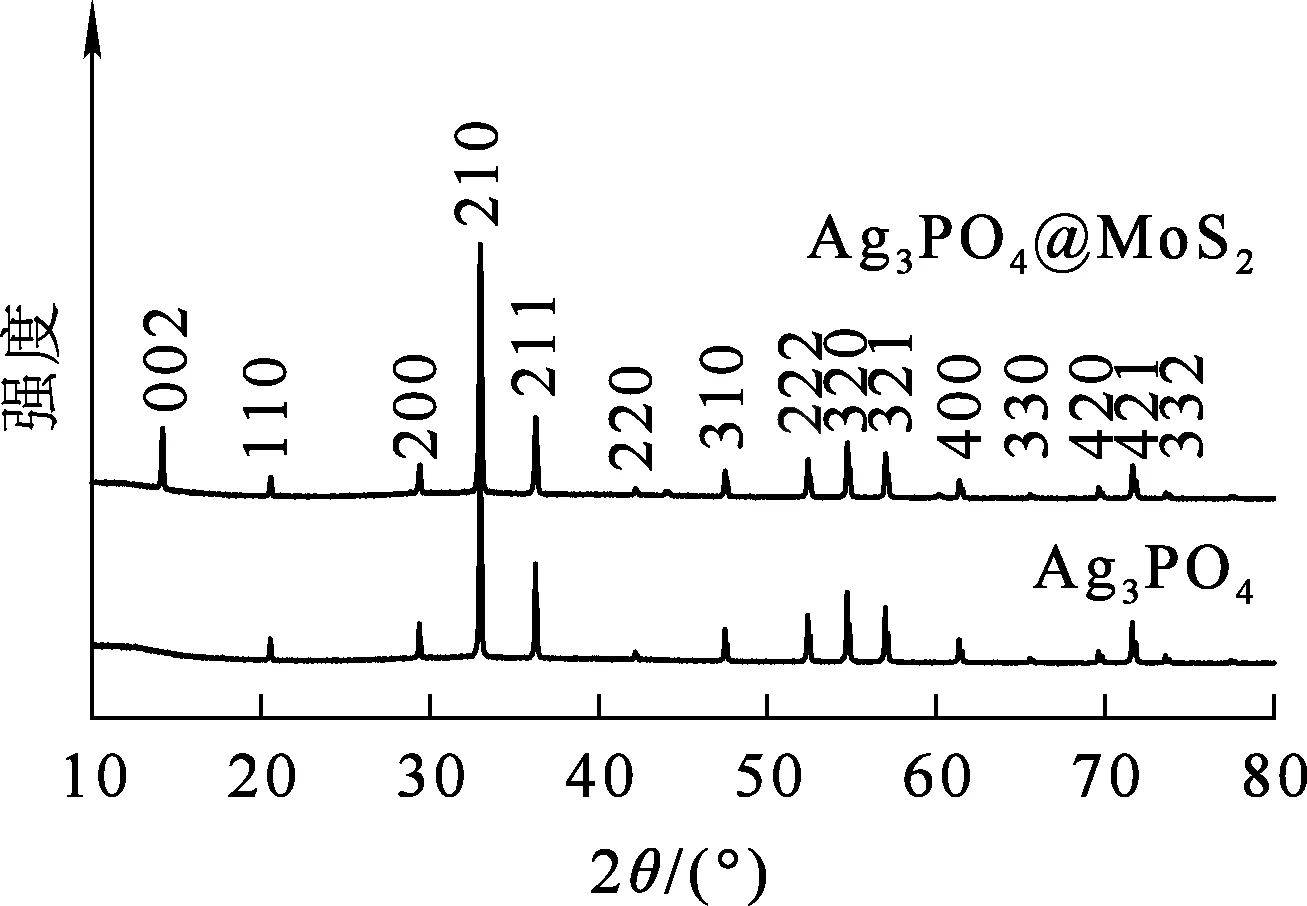
图4 Ag3PO4和Ag3PO4@MoS2的XRD分析结果
1.6.4 Zeta电位分析
Ag3PO4和Ag3PO4@MoS2的Zeta电位分析结果如图5所示。可以看出:pH由2.0升高至8.0,Ag3PO4的表面电位由7.4 mV降至-29.7 mV,等电位点pH为2.3;Ag3PO4@MoS2的表面电位也随pH升高而下降,Ag3PO4@MoS2的表面电位由-5.3 mV降至-37.1 mV。原因是,掺杂的MoS2表面电荷为负,导致Ag3PO4@MoS2表面电荷相比Ag3PO4表面电荷更负。

图5 Ag3PO4与Ag3PO4@MoS2的Zeta电位分析结果
2 碘离子测定
采用紫外分光光度法测定溶液中碘离子质量浓度。该法无需添加辅助试剂和显色剂,具有快速、准确、简单等优点[30]。
碘溶液的紫外吸收光谱如图6所示。以去离子水为空白进行对比。可以看出:I-在波长226 nm和194 nm处有特征吸收峰;随I-浓度增大,特征吸收峰峰强增大。由于紫外可见分光光度计在靠近190 nm处产生的紫外光不稳定,所以后续试验均选择226 nm作为I-测定波长。

图6 碘溶液的紫外吸收光谱
准确称取1.307 g固体碘化钾于烧杯中,加入去离子水,完全溶解后转移至1 000 mL容量瓶中,用去离子水定容,得到1 g/L碘储备液。用碘储备液配制0~2 mg/L范围内的一系列KI溶液,在波长226 nm处测定吸光度,根据朗伯比尔定律绘制碘离子标准曲线,结果如图7所示。可以看出:碘离子质量浓度在1.0~20 mg/L范围内,溶液吸光度与碘离子质量浓度之间的线性关系良好,拟合方程为
y=0.101 5x-0.001 38,
相关系数R2=0.999 32。
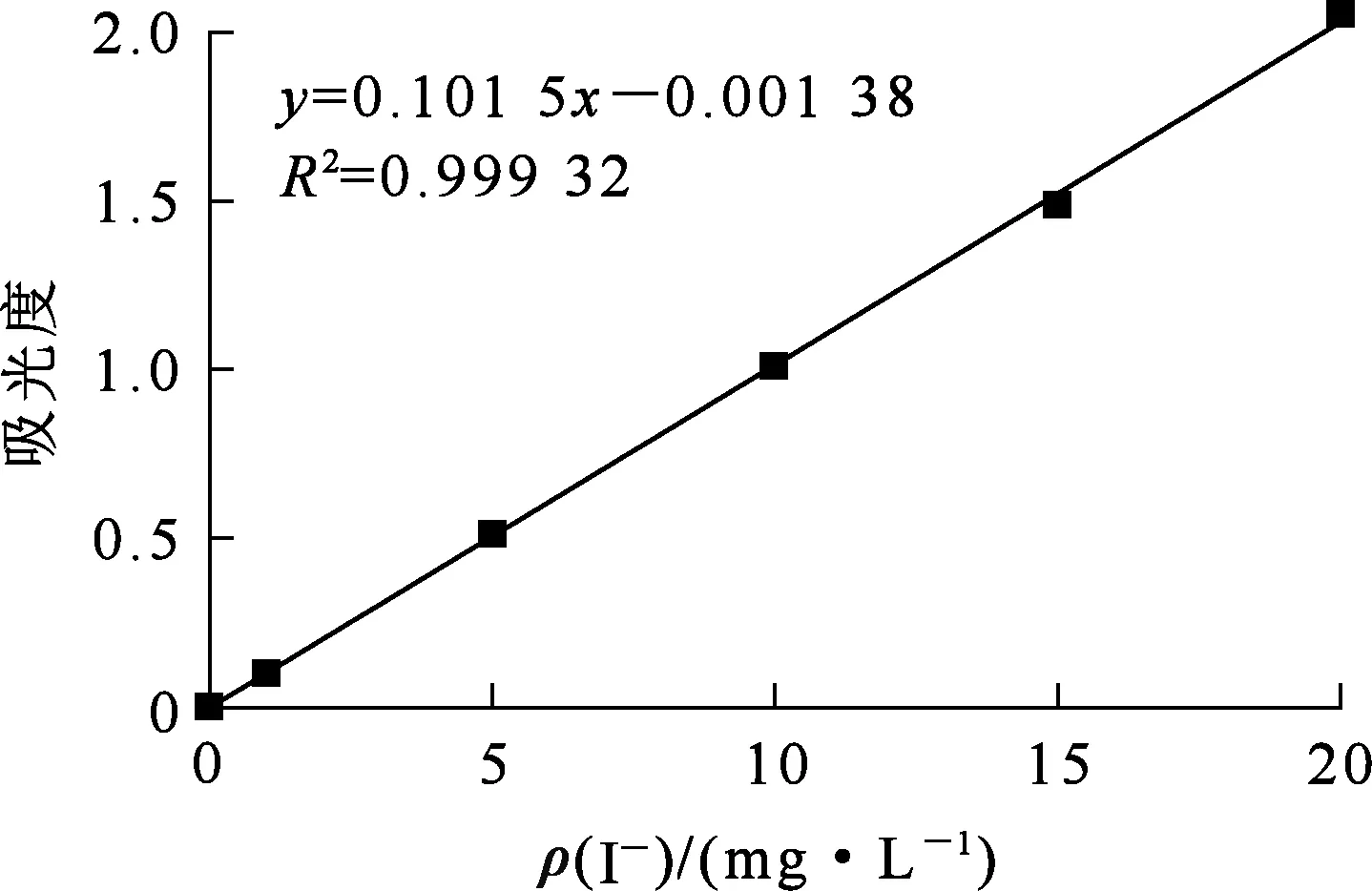
图7 I-的标准曲线
3 碘的吸附性能
3.1 溶液pH对吸附的影响
吸附剂质量0.01 g,溶液体积50 mL,碘离子质量浓度50 mg/L,吸附时间300 min。溶液初始pH对2种材料吸附碘的影响试验结果如图8所示。
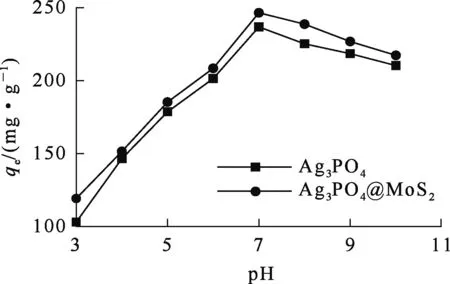
图8 溶液pH对Ag3PO4和Ag3PO4@MoS2吸附碘的影响
由图8看出:溶液pH在3~11范围内,Ag3PO4@MoS2对碘离子的吸附量都高于Ag3PO4的吸附量;酸性条件下,随pH增大,Ag3PO4和Ag3PO4@MoS2对碘离子的吸附量逐渐增大;pH=7.0时,Ag3PO4@MoS2对碘离子的吸附量为246.5 mg/g,Ag3PO4对碘离子的吸附量为236.8 mg/g。强酸性条件下,2种材料对碘离子的吸附量都不高,这是因为Ag3PO4易溶于酸,不利于AgI沉淀生成;随溶液pH提高,碱性条件下,溶液中OH-质量浓度逐渐增大,导致吸附剂外表面负电荷增加,与带负电荷的碘离子发生竞争吸附,导致吸附剂对碘离子的吸附量逐渐降低。
3.2 吸附动力学
吸附剂质量10 mg,溶液体积50 mL,碘离子质量浓度50 mg/L,溶液pH=7.0。接触时间对Ag3PO4和Ag3PO4@MoS2吸附碘的影响试验结果如图9所示。
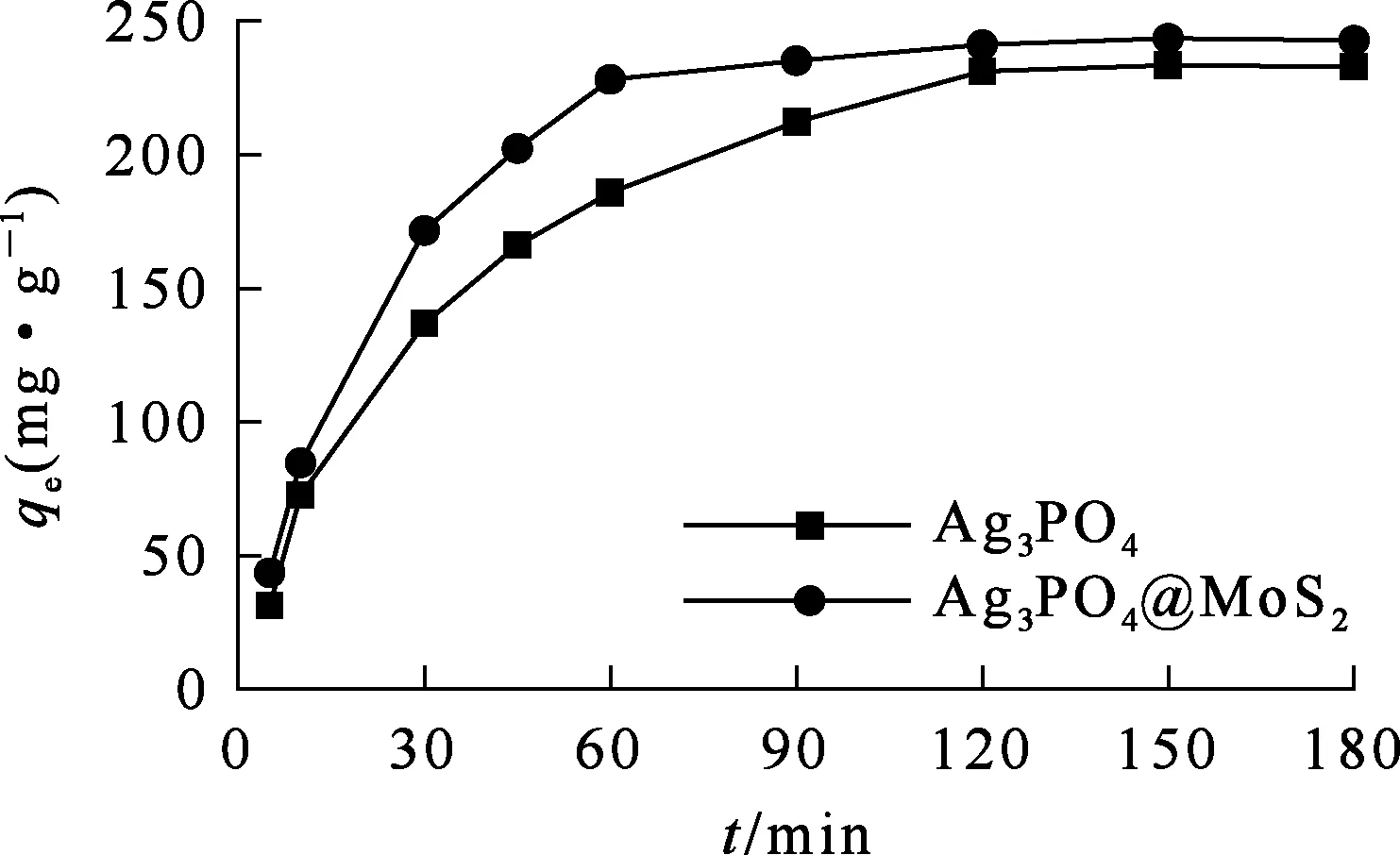
图9 接触时间对Ag3PO4和Ag3PO4@MoS2吸附碘的影响
由图9看出:接触时间在0~180 min范围内,Ag3PO4和Ag3PO4@MoS2对碘离子的吸附量逐渐增大,达到平衡所需时间分别为120、60 min。
采用准一级和准二级吸附动力学模型研究Ag3PO4和Ag3PO4@MoS2吸附碘离子的过程及吸附速率。模型的线性方程由公式(2)(3)计算所得。
ln(qe-qt)=lnqe-k1t;
(2)

(3)
式中:qt为吸附t时间时的碘离子吸附量,mg/g;k1为准一级吸附动力学模型的吸附速率常数,min-1;k2为准二级吸附动力学模型的吸附速率常数,g/(mg·min)。
根据图10(a)(b)中线性拟合曲线(ln(qe-qt)-t和t/qt-t)的斜率与截距计算动力学参数,所得结果见表1。
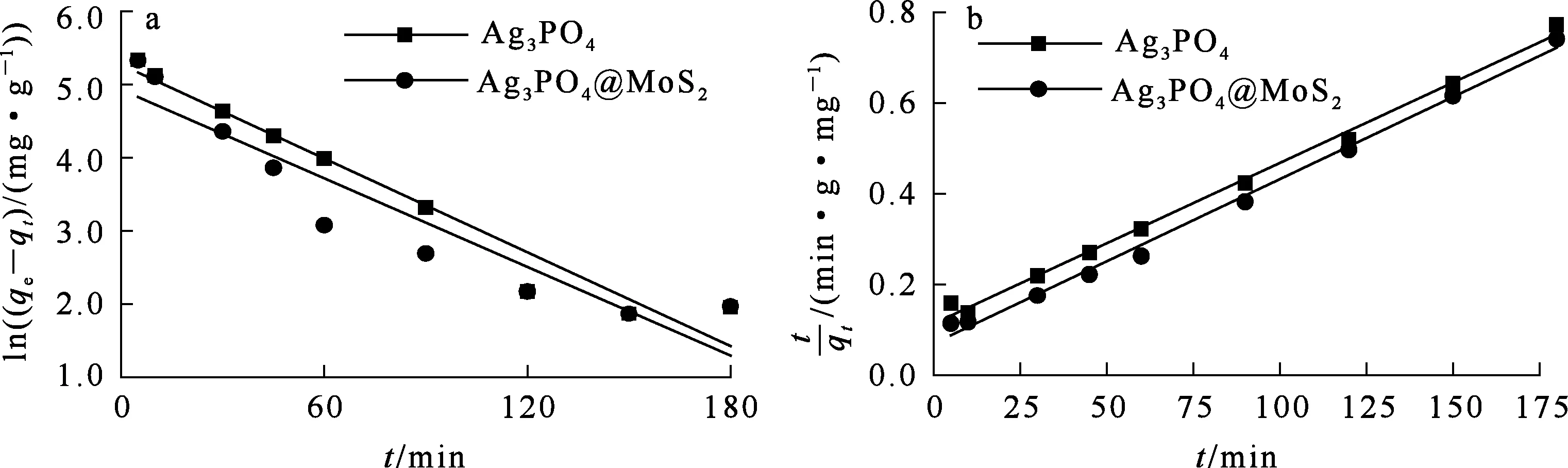
a—准一级动力学模型;b—准二级动力学模型。

吸附剂qe,exp/(mg·g-1)准一级动力学准二级动力学q1,cal/(mg·g-1)k1/min-1R21q2,cal/(mg·g-1)k2/(g·mg-1·min-1)R22Ag3PO4233.5194.92.1×10-20.950276.21.9×10-40.994Ag3PO4@MoS2243.5138.62.0×10-20.874282.51.1×10-40.995

3.3 吸附等温线
吸附剂质量10 mg,溶液体积50 mL,碘离子质量浓度50 mg/L,溶液pH=7.0,吸附时间120 min。碘离子初始质量浓度对Ag3PO4和Ag3PO4@MoS2吸附碘的影响试验结果如图11所示。可以看出:随碘离子初始质量浓度由10 mg/L升至170 mg/L,2种吸附剂对碘离子的吸附量均提高,并逐渐达到饱和,达到饱和时碘离子质量浓度均为150 mg/L。
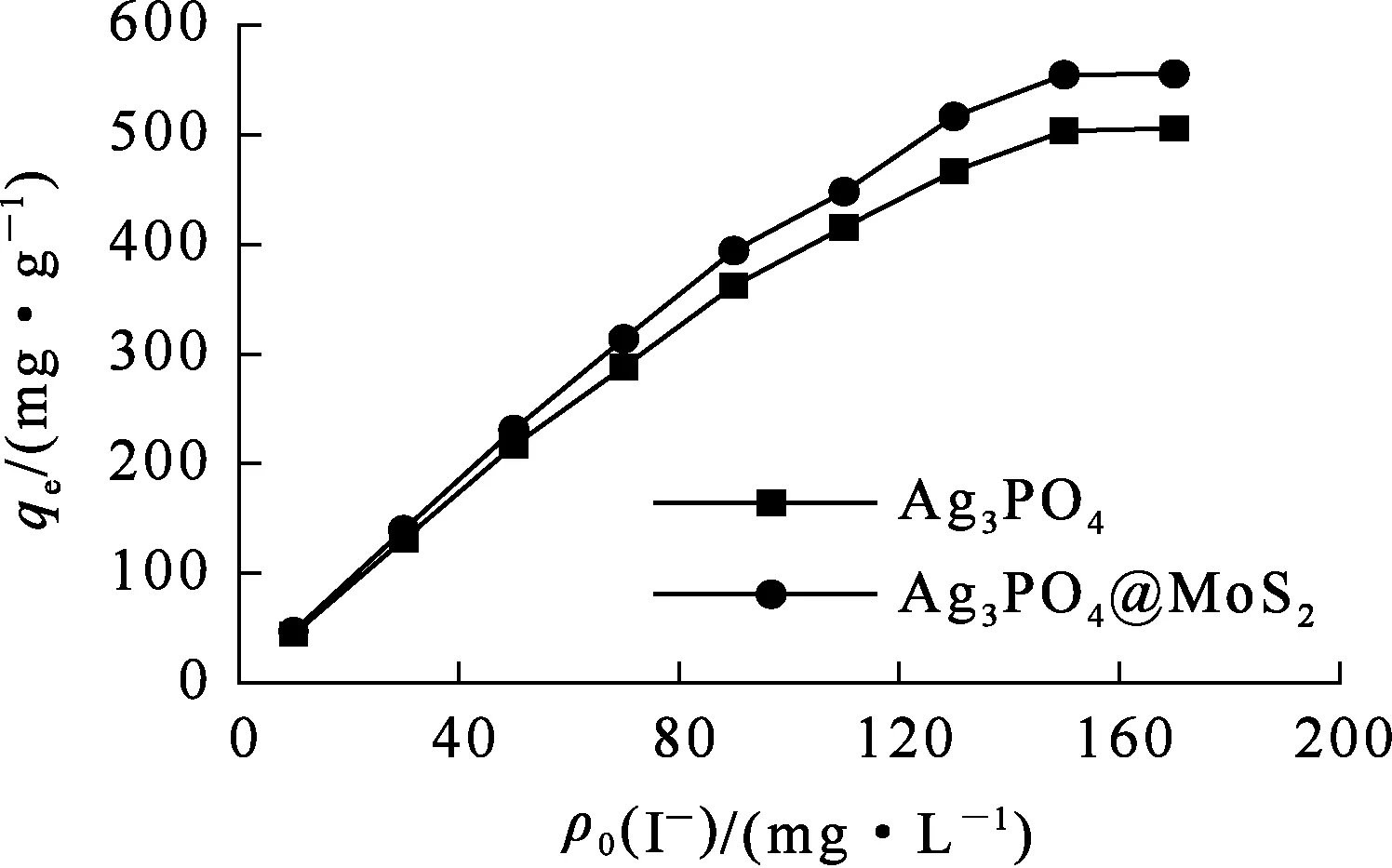
图11 碘离子初始质量浓度对Ag3PO4和Ag3PO4@MoS2吸附碘的影响
采用Langmuir和Freundlich模型进一步探讨2种吸附剂对碘的等温吸附行为。Langmuir吸附模型表达式为
(4)
式中:qm—单层饱和吸附容量,mg/g;kL—与吸附能量相关的参数,g/mg。
Freundlich吸附模型表达式为
(5)
式中:1/n—分均质系数;kF—Freundlich常数,(mg·g-1)/(mg·L-1)1/n。
将吸附平衡数据代入式(4)(5),分别对Langmuir和Freundlich等温吸附模型进行线性拟合,结果如图12(a)(b)所示。根据拟合曲线的截距和斜率求得qm、kL、n和kF,其结果与拟合线性相关系数见表2。
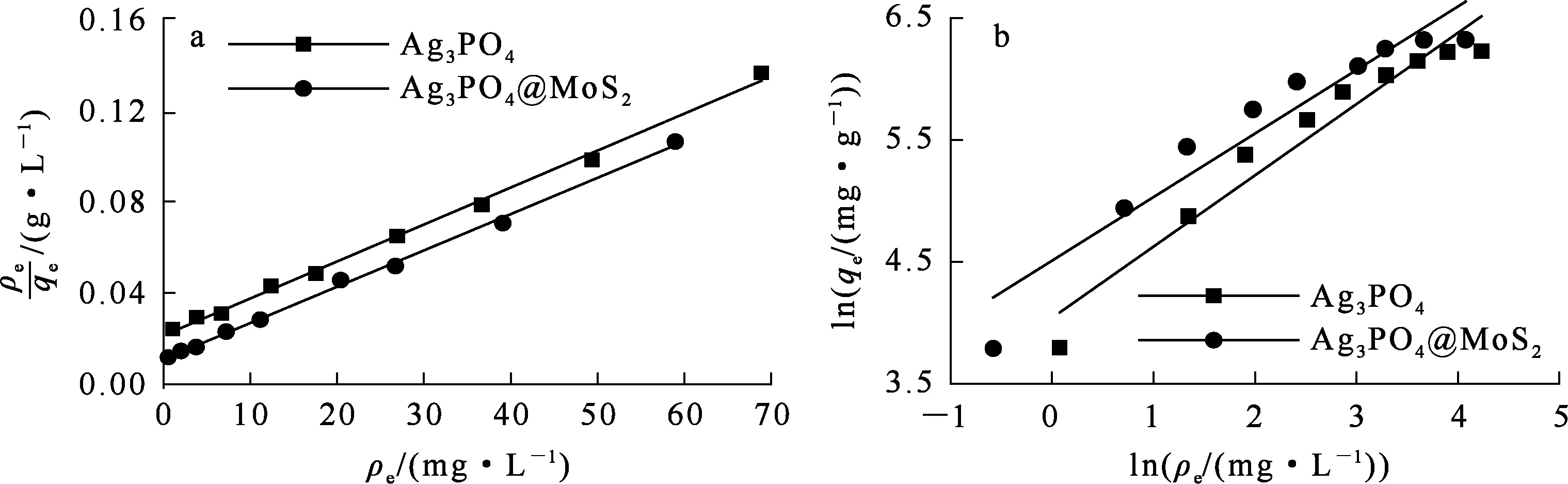
a—Langmuir吸附模型;b—Freundlich吸附模型。

吸附剂Langmuir模型Freundlich模型kL/(g·mg-1)qm/(mg·g-1)R21kF/(mg1-1/n·L1/n·g-1)nR22Ag3PO40.07617.280.99656.901.710.936Ag3PO4@MoS20.14628.930.99790.951.920.918

3.4 吸附热力学
吸附剂质量10 mg,溶液体积50 mL,碘离子质量浓度50 mg/L,溶液pH=7.0,吸附时间120 min。溶液温度由15 ℃升至35 ℃,Ag3PO4和Ag3PO4@MoS2对碘的吸附试验结果如图13所示。可以看出:随溶液温度升高,Ag3PO4和Ag3PO4@MoS2对碘离子的吸附量变化均不大,分别由230.2、241.3 mg/g提高至239.3、248.1 mg/g,表明这2种材料对碘离子的吸附过程均吸热。
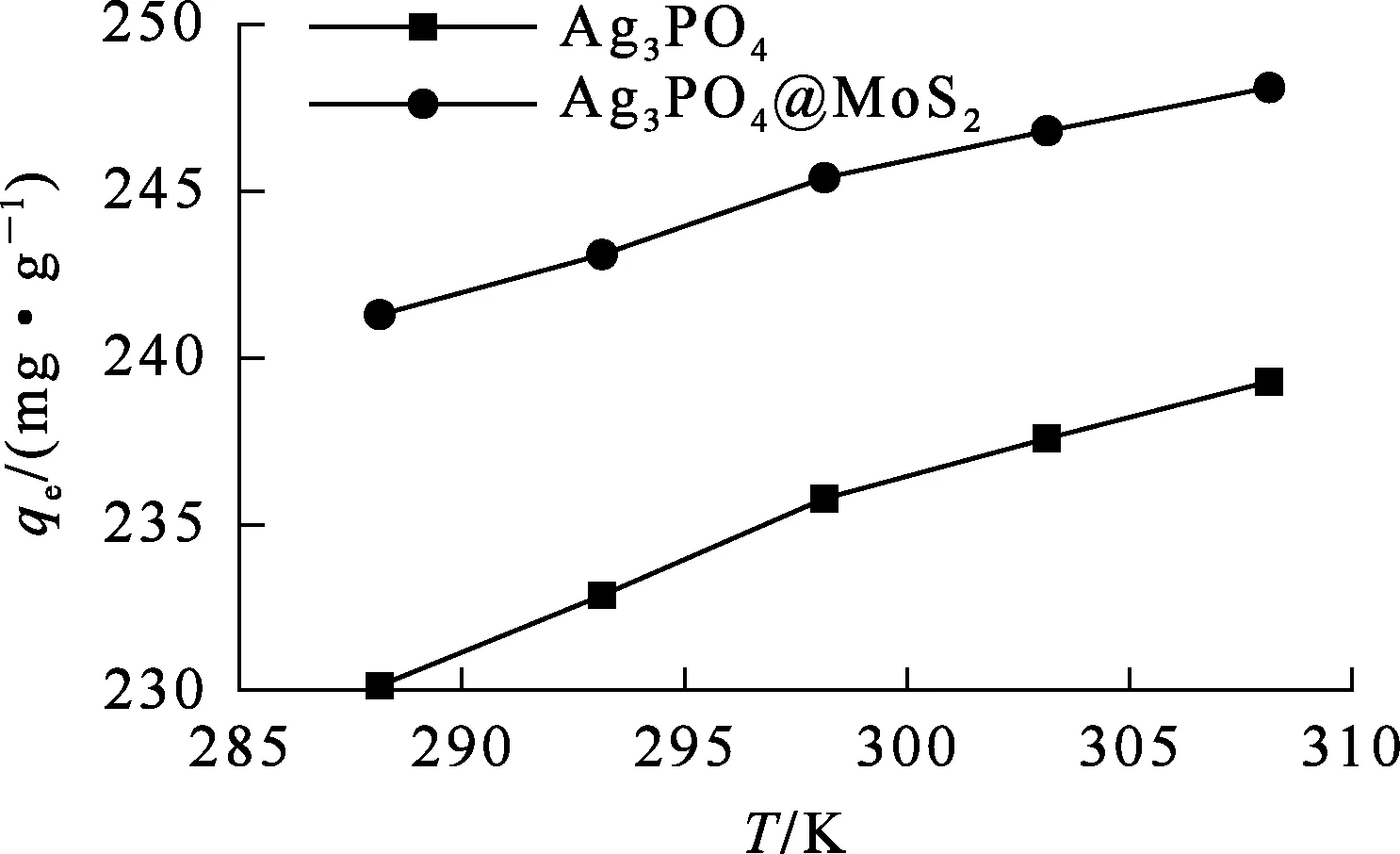
图13 温度对Ag3PO4和Ag3PO4@MoS2吸附碘的影响
吉布斯自由能变(ΔG,kJ/mol)、焓变(ΔH,kJ/mol)和熵变(ΔS,J/(K·mol))等热力学参数及分配系数kd(mL/g)之间的关系如下:
(6)
(7)
式中:R—气体摩尔常数,8.314 J/(k·mol);T—热力学温度,K。
吸附剂质量10 mg,溶液体积50 mL,碘离子质量浓度50 mg/L,溶液pH=7.0,吸附时间120 min。以1/T为横坐标,lnkd为纵坐标绘制Ag3PO4和Ag3PO4@MoS2吸附碘的热力学曲线,如图14所示。由拟合曲线的斜率和截距分别得到ΔH、ΔS,不同温度下的ΔG根据式(8)求得。
ΔG=ΔH-TΔS。
(8)
不同温度下,Ag3PO4和Ag3PO4@MoS2吸附碘的热力学参数见表3。可以看出:ΔH>0,ΔG<0,表明Ag3PO4和Ag3PO4@MoS2吸附碘离子的过程自发吸热;ΔS>0,表明2种吸附剂对碘离子的吸附均为表面混乱度增加过程;2种吸附剂对碘离子吸附过程的ΔG绝对值均随温度升高而增大,表明升温有利于吸附过程进行;此外,相同温度下,Ag3PO4吸附反应ΔG的绝对值小于Ag3PO4@MoS2吸附反应ΔG绝对值,表明Ag3PO4@MoS2对碘离子有更强的吸附性能。
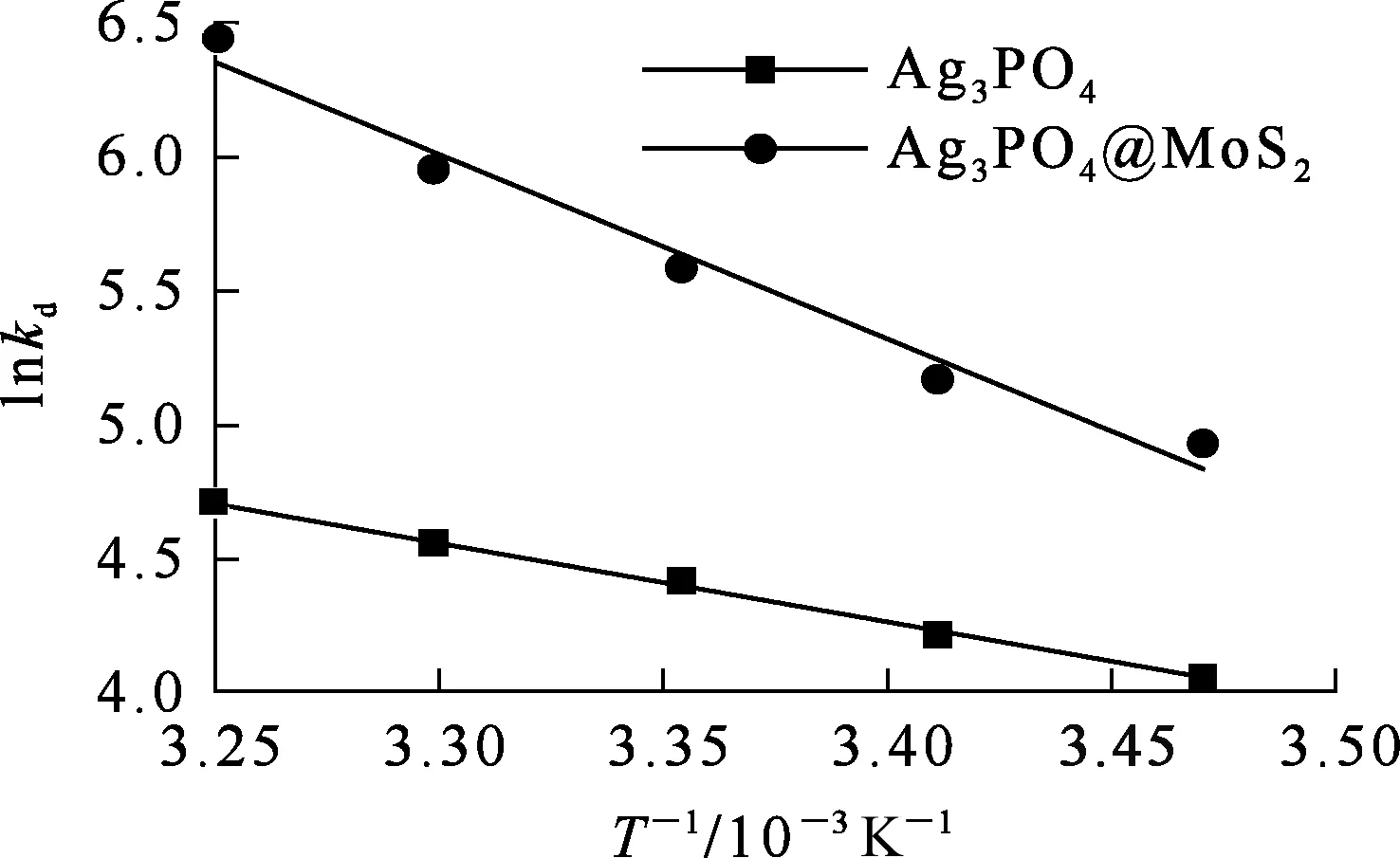
图14 Ag3PO4和Ag3PO4@MoS2吸附碘的热力学曲线
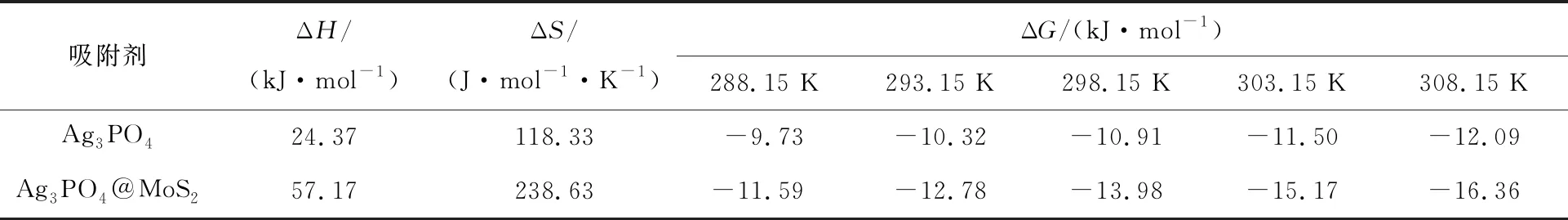
表3 Ag3PO4和Ag3PO4@MoS2吸附碘的热力学参数
4 结论
采用熔盐电解法制备二硫化钼,然后用其与磷酸银复合制备磷酸银/二硫化钼(Ag3PO4@MoS2)吸附剂是可行的,所制备的吸附剂可用于从水溶液中吸附碘离子。Ag3PO4和Ag3PO4@MoS2对碘离子的吸附过程均符合Langmuir模型,单分子层饱和吸附量为617.28 mg/g(Ag3PO4)和628.93 mg/g(Ag3PO4@MoS2),溶液最佳pH均为7.0,吸附达到平衡所需时间为120 min(Ag3PO4)和60 min(Ag3PO4@MoS2)。动力学研究结果表明,2种吸附剂对碘离子的吸附过程均符合准二级动力学模型,吸附过程主要受化学作用控制。MoS2的加入使得Ag3PO4对碘离子的吸附反应平衡时间缩短,吸附量提高,因为MoS2有较大比表面积,能够为银离子的附着提供更多活性位点,增大银离子与碘离子反应概率;Ag3PO4和Ag3PO4@MoS2对碘离子的吸附均为自发吸热过程。研究结果表明,Ag3PO4@MoS2对于从溶液中去除碘离子有较高研究价值。

