牙周炎大鼠正畸性牙根吸收中RANKL、TNF-α在牙周膜压力侧的表达
杨伟红 黄生高 于乐蓉
牙根吸收是正畸治疗常见并发症之一,其生物学机制与骨吸收类似,是一种多细胞/多因子共同参与、协调作用的复杂过程[1]。破牙骨质细胞在形态和功能上类似于破骨细胞,在牙根吸收中发挥破牙骨质作用,溶解无机矿物质、降解细胞外有机基质[2]。核因子κB受体活化因子配体(receptor activator of nuclear factor-κB ligand,RANKL)和肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)是促进破骨细胞和破牙骨质细胞分化和激活的重要因子,RANKL与破牙骨质细胞前体表面的特异性受体RANK结合进行信号转导,诱导破牙骨质细胞的形成和分化[3];TNF-α可直接或间接地促进破牙骨质细胞分化和增殖[4]。
牙周炎是一种渐进性感染性的炎性疾病,可导致牙槽骨吸收和牙周附着丧失。在细菌或细菌产物刺激下牙周韧带成纤维细胞表达的RANKL和TNF-α增加[5],与成纤维细胞在机械力作用下的反应类似[6]。实验观察伴或不伴有牙周炎大鼠正畸牙的压力侧牙根吸收情况、破牙骨质细胞数目以及RANKL和TNF-α的表达,探究牙周炎对正畸性牙根吸收的影响。
1 材料与方法
1.1 实验试剂
兔抗RANKL抗体(23408-1-AP)、小鼠抗TNF-α抗体(60291-1-Ig,武汉三鹰生物技术有限公司);TRAP试剂盒(自配);SP免疫组化试剂盒(PV9001)、DAB显色盒(ZLI-9018,北京中山金桥)。
1.2 实验动物及牙周炎模型建立
40只6周龄雄性健康SD大鼠,体质量(250±10)g,由中南大学实验动物学部提供。随机分为牙周炎组和对照组,每组20只。牙周炎组依据Nakamura-Kiyama等[7]的方法,使用3-0丝线结扎于大鼠左侧上颌第一磨牙牙颈部;对照组不作丝线结扎。正常饮食饲养4周后2组各处死5只作为加力0 d组。
1.3 大鼠正畸牙移动
将大鼠上颌切牙作为支抗,使用镍钛拉簧提供持续牵引力(0.49 N)近中移动上颌第一磨牙,建立牙周炎组和对照组正畸牙移动模型,加力3、7、14 d后2组各处死5只。
1.4 组织学标本制备
取上颌标本常规固定、脱钙、脱水、石蜡包埋,沿第一磨牙近远中方向连续切片,厚度为4μm。常规HE染色、按照试剂盒上的说明分别进行TRAP染色、RANKL和TNF-α免疫组化染色。
1.5 图像处理
每个标本取5张切片,Winceph 8.0软件测量上颌第一磨牙远颊根牙根吸收面积和牙根总面积,计算牙根吸收指数(牙根吸收指数=牙根吸收面积/牙根总面积)。TRAP和IHC染色的切片于远颊根压力侧牙根表面随机选取3个不重叠视野(×400)进行图像采集。TRAP阳性染色、胞核在2个或以上且位于牙根表面的细胞计数为多核破牙骨质细胞,其余为单核破牙骨质细胞。IHC切片采用Image Pro Plus图像分析软件测量RANKL、TNF-α平均光密度。
1.6 统计学分析
应用SPSS23.0软件统计,非参数检验法分析牙根吸收指数;计量资料以表示,均数比较采用单因素方差分析(ANOVA)和t检验,P<0.05有统计学意义。
2 结 果
2.1 牙周及牙根吸收情况
加力0 d时进行牙周检查,牙周炎组:牙龈红肿,探诊出血,探及牙周袋;对照组:牙周情况良好。X线片:与对照组相比,牙周炎组牙槽骨低平,釉质牙骨质界至牙槽嵴顶距离增加,根分叉暴露(图1)。
加力3 d时牙根表面罕见吸收迹象,7 d时可见大量牙根吸收陷窝,14 d时牙根吸收面积增加,未见有吸收陷窝修复的表现(图2)。加力7、14 d时牙周炎组牙根吸收指数显著大于对照组(P<0.05)(图3)。
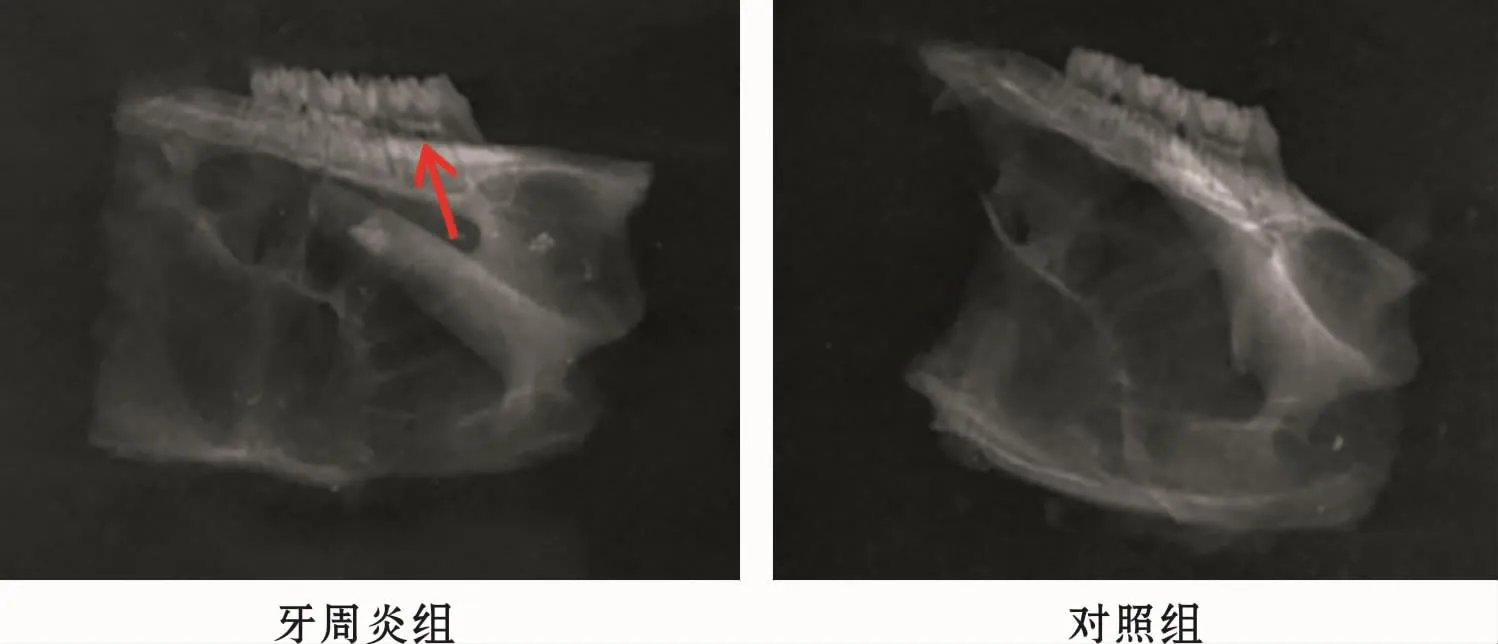
图1 加力0 d大鼠正畸牙X线片检查Fig 1 X-ray examination of orthodontic teeth in rats at day 0

图2 2组大鼠牙根吸收的变化 (×100)Fig 2 The changes of root absorption of the rats in the 2 groups (×100)

图3 加压后不同时间2组大鼠牙根吸收Fig 3 Rat root absorption of the 2 groups after loading
2.2 破牙骨质细胞数目变化
加力后破牙骨质细胞出现在压力侧牙根表面,主要分布于牙根吸收陷窝周围(图4)。单核破牙骨质细胞在加力3 d时最多,而多核破牙骨质细胞在加力7 d时最多,加力7 d时牙周炎组单核和多核破牙骨质细胞数目均高于对照组(P<0.05)(图5)。
2.3 RANKL、TNF-α的表达
RANKL在加力7 d时呈强阳性表达(图6),加力3、7、14 d时牙周炎组明显高于对照组(P<0.05)。TNF-α在加力7 d时阳性表达最强(图7),加力3、7、14 d时牙周炎组显著高于对照组(P<0.05)(表1)。

图4 TRAP染色(×400)Fig 4 TRAP stained (×400)

图5 加力后不同时间2组大鼠破牙骨质细胞数目Fig 5 Rat odontoclasts number of the groups after loading
表1 不同时间牙周炎组和对照组压力侧RANKL和TNF-α平均吸光度值 (,n=5)Tab 1 A value of RANKL and TNF-αexpression at the compressive side of the groups after loading(,n=5)
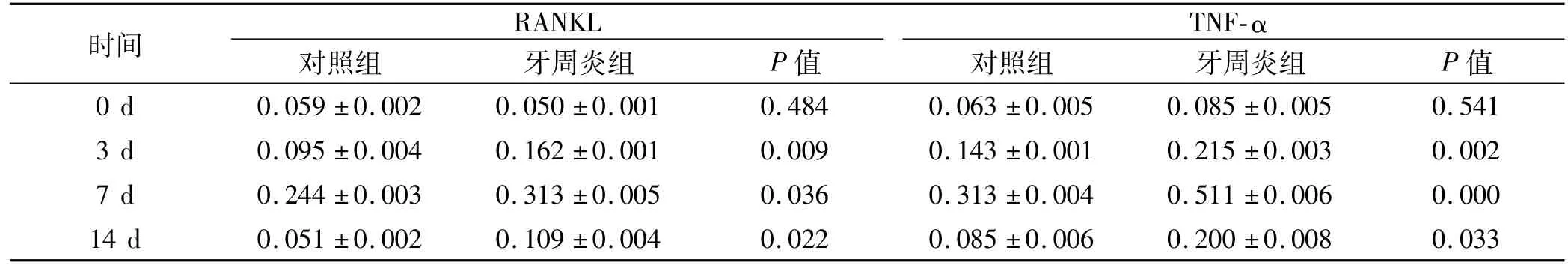
表1 不同时间牙周炎组和对照组压力侧RANKL和TNF-α平均吸光度值 (,n=5)Tab 1 A value of RANKL and TNF-αexpression at the compressive side of the groups after loading(,n=5)
时间RANKL TNF-α对照组 牙周炎组 P值 对照组 牙周炎组 P值5 0.085±0.005 0.541 3 d 0.095±0.004 0.162±0.001 0.009 0.143±0.001 0.215±0.003 0.002 7 d 0.244±0.003 0.313±0.005 0.036 0.313±0.004 0.511±0.006 0.000 14 d 0.051±0.002 0.109±0.004 0.022 0.085±0.0 0 d 0.059±0.002 0.050±0.001 0.484 0.063±0.00 06 0.200±0.008 0.033

图6 2组大鼠牙周带中RANKL的表达 (×400)Fig 6 RANKL expression in periodontal ligament of rats of the 2 groups (×400)

图7 2组大鼠牙周带中TNF-α的表达 (×400)Fig 7 TNF-αexpression in periodontal ligament of rats of the 2 groups (×400)
3 讨 论
正畸力作用下牙齿张力侧新骨形成、压力侧发生骨吸收,从而产生牙移动。牙根吸收是正畸治疗过程中一种不希望出现的情况,在压力侧牙根附近透明样变清除过程中,覆盖在牙根表面的成牙骨质细胞层被破坏,从而使下方高度矿化的牙骨质暴露[8]。除单核巨噬细胞外,无皱褶缘的多核TRAP阳性巨细胞也参与透明样变的清除,这可能是早期尚未成熟的前破骨/破牙骨质细胞,机械力刺激下它们很快分化为成熟的破骨/破牙骨质细胞[9],分别参与牙槽骨和牙根吸收过程。TRAP染色可用于标记分化后期的单核破牙骨质细胞和成熟多核破牙骨质细胞,能反应牙根吸收的状态。
骨吸收和钙代谢主要通过RANK-RANKL-OPG轴进行调控,在正畸牙移动过程中该系统不仅调节牙槽骨的吸收改建,还对正畸性牙根吸收有重要的调控作用。Yamaguchi等[10]发现,发生严重牙根吸收的正畸牙压力侧牙周膜中RANKL表达上调;Low等[11]报道了在正畸力作用下发生牙根吸收的组织中检测到RANKL的mRNA。本实验中也观察到RANKL在牙根吸收陷窝附近的组织中高表达。
TNF-α是一种超强炎性介质,能够激活单核巨噬细胞系统,诱导破骨细胞分化和增殖。TNF-α主要通过与TNF-R1作用发挥生物活性,Zhang等[12]发现敲除TNF-α的受体TNFR1可显著抑制RANK表达,减少破骨细胞分化,从而间接影响破骨细胞形成。此外,TNF-α还可以直接刺激破骨细胞形成,在Kudo等[13]的研究中,TNF-α直接作用于前破骨细胞,诱导成熟多核破骨细胞形成,此过程不被骨保护素(OPG)抑制。由于破牙骨质细胞和破骨细胞都来源于造血细胞,二者形态功能相似,结合本实验结果可推知,TNF-α可能诱导破牙骨质细胞的形成。
牙周炎是口腔两大类主要疾病之一,牙槽骨破坏是其最主要的诊断特征。牙周炎的病理改变不仅与牙周致病微生物及其毒性产物侵入有关 ,还与机体防御应答所产生的一系列因子有关 ,如TNF-α[14]。TNF-α作为细胞因子网络中的关键成员,具有广泛的生物学作用:作为始动因子启动炎症反应;增加破骨细胞的形成和活性,促进骨吸收;增加基质金属蛋白酶(MMPs)的产生,导致胶原纤维破坏;刺激基质细胞凋亡,限制牙周组织修复等[15]。牙周炎中细菌产生的LPS使成骨细胞RANKL表达增强,活化的T细胞也可分泌大量RANKL[16]。Boas等[17]发现正畸力作用下牙周炎大鼠的牙周组织中TNF-α表达增加,Romer等[18]的体外实验证实牙周病原体和正畸力的协同作用可刺激牙周韧带细胞表达的RANKL上调。本实验中也观察到RANKL和TNF-α在牙周炎组的表达高于对照组。不仅如此,牙周炎组的单核和多核破牙骨质细胞数目加力7天时明显多于对照组,牙根吸收也更为严重,这可能是由于牙周炎使RANKL、TNF-α表达增加,而这些细胞因子进一步促进了破牙骨质细胞的形成和活化,从而加重了牙根吸收这一正畸副反应。
通过本实验,并结合其他学者的相关研究,提示控制牙周炎症有利于减少正畸性牙根吸收等不良反应的发生。

