基于ChinaPca全基因组数据和基因表达量探讨LRP1对前列腺癌发病的影响
熊瀚 林睿 唐韦竹 蒙清贵 张庆云 陈阳 程继文
作者单位:530021 南宁 1广西医科大学附属肿瘤医院泌尿外科;2广西医科大学研究生院;3广西医科大学基因组与个体化医学研究中心;4广西医科大学第一附属医院泌尿外科
前列腺癌(prostate cancer,Pca)是男性泌尿系统常见的恶性肿瘤,发病率在男性恶性肿瘤中居第1位,死亡率居第5位[1]。我国前列腺癌发病率较低,但呈逐年上升趋势,目前发病率位居男性泌尿生殖系统恶性肿瘤第1位[2]。前列腺癌发病的危险因素有年龄、种族和遗传等[3]。前列腺癌发病风险亦与SNP有关,迄今通过全基因组关联分析(genomewide association study,GWAS)发现与前列腺癌发病相关的SNP数量达170余个,其中多数为欧美人群的研究结果[4]。中国人群的GWAS研究发现rs817826位点和rs103294位点与前列腺癌发病有关[5]。
低密度脂蛋白受体相关蛋白-1(low density lipoprotein receptor-related protein-1,LRP1) 有内吞细胞外蛋白酶和信号传递作用,参与脂蛋白代谢、细胞代谢和运动等多种生物过程[6]。研究发现LRP1可通过诱导基质金属蛋白酶-2(matrix metallopeptidase 2,MMP2)和MMP9表达,促进癌细胞迁移和侵袭[7]。前列腺癌组织中亦发现LRP1基因突变重排[8]。本课题组前期研究[9]发现LRP1基因在前列腺癌组织中突变率为23.1%。本研究进一步从LRP1基因的SNP及其表达量探讨LRP1基因对前列腺癌发生的影响。
1 材料与方法
1.1 LRP1基因SNP信息
本研究共纳入9个与LRP1基因有关的SNP,包括本研究前期在26例前列腺癌患者全外显子基因测序中的致病SNP 2个[9],以及在GWAS Catlog网站(https://www.ebi.ac.uk/gwas/)搜集LRP1基因在不同关联研究中差异有统计学意义的SNP 7个(P<5×10-8)。SNP基本信息见表1。
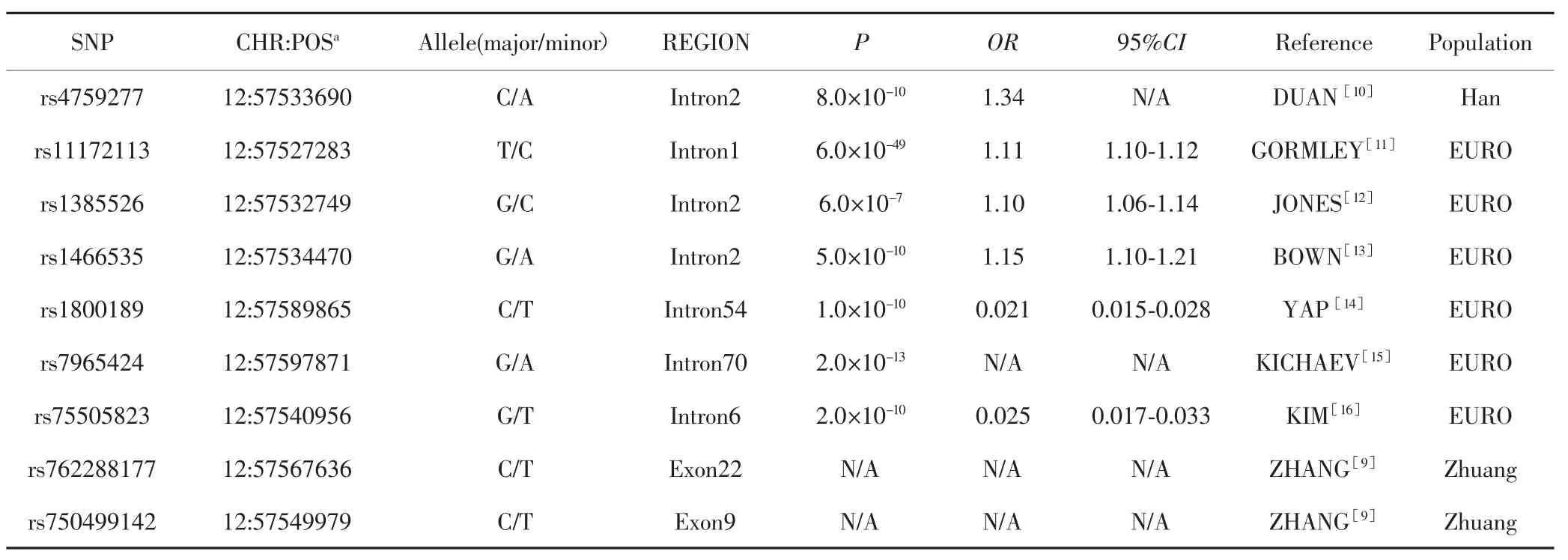
表1 LRP1基因SNP的基本信息Tab.1 Basic information of LRP1 gene SNP
1.2 SNPs的选择
中国前列腺癌遗传学协会(Chinese consortium for prostate cancer genetics,ChinaPca)对来自中国东部和南部9所医院或大学的前列腺癌患者进行全基因组关联研究。病例组为确诊的前列腺癌患者;对照组为未患前列腺癌且前列腺特异性抗原(PSA)<4 ng/mL,直肠指检阴性,一级亲属未患前列腺癌的社区人群。两组研究对象均抽取静脉血液进行DNA样本测序。采用IlluminaHumanOmniExpress微珠芯片对病例组1497例患者和对照组1 008名志愿者的731 458个SNP进行基因分型。采用标准的质量控制程序选择样本并分析SNPs:若样本总体基因分型百分比<95%,性别不明,重复样本或样本间有家族关系,则排除该样本;若SNP检出率<95%,最小等位基因频率(MAF)<0.05或对照组间的哈迪-温伯格平衡试验P<0.001,则排除该SNP。经质量控制分析,病例组纳入1417例,对照组1 008名,共587 292个SNP。ChinaPca数据的详细描述见文献[5],本研究数据来自上述质量控制后的测序数据。
1.3 免疫组化法检测LRP1在Pca组织中的表达
1.3.1 标本来源 收集广西医科大学第一附属医院2015年至2016年腹腔镜下前列腺癌根治术后有完整临床病理资料的12例前列腺癌组织标本(前列腺癌组),癌旁正常组织(距离癌组织≥3 cm)18例(癌旁正常组),以及在B超引导下经直肠或会阴前列腺穿刺术的前列腺炎组织4例(前列腺炎组)。癌旁正常组患者平均年龄64.4岁(46~78岁),前列腺癌组64.9岁(46~78岁),前列腺炎组68岁(49~80岁)。本研究经广西医科大学第一附属医院伦理委员会批准(审批号:20160304-12),患者签署知情同意书。
1.3.2 免疫组化检测 前列腺组织经10%中性福尔马林固定,常规脱水、石蜡包埋,4 μm厚切片,分别滴加一抗兔抗人单克隆抗体LRP1(购自英国abcam公司)和DAB显色剂进行 DAB染色,置于显微镜下观察。LRP1阳性着色部位主要位于细胞膜和细胞质,部分细胞核染色。计数被染色细胞,于200倍显微镜下观察免疫组化染色。染色阳性细胞数占0~10%,计0分;占 11%~25%,计 1分;占 26%~50%,计 2分;占51%及以上,计3分。染色强度评定:细胞完全无着色计0分,浅黄色计1分,黄色计2分,深棕黄色计3分。免疫组织化学结果总分为染色阳性细胞率计分和染色强度计分的乘积,其中总分≤1分为阴性(-),2~3分为弱阳性(+),3~6分为中等强度阳性(++),7~9分为强阳性(+++)。由2名病理医师镜下阅片,复核诊断及进行组织病理学分级。
1.4 基于TCGA、GTEx数据库分析LRP1在Pca组织中的表达
利用肿瘤基因组图谱(the cancer genome atlas,TCGA)(https://portal.gdc.c-ancer.gov/) 数 据 库 下 载LRP1基因在前列腺癌和癌旁正常组织中的表达数据。共搜集545例患者信息,其中癌组织493例,癌旁正常组织 52 例。在 GEPIA(http://gepia.cancer-pku.cn/)网站上对TCGA数据库和GTEx数据库的LRP1基因表达数据进行整合(包括492例前列腺癌组织和152例癌旁正常组织),于GEPIA网站对整合后的数据进行绘图[17]。
1.5 LRP1基因的网络互作分析
通过 String网站(https://string-db.org/)构建LRP1基因蛋白质相互作用网络(protein-protein interaction network,PPI),分析其与LRP1的关联且在KEGG通路中显示参与前列腺癌通路的相关基因[18],并对相关基因进行统计分析。
1.6 统计学方法
采用STATA 15.1和SPSS 22.0软件进行数据分析。Logistic回归计算OR值和95%CI来估算SNP与前列腺癌发病的关联;采用χ2检验分析不同组织的染色表达差异;两组计量资料比较采用独立样本t检验,多组间采用单因素方差分析;网络互作分析在GEPIA网站中进行,采用Pearson检验进行相关性分析[17]。以P<0.05为差异有统计学意义。
2 结果
2.1 LRP1基因SNP与Pca遗传易感性的关系
共验证9个候选SNP,其中外显子测序的2个SNP未在ChinaPca数据库中提取到数据;GWAS Catlog的7个SNP在ChinaPca数据中均提取到相关基因型数据,对这7个SNP进行分析,结果显示rs11172113可能与前列腺癌发病有关(P=0.083),rs11172113杂合子TC基因型是Pca发病的危险因素(OR=1.267,95%CI:1.066~1.505,P=0.007),见表 2。

表2 rs11172113在ChinaPca GWAS数据中的验证结果Tab.2 rs11172113 in ChinaPca GWAS data validation results
2.2 免疫组化检测结果
免疫组化检测结果显示,前列腺癌癌组织与癌旁正常组织中LRP1的阳性表达率差异无统计学意义(P=0.167);前列腺炎与癌旁正常组织的LRP1阳性表达率差异亦无统计学意义(P>0.999)。见表3。镜下可见LRP1在癌旁正常组织中的染色程度较深,而在癌组织及前列腺炎组织染色程度较浅,见图1。
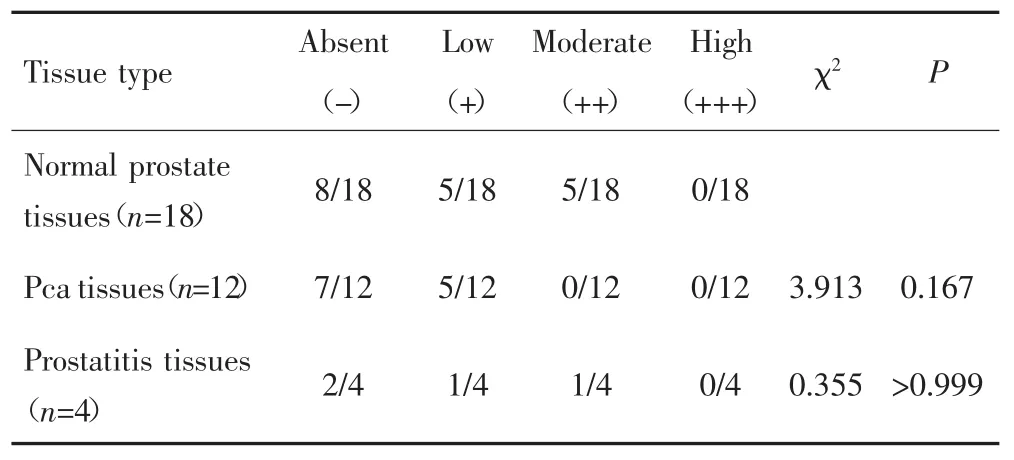
表3 免疫组化检测LRP1在不同前列腺组织中的表达Tab.3 Immunohistochemical analysis of LRP1 expression in different prostate tissues

图1 免疫组化检测LRP1在不同前列腺组织中的表达(DAB染色×200)Fig.1 Expression of LRP1 in different prostate tissues was detected by immunohistochemistry(DAB×200)
2.3 TCGA、GTEx数据库中LRP1基因的表达
在TCGA数据库中,LRP1在前列腺癌和癌旁组织中的表达量分别为12.105±0.904和12.150±0.786,差异无统计学意义(P=0.729),见图2A。进一步分析发现LRP1表达量与年龄、TNM分期、Gleason评分以及种族无关(P>0.05),见表4。在GEPIA网站上对TCGA和GETx数据库中LRP1基因表达量数据进行整合分析,结果显示LRP1在前列腺癌组织中的表达量低于癌旁正常组织(P<0.05),见图2B。
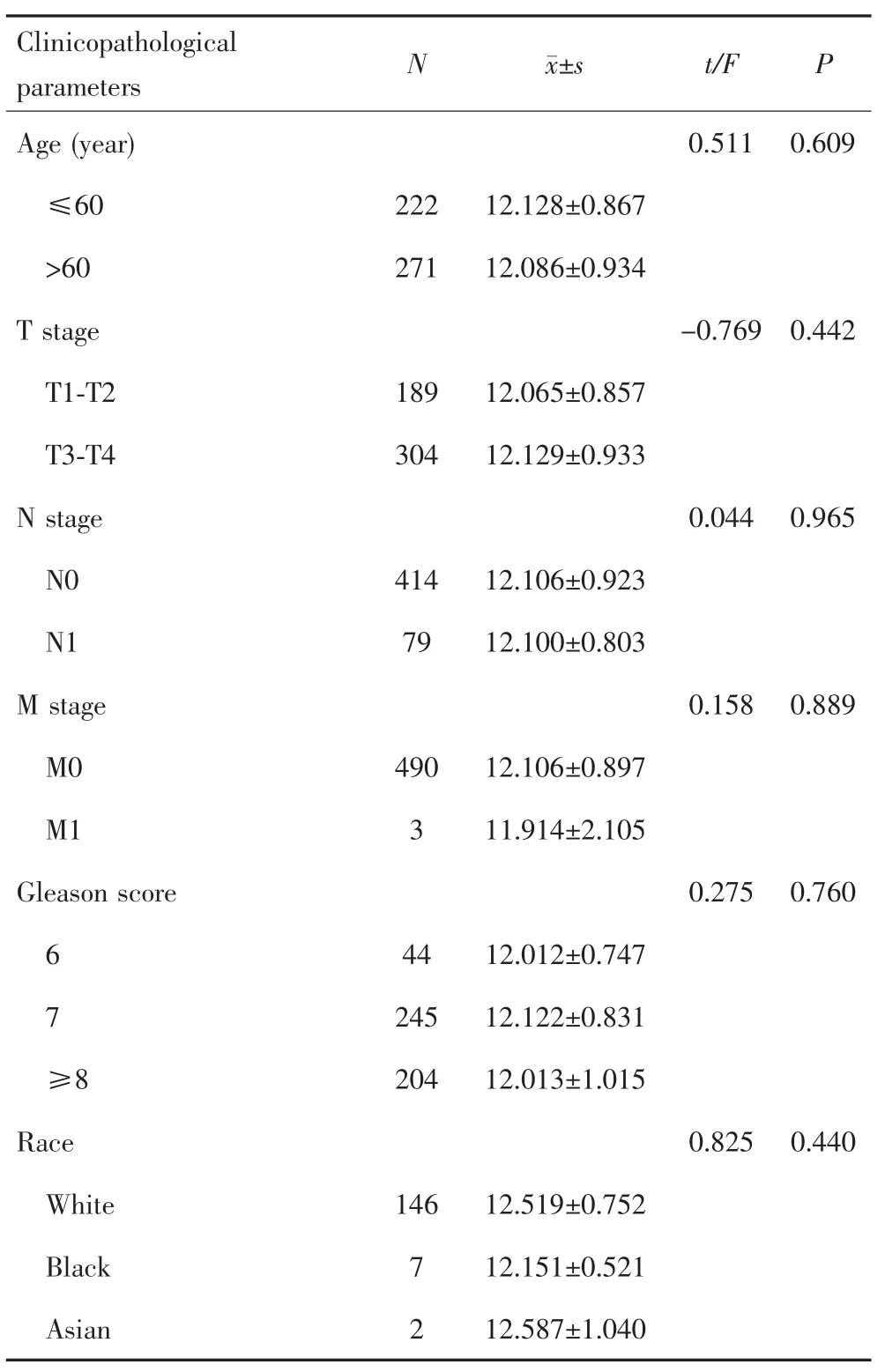
表4 基于TCGA数据库分析Pca组织LRP1表达与临床病理特征的关系Tab.4 Relationship between LRP1 level and clinical information in Pca based on TCGA database

图2 LRP1基因在Pca癌组织和癌旁正常组织中的表达Fig.2 Expression of LRP1 gene in Pca tissues and adjacent normal tissues
2.4 LRP1蛋白质相互作用网络分析结果
通过String网站构建LRP1基因PPI网络,发现3个基因与LRP1相互联系且在KEGG通路分析参与前列腺癌通路,分别为组织型纤溶酶原激活物(PLAT)、血小板衍生生长因子亚基B(PDGFB)和血小板衍生生长因子受体-β(PDGFRB),见图3。在GEPIA网站进行Pearson分析,结果显示PDGFB基因、PDGFRB基因和PLAT基因表达均与LRP1基因呈正相关(r=0.74,P<0.001;r=0.40,P<0.001;r=0.093,P=0.018)。3个基因在前列腺癌癌组织中的表达量均低于癌旁正常组织(P<0.05),见图 4。
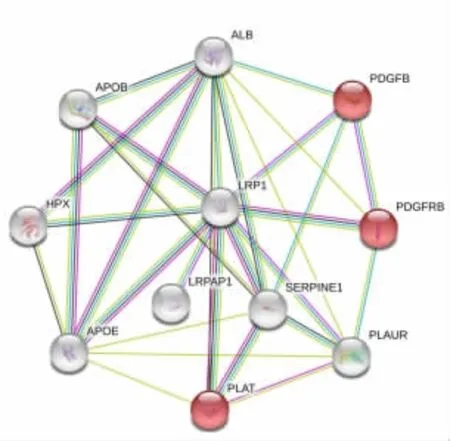
图3 基于String网站构建LRP1蛋白质相互作用网络Fig.3 Protein interaction network for LRP1 builted on the String website
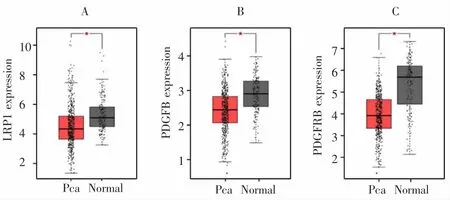
图4 基于TCGA和GTEx数据库分析PLAT、PDGFB、PDGFRB基因在Pca组织和癌旁正常组织中的表达Fig.4 Expression of PLAT,PDGFB and PDGFRB genes in Pca tissues and adjacent normal tissues based on TCGA and GTEx databases
3 讨论
前列腺癌的发病是一个复杂的过程,目前致病机制仍不清楚。LRP1有胞吞和传递信号的作用,对肿瘤微环境形成有重要作用[19]。本研究从LRP1单核苷酸多态性和LRP1基因表达量两方面探讨LRP1在前列腺癌发病中的作用。GWAS是在全基因组范围内找出存在的序列变异,即单核苷酸多态性(SNP),从中筛选出致病位点。ChinaPca GWAS数据库是目前我国最大的前列腺癌全基因组数据库,发表了多篇关于前列腺癌SNP研究文章[5,20]。本研究通过该数据库验证了7个LRP1基因的SNP,发现LRP1基因rs11172113的TC杂合子突变基因型是前列腺癌发病的危险因素,提示rs11172113位点可能是前列腺癌的遗传易感位点。
本研究免疫组化检测结果显示,LRP1在癌旁正常组织呈中等强度阳性,而在前列腺癌癌组织呈弱阳性,与国外研究结果一致[21],但LRP1在前列腺癌癌组织与癌旁正常组织中的表达未显示统计学差异性,可能与样本量较少有关。本研究还从TCGA数据库中搜集了LRP1基因的表达量数据进行统计分析,结果亦显示LRP1基因在前列腺癌癌组织和癌旁正常组织中的表达量差异无统计学意义。因TCGA数据库的前列腺正常组织例数较少,为排除其可能导致的统计学偏差,本研究在GEPIA网站中整合了TCGA和GTEx数据库数据进行分析,结果显示LRP1在前列腺正常组织中的表达量高于前列腺癌癌组织,与免疫组化结果一致,说明LRP1在前列腺癌癌组织中呈低表达,且可能参与前列腺癌的发生发展。
有研究发现LRP1可通过激活ERK通路和抑制JNK通路而促进癌细胞侵袭[22],ERK通路和JNK通路是参与前列腺癌发生发展的重要通路[23]。本研究在String网站上构建LRP1的蛋白质相互作用网络,发现LRP1与PLAT、PDGFB和PDGFRB相关,同时KEGG通路显示3个基因均参与前列腺癌相关通路,统计分析结果提示LRP1表达与3个基因呈正相关,且前列腺癌癌组织和癌旁组织中3个基因的表达量差异显著。
综上所述,LRP1基因的rs11172113位点可能是前列腺癌的遗传易感性位点。LRP1在前列腺癌癌组织中低表达,且可能通过调节PLAT、PDGFB和PDGFRB基因表达调控前列腺癌相关通路,从而导致前列腺癌发病。但本研究仅基于数据库分析,其具体作用机制还需开展基础实验和临床试验进一步研究。

