术前白蛋白与球蛋白比值对喉鳞状细胞癌患者预后的评估价值
庞振文 郭鹏 何东生 杨爱芳黄愉峰 曾先捷
作者单位:530021 南宁 广西医科大学附属肿瘤医院1头颈外科,2实验研究部
喉鳞状细胞癌(laryngeal squamous cell carcinoma,LSCC)是最常见的头颈部鳞状细胞癌,死亡率位居耳鼻喉肿瘤第3位[1-2]。LSCC具有浸润性强、颈部淋巴结易转移、预后差等特征[3]。以手术为主的综合治疗是LSCC的主要治疗模式,但5年生存率不理想[4]。因此,寻找敏感的预后评估指标具有重要意义。研究表明,术前白蛋白/球蛋白比值(albumin/globulin ratio,AGR)是肝癌、胃癌、直肠癌、尿路上皮癌、头颈部鳞癌等多种实体肿瘤的独立预后因素[5-9]。本研究分析喉鳞状细胞癌患者术前AGR水平及其与临床病理特征的关系,探讨术前AGR作为预后评价指标的价值。
1 资料与方法
1.1 研究对象
选取2008年1月至2017年12月在广西医科大学附属肿瘤医院头颈外科行喉癌手术治疗的患者为研究对象。纳入标准:⑴首次病理确诊的喉鳞状细胞癌患者;⑵术前未行化疗、放疗且无输血史;⑶实验室检查、影像学检查等临床资料齐全;⑷根据国家癌症综合网络指南,治疗方案包括标准喉切除术±颈清扫和术后放化疗。排除标准:⑴合并其他恶性肿瘤;⑵合并急性炎症疾病或可能影响血清生化水平的血液学疾病,严重心、肺、脑疾病者。本研究经广西医科大学附属肿瘤医院伦理委员会批准,患者知情同意。
1.2 资料收集及分组
收集患者的性别、年龄、吸烟史、饮酒史、肿瘤部位分型、肿瘤分期、术前白蛋白(ALB)和术前球蛋白(GLB)等临床资料,所有患者术前3~7 d检测术前ALB和GLB水平,AGR计算公式:AGR=ALB/GLB。以患者死亡为终点,通过X-Tile软件计算AGR的最佳截断值为1.31(χ2=18.640,P<0.001),根据最佳截断值将患者分为高 AGR 组(AGR>1.31,n=98)和低 AGR 组(AGR≤1.31,n=49)。
1.3 随访
随访时间为手术日至患者死亡或失访的时间,随访方式包括电话随访、门诊复查等。随访截至2018年2月,随访时间为6~121个月,失访6例,死亡54例。总生存期(overall survival,OS)定义为手术日至死亡或最后随访日期的时间。
1.4 统计学方法
采用SPSS 22.0软件进行数据分析。分类数据采用n(%)表示,组间比较用χ2检验;采用Kaplan-Meier法计算生存率,差异性分析行Log-rank检验;多因素Cox回归分析影响OS的因素。以P<0.05为差异有统计学意义。
2 结果
2.1 一般资料
共147例患者符合标准纳入本研究,其中男性141例,女性6例,年龄40~84岁,中位年龄59岁。根据TNM-UICC/AJCC分期第七版:Ⅰ期41例,Ⅱ期30例,Ⅲ期25例,Ⅳ期51例。肿瘤分化程度:高分化46例,中分化63例,低分化38例。肿瘤部位分型:声门上型26例,声门型115例,声门下型6例。颈部淋巴转移38例,其中单侧转移30例,双侧转移8例。见表1。患者术前血清 ALB 平均值为(39.66±3.86)g/L,GLB平均值为(26.80±4.12)g/L。
2.2 AGR与LSCC患者临床病理特征的关系
高AGR组和低AGR组患者肿瘤部位分型、T分期、N分期、临床分期等比较差异均有统计学意义(P<0.05),性别、年龄、吸烟、饮酒、分化程度等差异均无统计学意义(P>0.05)。见表 1。
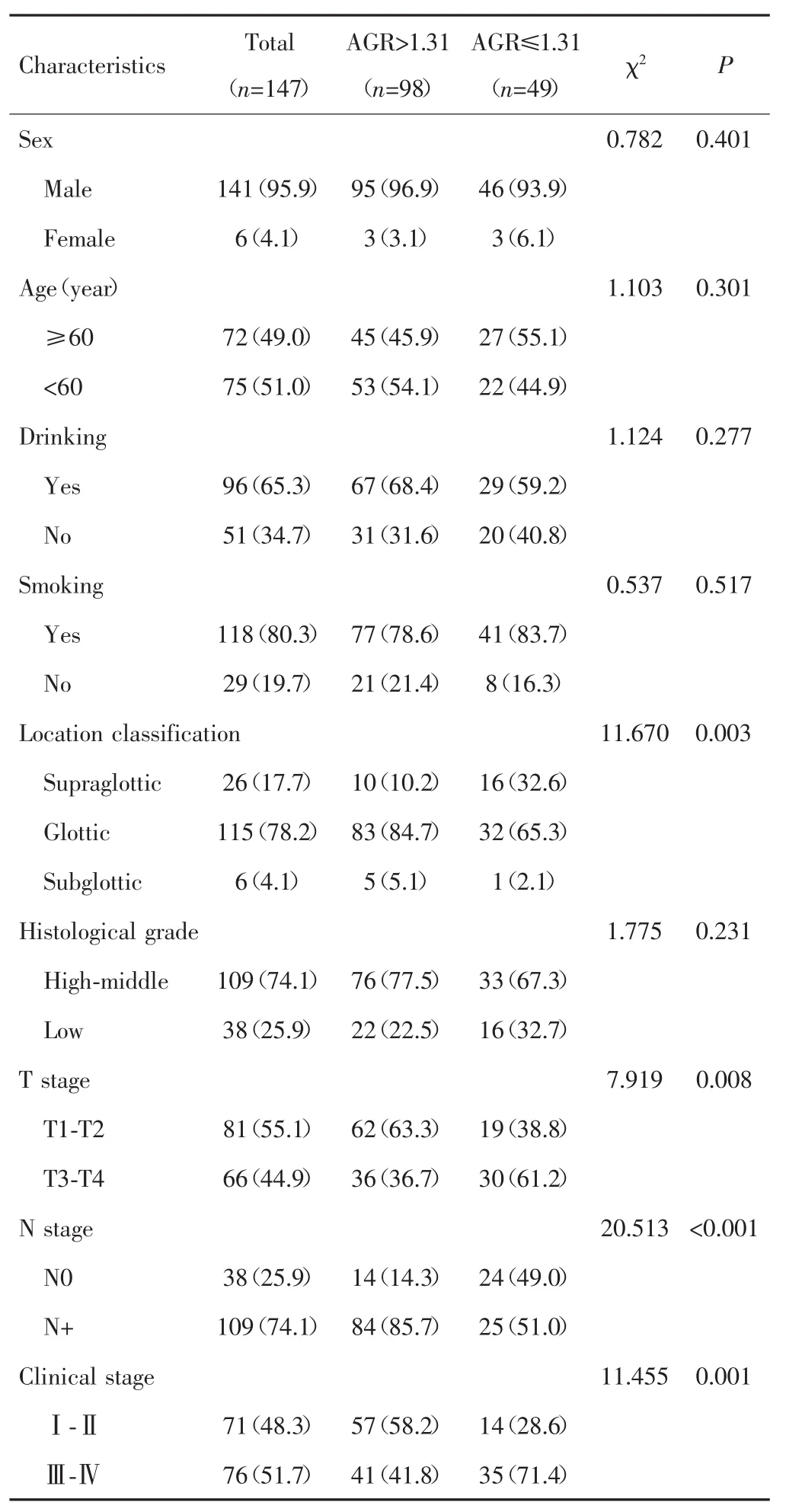
表1 AGR与LSCC患者临床病理特征的关系[n(%)]Tab.1 Relationship between AGR and clinical characteristics of LSCC patients[n(%)]
2.3 AGR与LSCC患者的生存关系
全组中位随访时间为64个月,高AGR组患者3年、5年总生存率分别为88.5%、82.4%,低AGR组患者分别为70.1%、56.4%,两组生存曲线比较差异有统计学意义(χ2=16.639,P<0.001),见图 1。
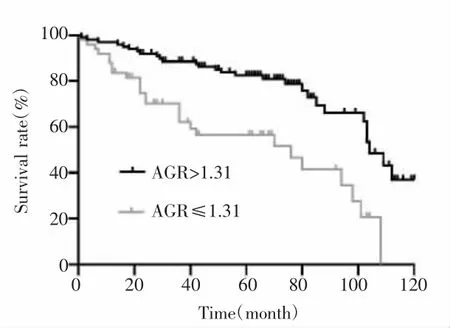
图1 高AGR组和低AGR组LSCC患者的生存曲线Fig.1 Overall survival curve for the LSCC patients stratified by AGR
2.4 影响LSCC患者总生存期的因素
单因素Cox回归显示,吸烟、肿瘤部位分型、组织学分级、T分期、N分期、临床分期、AGR与总生存期有关(P<0.05),见表2。多因素Cox回归显示,术前AGR≤1.31是影响患者OS的独立危险因素(HR=2.098,95%CI:1.142~3.856,P=0.017),见表 3。
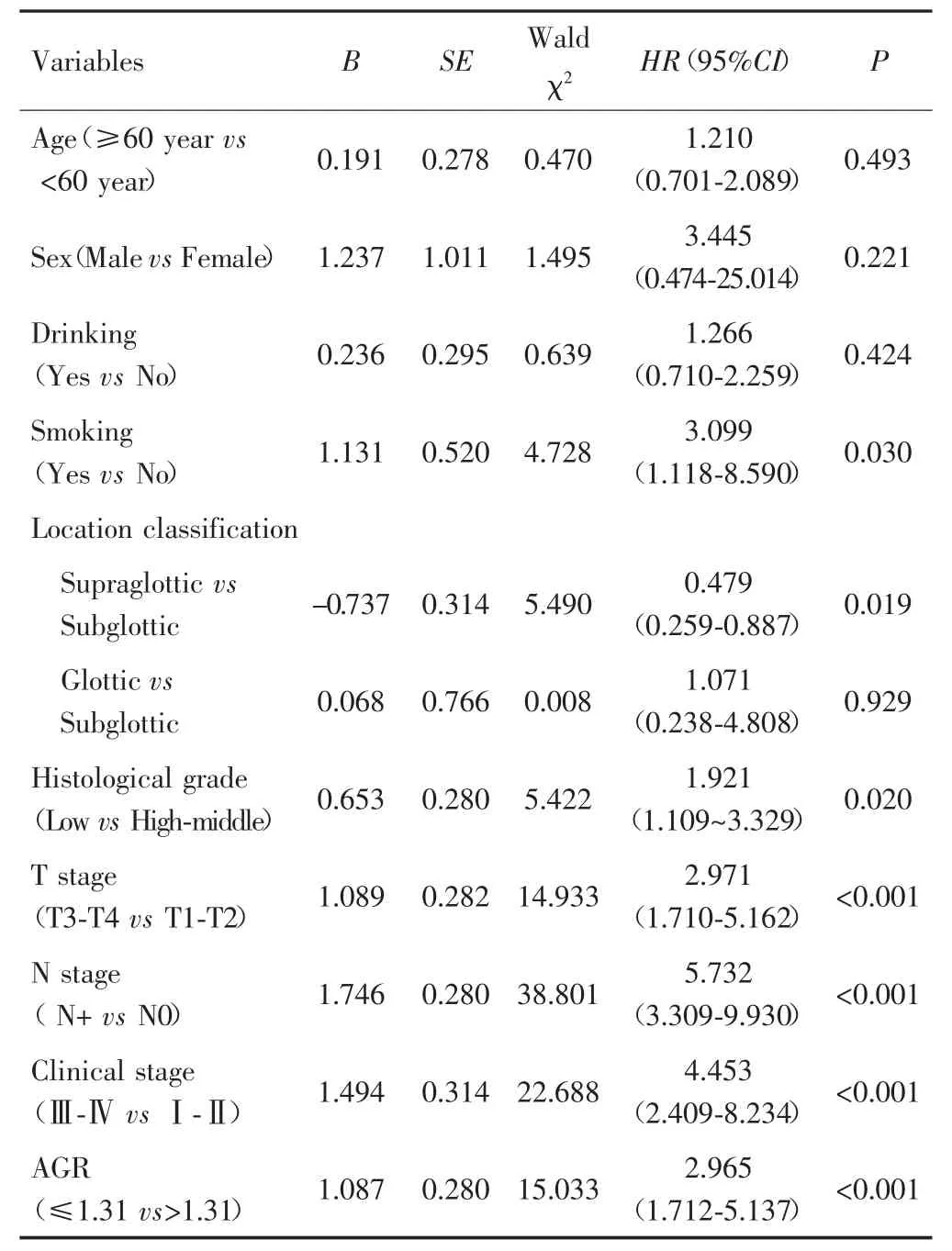
表2 影响LSCC患者OS的单因素Cox回归分析结果Tab.2 Univariate Cox regression analysis of OS in LSCC patients
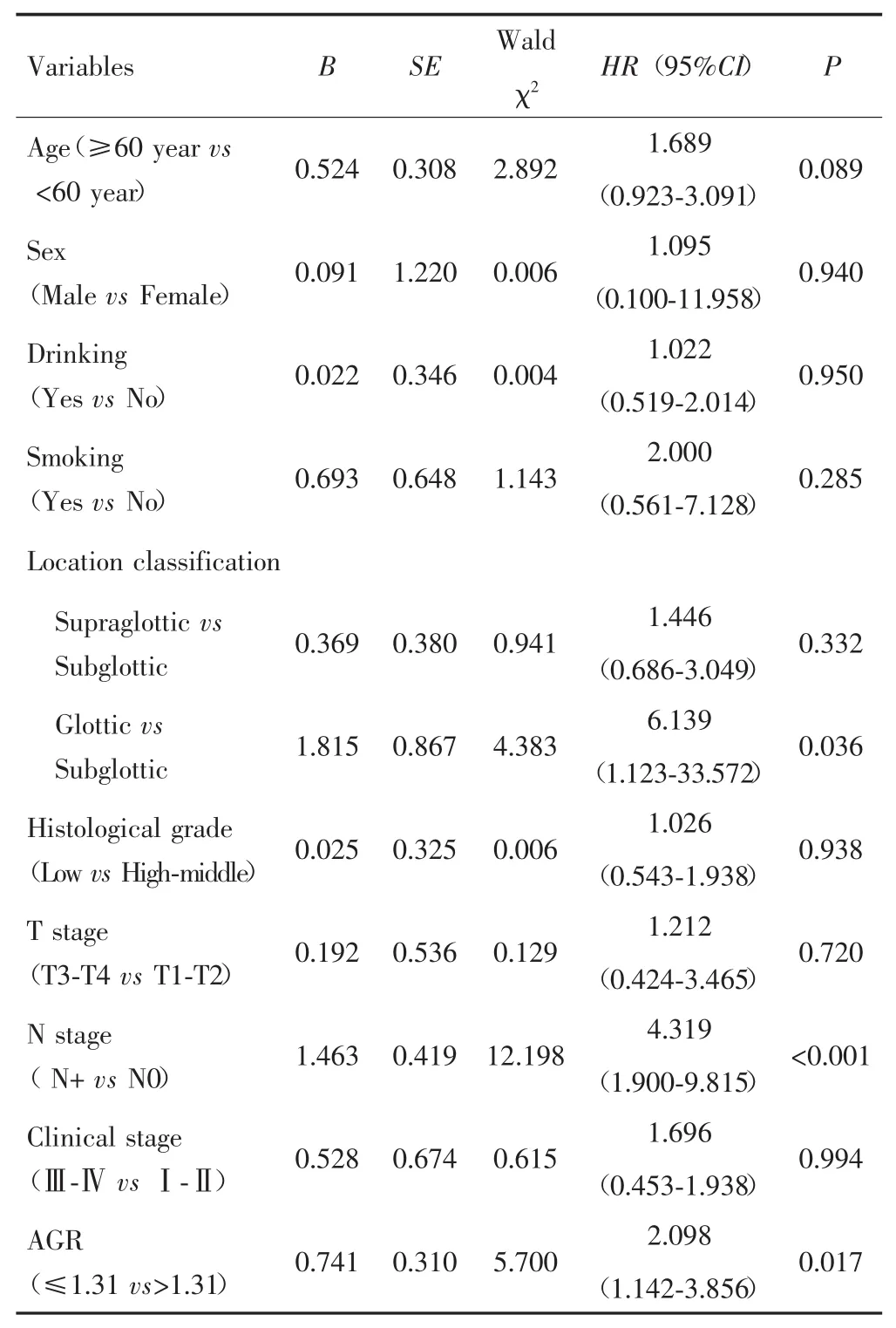
表3 影响LSCC患者OS的多因素Cox回归分析结果Tab.3 Multivariate Cox regression analysis of OS in LSCC patients
3 讨论
目前临床常用CT作为评估LSCC患者病情及制定治疗方案的手段,但由于LSCC位置隐蔽,早期症状不明显,CT检查结果提示N0期,但部分患者就诊时已发生淋巴结转移,尤其是声门上型LSCC,从而影响预后[3,10-11],因此寻找更敏感的 LSCC 预后评估指标有重要意义。近年来,术前全身炎症及免疫反应标志物在喉癌预后评估中应用广泛,如中性粒细胞/淋巴细胞比值(NLR)、血小板/淋巴细胞比值(PLR)、淋巴细胞/单核细胞比值(LMR)等[12-14]。这些指标对评估LSCC患者预后有一定参考价值,但敏感性及效能稍逊于白蛋白指标[15-16]。AGR是白蛋白指标之一,与CT相比,具有检测简便、经济实用、无辐射等优势。ZHOU等[16]比较AGR与其他炎性指标比值评估LSCC患者预后的作用,制作ROC曲线显示AGR最佳截断值为1.31,且发现AGR对LSCC预后的预测价值优于NLR、PLR、LMR。本研究通过X-Tile软件计算AGR的最佳截断值为1.31,与上述研究的最佳截断值一致,因此以1.31为临界值探讨AGR与LSCC预后的关系。
研究表明AGR与LSCC的发生和进展密切相关[17]。炎症可抑制白蛋白的生成,同时营养不良可加剧白蛋白合成不足,这是多种恶性肿瘤发生的诱因[18]。研究发现白蛋白水平可反映癌症患者营养状况,低白蛋白情况下,患者细胞免疫、体液免疫和吞噬细胞功能较低,免疫系统相对脆弱,易感染,影响治疗效果[10,14]。球蛋白由血浆中所有促炎症蛋白组成,包括急性期蛋白和免疫球蛋白,促炎症蛋白聚集导致球蛋白水平升高,反映机体的炎症反应及持续暴露于不同促炎症因子状态,亦可促进肿瘤生长及增殖[5]。AGR降低说明患者血清白蛋白水平低、球蛋白水平高,机体整体状态欠佳[16]。DU等[19]研究喉癌患者发现低 AGR 喉癌患者声门上型的淋巴结转移率较高。CHO等[12]研究报道AGR对喉癌预后具有预测价值。本研究对147例LSCC患者进行回顾性分析,结果显示AGR与肿瘤部位分型、T分期、临床分期、淋巴结转移有关,提示AGR可能与预后有关。随访分析发现低AGR患者3年、5年总生存期显著低于高AGR患者。本研究进一步采用Cox回归分析影响LSCC患者预后的因素,单因素分析结果显示吸烟、肿瘤部位分型、组织学分级、AGR、N分期、T分期及临床分期、AGR可能是影响OS的预后不良因素,多因素结果显示术前AGR≤1.31是影响患者OS的独立危险因素。与相关文献报道基本一致[14,16]说明AGR可能是评估LSCC预后的有效指标。
综上所述,低AGR是LSCC患者预后的独立危险因素,AGR降低提示LSCC预后不良。此外,AGR具有敏感性高、重复性好、检测简便、经济实用等优点[5,16],便于广泛应用。但本研究为回顾性分析可能存在数据收集偏倚,多因素分析亦未能校正不确定的混杂因素等,研究结论需大样本、多中心研究进一步证实。

