响应面杉木叶片多酚提取工艺及其优化
张 健, 吕蒙蒙, 谢亚聪, 武忆寒, 林思祖, 陈 宇
(1.福建农林大学林学院;2.国家林业和草原局杉木工程技术研究中心,福建 福州 350002)
植物多酚又称植物单宁,是植物次级代谢产生的一种天然有机化合物,广泛存在于植物体的各组织中[1].多酚类成分具有抗氧化活性[2]、抗菌[3]、抗病毒、抗微生物、调血脂和降血糖[4-9]的作用;具有抗脂质化作用[10]、增强抗氧化性能力等生物学作用[11].因此,植物多酚被开发应用于医疗保健[12]、化妆品[13]、食品保鲜[14-15]、建筑功能材料[16]等诸多领域.近些年随着多酚提取方法的不断发展,先后有诸多学者对甘薯[17]、苹果[18]、青荚[19]、梨[20]、鸡桑[21]等植物的叶进行了多酚提取工艺优化研究,为不同植物资源的综合利用提供了研究思路.
杉木[Cunninghamialanceolata(Hook.) Lamb.]为中国长江、秦岭以南地区用材栽培最广树种[22].杉木资源利用目前主要集中在木材方面,而其非木质利用方面研究相对匮乏,鲜有学者对其种鳞进行了多酚的提取方法及工艺优化研究[23].随着生态建设中杉木人工林培育面积和区域不断扩大,在其抚育、间伐[24-25]过程中产生大量剩余树叶,剩余物巨大,如何利用这些剩余物资源,丰富杉木人工林产品种类,提高杉木综合利用效率,对于促进杉木人工林总体产值提升具有重要意义.而开展杉木叶片多酚最佳提取工艺的研究是开发杉木资源潜在价值的有效手段之一.因此,本研究以杉木叶片为原料,采用超声波微波萃取协同辅助提取多酚,通过响应面试验优化其工艺参数,以期为杉木叶片中的多酚产业开发及杉木综合资源的利用提供一定的研究基础.
1 材料与方法
1.1 材料与仪器
原料为2018年2月至7月在福建省三明市尤溪国有林场抚育、间伐、采伐及实验采样后的杉木废弃叶片,保鲜处理后带回实验室,冷冻干燥36 h,用粉碎机粉碎后,过筛(100目)后收集至密封袋,置于4 ℃冰箱备用.
药品(分析纯):没食子酸(20180809,上海阿拉丁生化科技股份有限公司);无水乙醇(20180806,上海国药集团化学试剂有限公司);无水碳酸钠(20151216,上海国药集团化学试剂有限公司);福林酚试剂(20180812,北京索莱宝科技有限公司).
仪器:FT102微型植物粉碎机(天津市泰斯特仪器有限公司),CP224C奥豪斯电子分析天平(上海奥豪斯仪器有限公司);Xinyi-1000Q超声波微波协同萃取仪(宁波新艺超声设备有限公司);Infinite®200 Pro NanoQuant酶标仪(Tecan Austria GmbH); HH-4数显恒温水浴锅(常州国华电器有限公司);PD-1E冷冻干燥机(北京德天佑科技发展有限公司).
1.2 试验方法
1.2.1 没食子酸标准曲线的建立 精确称量没食子酸标品0.025 g后,超纯水溶解,定容至100 mL,制备得0.25 mg·mL-1的没食子酸标准液.采用福林酚试剂法[23],按梯度精确递增吸取一定量的0.25 mg·mL-1的没食子酸标准液,制备0.25、0.20、0.15、0.10、0.05和0 mg·mL-1的标液.依次按梯度取0.2 mL不同浓度标液于6个10 mL棕色离心管内,再加入0.4 mL福林酚试剂,震荡摇匀,5 min后依次加入2 mL 10% Na2CO3溶液,取超纯水2.4 mL定容至5 mL,震荡摇匀,50 ℃水浴1 h,然后在765 nm波长处分别测得吸光度值[23].根据吸光度值与浓度的关系,线性回归后得方程为y=2.830 9x+0.058 6,R2=0.999 3.
1.2.2 杉木叶片多酚提取量的测定 称取一定的杉木混合叶片后加入既定浓度的乙醇溶液,在不同条件下进行超声萃取后,经真空过滤后得到叶片提取液.将其稀释一定倍数后取0.2 mL于10 mL棕色离心管内,依照1.2.1福林酚试剂法测定多酚步骤于可见光分区765 nm处测其吸光值.以没食子酸标准品计算样品中的多酚含量,计算公式如下:
式中:V为提取液体积(mL);M为原样质量(g);A为原液液稀释后测得的吸光值;N为提取液稀释倍数;P为多酚提取量(mg·g-1).
1.2.3 单因素试验 称取0.5 g杉木叶片粉末,微波功率固定150 W,进行单因素试验,以多酚提取量为考察指标,考察各个因素.各单因素条件分别为提取时间10、15、20、25、35 min,乙醇浓度20%、40%、60%、80%、100%,液料比(一定浓度的乙醇体积与杉木混合叶片质量比值)60∶1、70∶1、80∶1、90∶1、100∶1、110∶1,提取温度30、40、50、60 、70 ℃和超声波功率100、200、300、400、500 W.
1.2.4 响应面优化试验设计 在1.2.3试验的基础上,选定提取时间(A)、液料比(B)、乙醇浓度(C)、提取温度(D)为因子、多酚提取量(P)为响应值,建立4因素3水平的响应面试验方案,29个试验,每次试验重复3次经分析回归拟合后得到回归方程,理论预测试验方案及多酚提取量理论值.杉木叶片的响应面因素及水平设计见表1.
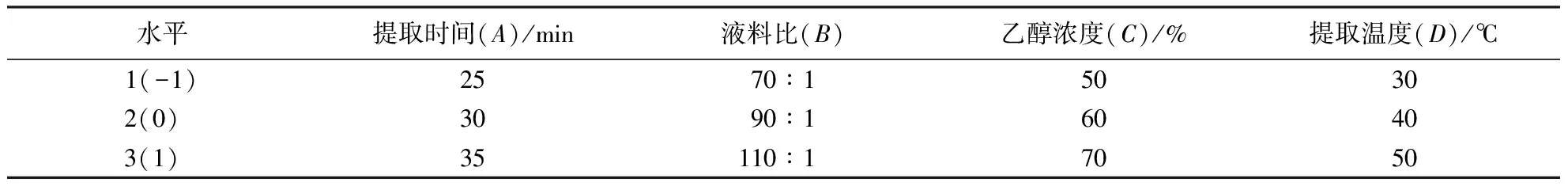
表1 杉木叶片响应面试验因素及水平表Table 1 Factors and levels of response surface test for Chinese fir leaves
1.2.5 数据处理 试验数据采用Excel 2016分析处理后,在其试验结果基础上,用 Design-expert 10设计及处理分析,制图.
2 结果与分析
2.1 单因素试验结果
由图1可知,在设定的单因素的取值范围内,杉木叶片多酚提取量均为先升后降趋势.提取时间30 min时,多酚提取量最高(43.33 mg·g-1),比最低水平提升了10.68%(图1a);提取温度40 ℃时,多酚提取量最高(43.80 mg·g-1),比最低水平提升了20.93%(图1b);乙醇浓度60%时,多酚提取量最高(45.65mg·g-1),比最低水平提升了26.89%(图1c);当液料比为90∶1时,多酚提取量最高(49.30 mg·g-1),比最低水平提升了23.25%(图1d);超声波功率对杉木叶片多酚提取量无明显影响(图1e),在保证多酚提取量的前提下,为节约能耗,降低仪器损耗,将超声功率固定为100 W.
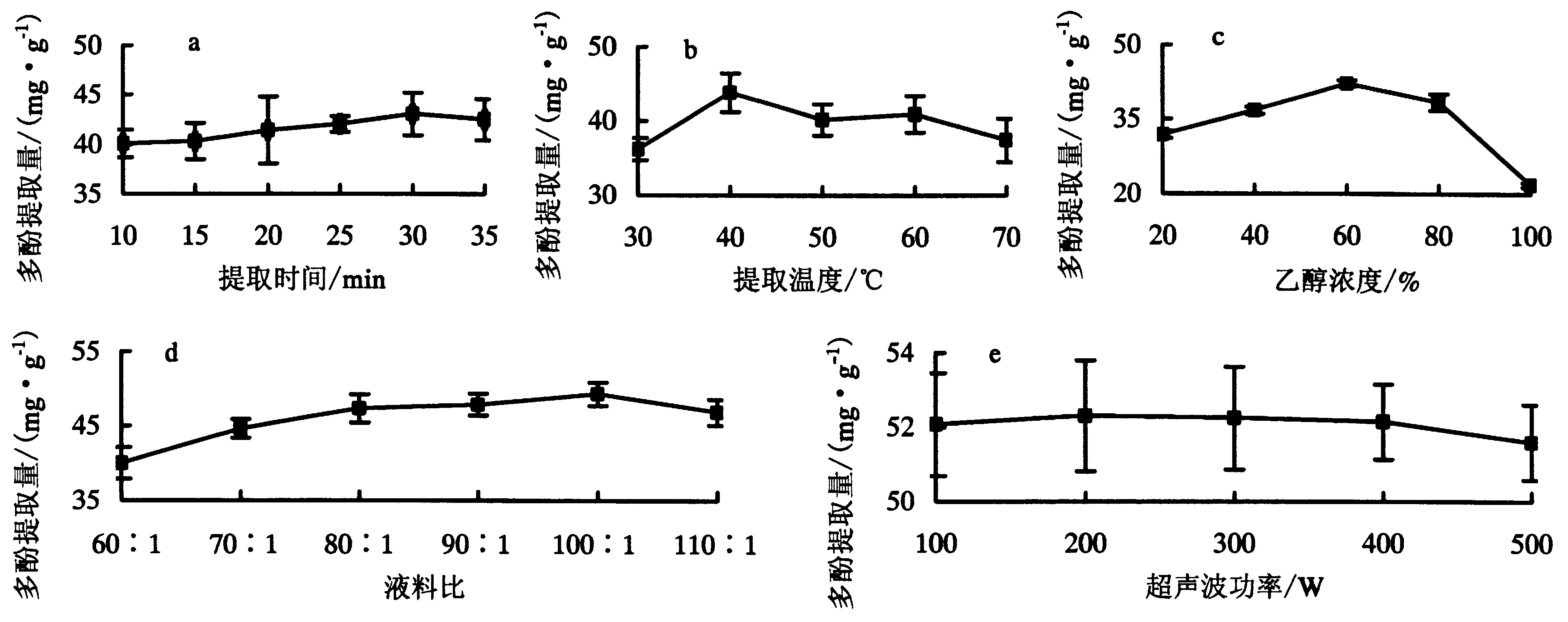
图1 各因素对多酚提取量的影响Fig.1 Effects of factors on polyphenols yields
2.2 Box-Behnken试验结果与分析
2.2.1 回归数学模型的建立与分析 采用Design-expert 10软件进行响应面(Box-Behnken) 试验设计,结果如表2所示.该试验共设计29个试验点,设5个零点以及24个分析因点,其中的自变量为分析因点,取值(以单因素结果为基础)于提取时间(A)、液料比(B)、乙醇浓度(C)及温度(D)中所构成的三维顶点,零点提取时间(A)、液料比(B)、乙醇浓度(C)、提取温度(D)的中心点,为保证试验重复性,点试验进行3次,以降低不可控因素对试验的干扰.
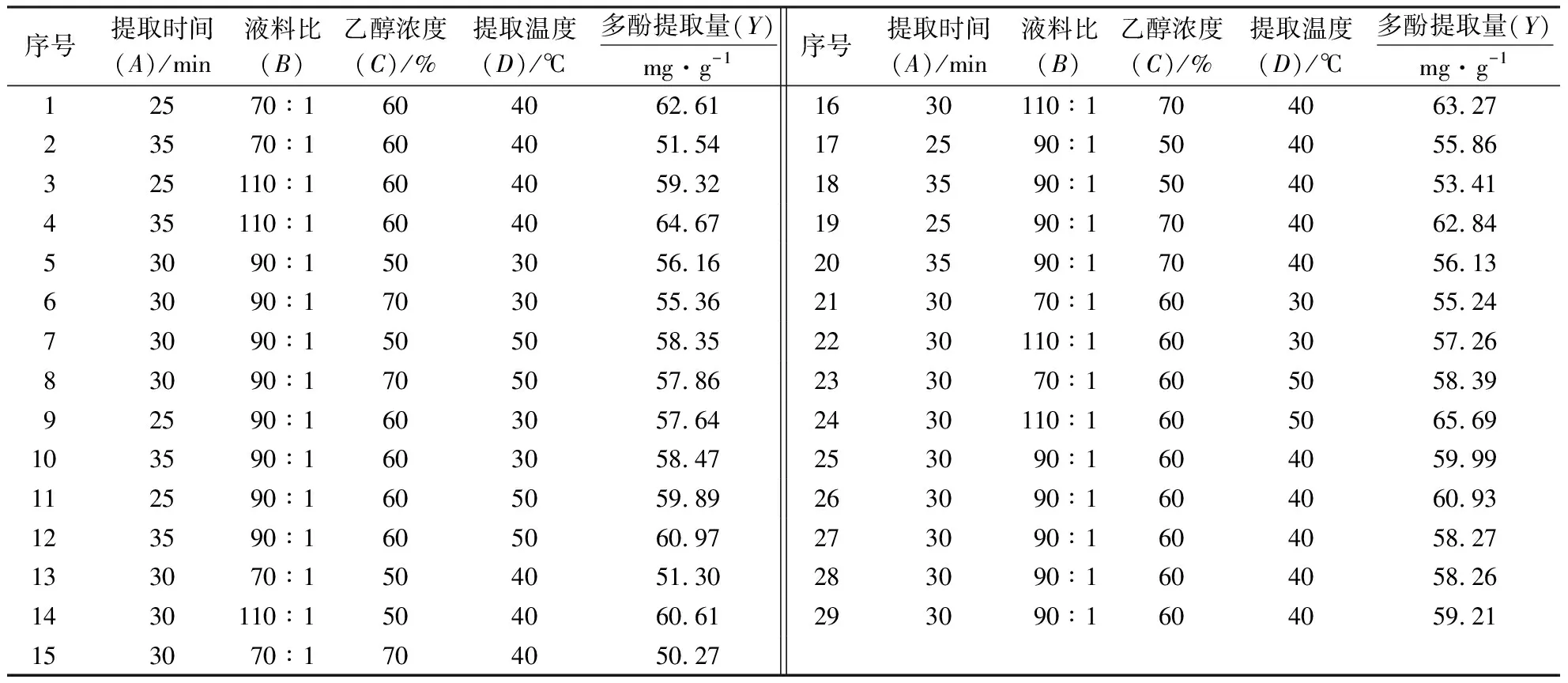
表2 响应面试验结果1)Table 2 Results of response surface test
1)表中最终值为3次重复试验的均值.
表2数据用软件进行回归方程拟合,得到多酚提取量理论预测值(Y)与提取时间(A)、液料比(B)、乙醇浓度(C)、温度(D)的回归模型方程:
Y=74.24-3.17A-1.51B+3.31C-0.46D+0.04AB-0.02AC+1.25AD+4.61BC+6.60BD+7.5CD+8.26A2-
4.77B2-0.025C2-5.22D2
对该模型进行方差分析,比较各因素作用大小,分析如表3.数字模型方程(P<0.01)极显著,其决定系数(R2)为0.819,Radj2=0.637为调整后系数,可见该模型拟合性较好,失拟性P=0.064 2,差异不显著(P>0.05),变异系数CV=3.920%,可知该回归方程拟合度较高,试验误差小,置信度较高,试验可重复性较高.其中A、C、AC、AD、BC、BD、CD、A2、B2、D2差异不显著,D、C2差异显著,B、AB差异极显著,从表3的显著性和F值可知,影响杉木叶片多酚提取量的因素依次为液料比(B)>提取温度(D)>乙醇浓度(C)>提取时间(A).
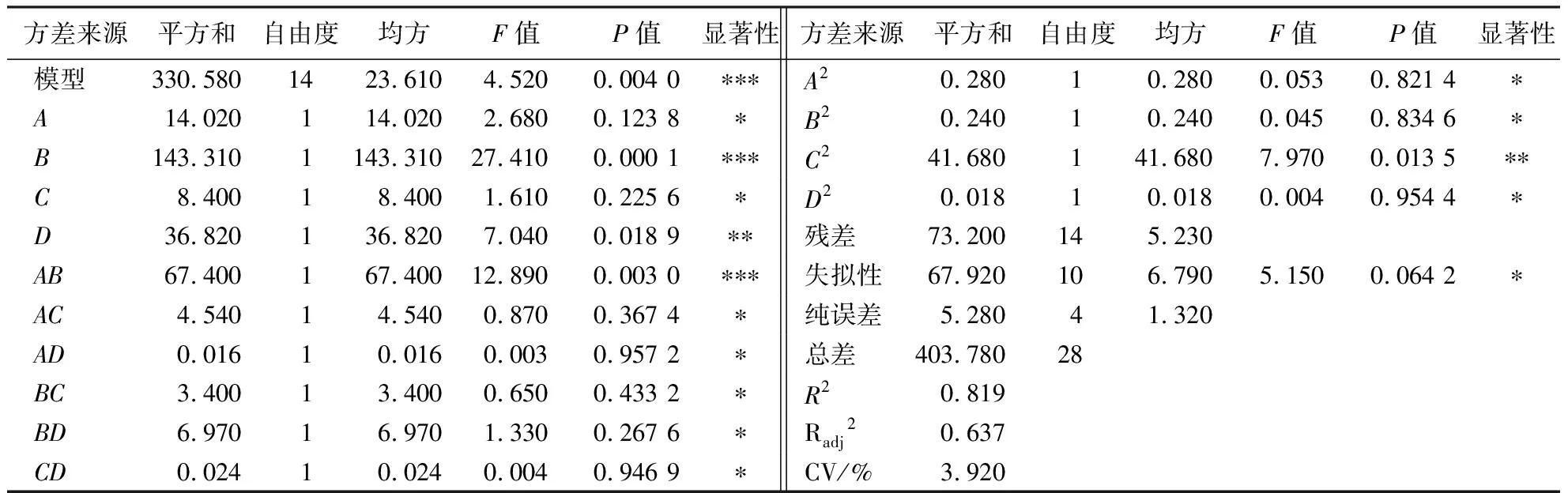
表3 回归方程显著性检验表1)Table 3 Significance testing for the regression equations
1)*表明P>0.05差异不显著,**表明P<0.05差异显著,***表明P<0.01差异极显著.
2.2.2 响应曲面图分析 图2为多酚提取量(响应值)与各个因子之间的响应曲面.图2a、2c为提取时间与液料比、温度的之间的交互作用对杉木叶片多酚提取量的影响结果,当提取时间在25~35 min之间时,多酚提取量均有下降趋势.提取时间与乙醇浓度交互作用对杉木叶片多酚提取量的影响结果如图2b所示,多酚提取量先缓慢上升后趋于平缓.图2c、2e、2f为提取温度与其他因素的交互作用对杉木叶片多酚提取量的影响结果,当提取温度在30~50 ℃之间时,多酚提取量均呈上升趋势.乙醇浓度与剩余因素之间的交互作用结果如图2b、2d、2f所示,当乙醇浓度在50%~70%之间时,多酚提取量先是缓慢上升然后呈下降趋势,响应面坡度变化较大.图2a、2d、2e为液料比与其他3个因素的交互作用结果,当液料比在70∶1~110∶1之间,多酚提取量均呈上升趋势,其响应面坡度变化的幅度极大.
2.3 最佳理论工艺及验证性试验
运用软件得出的模型方程进行最佳理论试验模拟后,得杉木叶片的最佳提取工艺:提取时间35 min,液料比110∶1,乙醇浓度61.50%,提取温度50 ℃,理论预测多酚提取量为68.97 mg·g-1.重复6次最佳工艺,实际测得多酚平均量为62.72 mg·g-1,低于理论值10%,实测值与理论值相差较小,说明此模型较为准确可靠,具有实际操作可行性(表4).在保证提取量的基础上,应简化试验操作,迎合试验操作.因此提取工艺改良为:提取时间35 min,液料比110∶1,乙醇浓度60%,提取温度50 ℃.在该条件下重复6次,测得多酚平均得率为 62.92 mg·g-1,高于最佳工艺值0.32%,适用于实际试验操作.
3 讨论
本研究运用Box-Behnken的试验原理,探讨以杉木叶片为试验材料,采用超声波提取法提取多酚的最佳工艺及其优化,得到其最佳工艺条件:提取时间35 min,液料比110∶1,乙醇浓度60%,提取温度50 ℃.在单因素处理的结果中,超声功率的单因素试验结果表明其对杉木叶片多酚提取影响不大,且多酚得率在超声功率增大后有略微下降,推测其因“空化效应”增强,导致已提取出的多酚结构遭到破坏,从而多酚得率下降[26-27].提取温度对杉木叶片多酚提取率影响的机理是:提取温度升高,分子运动加快,多酚析出增加,加速了乙醇挥发,同时多酚结构被破坏,导致多酚得率降低[28-29].其次,加大液料比,延长提取时间,均属于变相增大接触面积和延长时间促进溶质析出;乙醇浓度在一定范围内变化,有利于多酚与蛋白质等结合的氢键破坏,但超限后会导致提取液中醇性杂质增多,进而使多酚提取率有所降低[30-31].
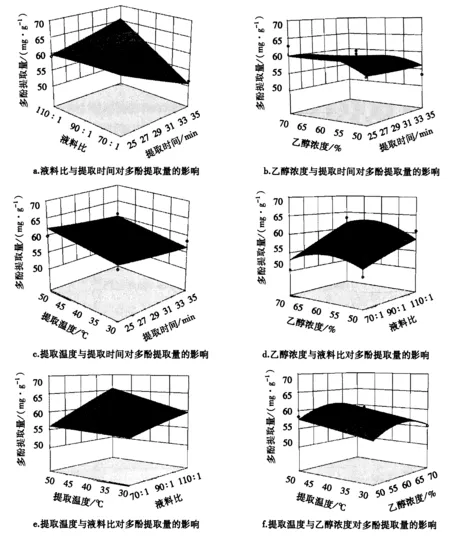
图2 不同组合变量与多酚提取量的关系响应曲面Fig.2 Response surface map of pairwise combinations of variables and polyphenol yields
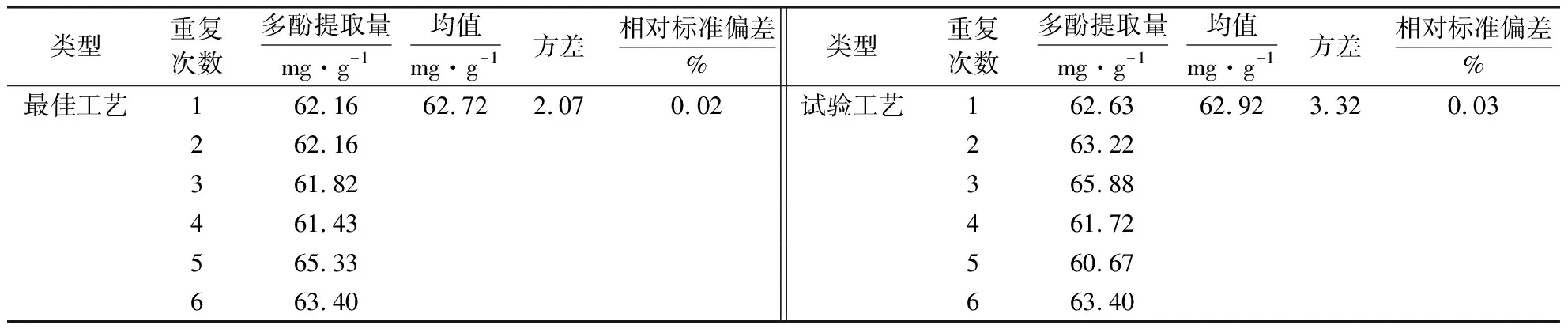
类型重复次数多酚提取量mg·g-1均值mg·g-1方差相对标准偏差%类型重复次数多酚提取量mg·g-1均值mg·g-1方差相对标准偏差%最佳工艺162.1662.722.070.02试验工艺162.6362.923.320.03262.16263.22361.82365.88461.43461.72565.33560.67663.40663.40
目前已在较多物种中开展关于利用植物采伐剩余物提取多酚的研究.相较于玉米苞叶(3.72 mg·g-1)[32]、枇杷叶(48.24 mg·g-1)[33]、甘薯叶(15.80 mg·g-1)[34]、黄芩叶(4.99 mg·g-1)[35]等,杉木叶片的多酚得率较高(62.92 mg·g-1).李佳等[23]利用杉木种子园中收种后的剩余球果进行多酚提取,其多酚得率为34.30 mg·g-1,低于本研究中叶片的多酚得率 62.92 mg·g-1,推测与鳞片的含水率较高和提取方法不同有关.从本研究的结果看,杉木叶片中含有较为丰富的植物多酚资源,具有良好的应用前景.

