茉莉花原生质体瞬时表达体系的建立及应用
张 娅, 刘晓烽, 张 婧, 何 弦, 袁 媛, 吕美玲, 黄晨星, 郑祥梓, 缪 颖, 伍炳华
(1.福建农林大学生命科学学院,福建省植物功能生物学与绿色农业重点实验室;2.福建农林大学园艺学院,福建 福州 350002)
茉莉花[Jasminumsambac(L.) Ait]是木犀科素馨属香花植物,可用于茉莉花茶的窨制和香料提取[1,2].双瓣茉莉是我国茉莉花栽培的主要品种,其花冠筒分为两轮,花瓣洁白,产量高,花香浓,是窨制茉莉花茶的主要原料,具有重要的经济价值;植株抗逆性较强,易于栽培,也是用于研究的理想材料[3].获得可稳定遗传的转基因植株虽然是研究植物基因功能的重要手段,但由于耗时长、成本高、转化体系不成熟等因素仍限制着当今许多植物品种的分子生物学研究.瞬时表达技术结合报告基因的使用为研究目标基因功能提供了快速、高效的途径[4,5],拟南芥、烟草、番茄、玉米原生质体细胞,烟草叶肉细胞,烟草BY-2细胞以及洋葱表皮细胞等介导的基因瞬时表达体系已被广泛应用于目标蛋白表达、亚细胞定位、启动子及蛋白活性检测、蛋白互作等基因功能研究分析[6-9].现阶段植物细胞的瞬时转化研究主要集中在模式植物,在花卉植物上的研究相对较少.然而,异源受体细胞对同一蛋白的表达效果可能存在差异[10],为了使目标基因的表达产物正确折叠,修饰并精准定位于相应的亚细胞结构,选择同源植物细胞瞬时表达分析可增加研究的准确性.
前人在茉莉花品种形态特征、香气特性和精油提取方面做了大量研究[2,3,11],但关于功能基因在细胞水平方面的研究甚少,而关于茉莉花原生质体瞬时表达的方法还未见报道,因此建立茉莉花原生质体制备和转化体系为深入开展茉莉花细胞水平及分子水平的功能基因组研究具有重要意义.本研究通过酶解法分离到大量有活力的双瓣茉莉花花瓣原生质体,运用PEG介导的瞬时转化体系,成功鉴定了3个茉莉花来源的目标蛋白在原细胞中的亚细胞定位,为高通量开展茉莉花候选基因的功能分析奠定基础.
1 材料与方法
1.1 试验材料
1.1.1 植物材料 茉莉花供试材料为自然条件下盆栽种植的双瓣茉莉,取自福建农林大学茉莉花种质资源圃.拟南芥供试材料为哥伦比亚生态型[Arabidopsisthaliana(L.) Heynold ecotype Columbia 0],由本实验室人工气候室培育,生长条件为22 ℃,光照13 h(22 ℃),黑暗11 h,光照强度约80 μmol·m-2·s-1,湿度60%. 拟南芥种子在4 ℃冷室春化48 h后,移至温室萌发,萌发后的种子移至蛭石上,定期浇灌1/4 Hoagland营养液.
1.1.2 质粒载体 试验所用载体p35S-GFP来源于细胞表达载体p2FGW7(6666 bp)[12],表达框由花椰菜花叶病毒(CaMV)35S启动子、绿色荧光蛋白(GFP)基因和胭脂碱合成酶终止子(NOS)构成.质粒在大肠杆菌DH5α菌株中扩增后,大量提取纯化质粒DNA,电泳鉴定并测定质粒DNA浓度和纯度,D260 nm/D280 nm=1.8~1.9,DNA浓度为1 μg·μL-1,-20 ℃保存备用.
JsLHY-GFP、JsSWEET1-GFP和JsSWEET17-GFP载体:JsLHY、JsSWEET1和JsSWEET17是福建农林大学园艺学院伍炳华课题组从茉莉花花朵cDNA中利用RACE引物分离克隆到的3个基因,其中JsLHY属于MYB转录因子家族的生物钟LHY/CCA1[13]的同源编码基因;JsSWEET1和JsSWEET17属于糖转运蛋白SWEET家族的两个编码基因[14].3个基因均已亚克隆至细胞表达载体p2GWF7(6670 bp)[12]的GFP编码序列的阅读框5′端,构建了JsLHY-GFP、JsSWEET1-GFP和JsSWEET17-GFP载体.
1.1.3 试剂 主要试剂有纤维素酶(Cellulase ‘Onozuka’ R10, Yakult Pharmaceutical Industry)、离析酶(Macerozyme ‘Onozuka’ R10, Yakult Pharmaceutical Industry)、果胶酶(Pectinase, Sigma)、牛血清白蛋白(BSA, Sigma)、MES(Sigma)、PEG4000(Sigma)、二乙酸荧光素(Fluorescein Diacetate, FDA, sigma)、碘化丙啶(Propidium Iodide, PI, Sigma).其余基本试剂均购自生工生物公司.
1.2 外植体材料的处理
参照Yoo et al[12]的方法,选取生长5~6周的拟南芥真叶中完全伸展的叶片,或自然盆栽下3年生茉莉花植株的嫩叶,用单面刀片将叶片切成宽约0.5~1.0 mm的细丝,与酶液充分混合后,进行原生质体分离.
本试验还选用盛开的茉莉花花瓣作为分离原生质体的酶解材料,并借鉴Yoo et al[12]、Wu et al[15]和Zheng et al[16]的方法,采用不同的处理方式,本文命名为切丝法、胶撕法和磨砂法,比较对茉莉花花瓣原生质体分离效率的影响.选取3~5朵新鲜开放的花朵0.1~0.4 g,采用不同的处理方式使花瓣细胞暴露:A切丝法,用刀片将花瓣切成宽度为0.5~1.0 mm细条;B胶撕法,用胶带纸粘住花瓣正反面,轻轻撕去粘在下表皮上的胶带,使花瓣细胞暴露;C磨砂法,用极细石英砂轻轻摩擦花瓣下表皮,造成表皮轻微磨损暴露出花瓣细胞.处理后的花瓣组织立即移至酶液中,进行原生质体分离,每个处理试验设置3个生物学重复,分别统计花瓣原生质体产量和活性.
1.3 原生质体的分离方法
叶片或花瓣原生质体的制备方法参照Yoo et al[12]的方法,并略做修改,将处理后的植物材料浸泡于含15 g·L-1纤维素酶和4 g·L-1离析酶的酶解液中,酶溶剂为20 mmol·L-1KCl,0.4 mol·L-1甘露醇,20 mmol·L-1MES pH 5.7,10 mmol·L-1CaCl2和1 g·L-1BSA的混合液,抽真空处理30 min后,在25 ℃黑暗条件下静置酶解4 h,之后置于水平振荡器上以200 r·min-1的转速震荡10 min,使原生质体充分释放到酶解液中.向酶解混合液中加入等体积的W5溶液(154 mmol·L-1NaCl,125 mmol·L-1CaCl2,5 mmol·L-1KCl,2 mmol·L-1MES pH 5.7),经200目纱布过滤后,于200g,4 ℃离心3 min,弃上清收集原生质体,之后再加入2 mL的W5,静置冰上40 min,移除上清后,加入2 mL W5溶液重悬,测定原生质体总量.
为优化茉莉花瓣原生质体的分离效率,将切丝法处理后的花瓣组织置于含一定浓度梯度纤维素酶或果胶酶的酶解液中,黑暗条件下酶解3~6 h,在显微镜下统计原生质体产量和死亡率,确定适宜的酶液组合和酶解时间,试验重复3次.使用荧光染料PI检测原生质体的死亡率.向100 μL收集的原生质体中加入 1 μL PI溶液(100 μg·mL-1)混匀,取10 μL至载玻片上,在荧光显微镜下统计一个视野中发出红色荧光信号的原生质体个数和白光视野下原生质体的总个数,观察视野5~10个,原生质体死亡率/%=(发红色荧光的细胞数/原生质体总数)×100.
1.4 原生质体的产量与活性测定
产量测定:通过血球计数板计数.收集的原生质体重悬于W5溶液中,取少量滴于0.1 mm血球计数板上,在光学显微镜下观察,选取膜结构完整的原生质体计数,每个样品计数3个重复,取平均值,统计原生质体产量.悬浮液中原生质体浓度/(个·mL-1)=血球计数板平均每个大方格(0.1 mm3,即0.1 μL)的原生质体个数×104.原生质体产量,即每克鲜重材料所得的原生质体个数/(个·g-1)=原生质体的浓度(个·mL-1)×悬浮原生质体的W5溶液体积(mL)/花瓣质量(g).
活性测定:采用FDA活体染色法.每100 μL悬浮的原生质体中加入1 μL FDA染色液(5 mg·mL-1溶解于丙酮),取10 μL置于载玻片上,在荧光显微镜下检查其活性,活力高的原生质体在荧光下显微镜下可发出黄绿色荧光.
1.5 原生质体的瞬时转化
将沉淀后的原生质体用MMG溶液(0.4 mol·L-1甘露醇,15 mmol·L-1MgCl2,4 mmol·L-1MES pH 5.7)重悬,使其浓度达到2×105个·mL-1,用于PEG介导的遗传转化.每100 μL原生质体样品与10 μL外源质粒DNA(1 μg·μL-1)以及110 μL PEG溶液[400 g·L-1PEG 4000,0.2 mol·L-1甘露醇,0.1 mol·L-1CaCl2]充分混匀后,室温静置5 min,加入440 μL W5溶液终止反应,200g离心弃上清.用100 μL W1溶液(0.5 mol·L-1甘露醇,20 mmol·L-1KCl,4 mmol·L-1MES pH 5.7)重悬原生质体,22 ℃黑暗条件下培养12~16 h,可观察原生质体转化效率或目标蛋白的亚细胞定位.
为改善茉莉花瓣原生质体的转化效率,将分离纯化后的花瓣原生质体重悬成不同浓度的细胞液,向转化体系中加入不同量的p35S-GFP质粒DNA,与等体积的不同质量浓度的PEG溶液轻柔混匀,使转化体系的PEG终浓度分别为50、100、150、200和250 g·L-1, 室温静置分别处理2、5、10、15和30 min,转化后的原生质体暗处孵育16 h,在显微镜下统计转化效率,试验重复3次.转化效率检测:向100 μL转化后的原生质体加入1 μL PI溶液,取10 μL至载玻片上,在荧光显微镜下统计1个视野中发出红色荧光信号的原生质体个数,表达绿色荧光蛋白的原生质体个数和白光视野下原生质体的总个数,观察视野5~10个,原生质体转化效率/%=[发绿色荧光的原生质体数/(原生质体总数-PI染色发红色荧光的细胞数)]×100.
1.6 共聚焦显微镜观察细胞定位
含目标基因的瞬时表达载体转入原生质体,孵育16 h后,从管底吸取10 μL 原生质体溶液置于载玻片上,用 Leica TCS SP8激光共聚焦显微镜观察目标蛋白表达情况.用于观察GFP信号的荧光激发光波长为488 nm,发射波长为505~535 nm;观察叶绿体自发荧光的激发光波长为633 nm,发射波长为647~685 nm.
2 结果与分析
2.1 茉莉花原生质体分离体系的优化
为了分离到足够量、有活力的茉莉花原生质体,本试验采用酶解法,针对不同组织器官、不同处理方式、酶解液组合、酶解时间等因素进行了摸索和优化.
2.1.1 不同处理方式对茉莉花原生质体分离的影响 借鉴拟南芥和番茄叶片原生质体制备方法[12,15,16],初步尝试从茉莉花叶片分离原生质体,然而得到的原生质体多为细胞碎片,且形状异常,FDA染色大部分无荧光,显示存活率极低(图1-A,B).然而,以茉莉花花瓣为试材时,在相同的酶解液中可收集到形态良好,FDA处理发荧光,有活力的原生质体(图1-C,D),因此在接下来的研究中须专注于优化茉莉花花瓣的原生质体分离体系.

A.从叶片中分离出的原生质体;B.FDA染色后的叶片原生质体;C.从花瓣中分离出的原生质体;D.FDA染色后的花瓣原生质体.酶解液组合为1.5%纤维素酶+0.4%离析酶;酶解时间为4 h.标尺=49 μm.图1 双瓣茉莉叶片和花瓣原生质体的分离及检测Fig.1 Isolation and viability test of the protoplasts from jasmine leaves and petals
尝试了用切丝法、胶撕法和磨砂法在酶解前分别对花瓣组织进行处理(图2-A,B,C),以使花瓣细胞能充分接触酶解液.在4 mL相同酶解液中孵育6 h后,收集观察原生质体产量,在3次独立重复试验中均显示切丝法获得的原生质体数量最多,胶撕法次之,磨砂法得到的原生质体产量最低(图3).考虑到操作的简易性,切丝法处理茉莉花花瓣对原生质体分离最有效.

A.切丝法;B.胶撕法;C.磨砂法.图2 花瓣的不同处理方式Fig.2 Different methods on breaking petal epidermis
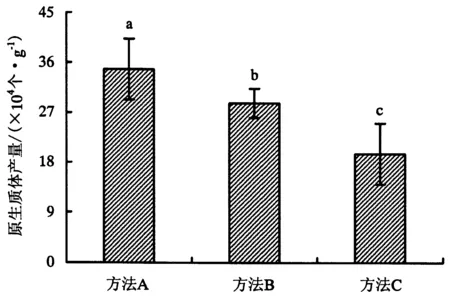
酶解液组合为15 g·L-1纤维素酶+4 g·L-1离析酶, 酶解时间为4 h.同一测定项目不同小写字母表示在0.05水平上差异显著.图3 比较花瓣的不同处理方式对原生质体分离效率的影响Fig.3 Comparison on protoplast yields via different petal epidermis isolation methods
2.1.2 酶液组合和酶解时间对茉莉花原生质体分离的影响 在含4 g·L-1离析酶 和2 g·L-1果胶酶的酶解液中梯度增加纤维素酶的质量浓度从5至30 g·L-1,检测结果显示(图4-A),在一定浓度范围内,原生质体产量随纤维素酶质量浓度提高而增加,当浓度为15 g·L-1时,原生质体产量达到峰值,为1.34×106个·g-1,死亡率为29.1%;随着纤维素酶质量浓度继续升高,原生质体产量和活力都开始下降,细胞破碎程度严重.因此,分离茉莉花花瓣原生质体较适宜的纤维素酶质量浓度为15 g·L-1.在含4 g·L-1离析酶和15 g·L-1纤维素酶的酶解液梯度增加果胶酶的质量浓度从2至10 g·L-1, 花瓣原生质体产量检测结果显示(图4-B),随果胶酶浓度升高,原生质体产量同步增加,当果胶酶质量浓度为8 g·L-1时,原生质体产量最高,为1.48×106个·g-1,死亡率较低,为31.0%, 较适宜花瓣原生质体的分离.试验表明,酶解液中最佳的纤维素酶和果胶酶质量浓度分别为15和8 g·L-1.
为进一步优化茉莉花花瓣原生质体的分离效率,选取4个酶解时间段3、4、5、6 h,采用上述优化后的酶解液组合,检测释放出来的原生质体总量及死亡率.如图4-C所示,随着酶解时间延长,原生质体产量逐步增多,在酶解5 h时,原生质体产量最高,达到2.96×106个·g-1,死亡率为23.5%,相对较低.因此最适合酶解时间为5 h.

A.纤维素酶浓度对原生质体分离的影响,酶解液中含4 g·L-1离析酶和2 g·L-1果胶酶,酶解时间为4 h;B.果胶酶浓度对原生质体分离的影响,酶解液中含4 g·L-1离析酶和15 g·L-1纤维素酶,酶解时间为4 h.C.酶解时间对原生质体分离的影响,酶液组合为15 g·L-1纤维素酶+8 g·L-1果胶酶+4 g·L-1离析酶.材料均为为切丝法处理的花瓣组织.图4 酶液浓度和酶解时间对原生质体分离效率的影响Fig.4 Influences of enzyme concentration and enzymolysis time on protoplast yield
2.2 茉莉花原生质体瞬时转化体系的优化
本研究进一步采用PEG介导法,探讨了原生质体终浓度、外源DNA含量、不同PEG处理等对茉莉花花瓣原生质体瞬时转化效率的影响.
将收集的花瓣原生质体稀释成不同终浓度的细胞液,经相同的转化方法和孵育时间,荧光显微镜下统计原生质体转化效率,结果如图5-A所示,相同转化体系中,外源DNA含量为100 μg·mL-1原生质体时,最适合转化的茉莉花花瓣原生质体浓度为4×105个·mL-1,转化效率约78%.

A.原生质体浓度对转化效率的影响,每100 μL原生质体与10 μg p35S-GFP质粒DNA混合;B.质粒DNA含量对转化效率的影响,转化体系的原生质体浓度为4×105个·mL-1,质粒为p35S-GFP.A,B试验中,转化时PEG溶液终浓度均为200 g·L-1,处理时间均为5 min.C.PEG-4000终浓度对原生质体转化效率的影响,PEG处理时间为5 min;D.PEG处理时间对原生质体转化效率的影响,PEG溶液终浓度为200 g·L-1.C,D试验中,原生质体浓度均为4×105个·mL-1,每100 μL原生质体加入10 μg p35S-GFP质粒DNA进行转化.同一测定项目不同小写字母表示在0.05水平上差异显著.图5 原生质体浓度、质粒DNA含量及PEG处理对转化效率的影响Fig.5 Influences of protoplast concentration, plasmid DNA content and, PEG treatment on transformation efficiency
向原生质体浓度为4×105个·mL-1的转化体系中加入不同量的p35S-GFP质粒,经相同的PEG处理和孵育时间,结果如图5-B所示,当转化体系中DNA含量为75 μg·mL-1原生质体时,转化效率最佳,约为79%.
本研究分析了不同终浓度的PEG4000对茉莉花花瓣原生质体转化效率的影响(图5-C).在终浓度为200 g·L-1的PEG处理下花瓣原生质体的转化效率显著高于其他浓度,其次是150和250 g·L-1的PEG终浓度,50 g·L-1PEG处理下原生质体转化效率最低.
为进一步优化转化体系,本试验还比较了PEG诱导时间对原生质体转化效率的影响(图5-D).PEG处理时间在10 min以内,原生质体转化效率均达到70%以上,当处理时间超过15 min,转化效率显著降低.
2.3 茉莉花花瓣原生质体瞬时表达体系的建立
综合分析了影响茉莉花原生质体分离的主要因素,建立了茉莉花花瓣原生质体的瞬时转化体系.试验流程为:以温室或自然环境中生长并盛开的茉莉花朵为材料,取其充分展开的花瓣为外植体(图6-A),用刀片将花瓣切割到足够纤细且均匀,移至含15 g·L-1纤维素酶,4 g·L-1离析酶和8 g·L-1果胶酶的酶解混合液中,每5 mL酶解液可酶解约0.5 g花瓣量(图6-B),酶解5h,过滤收集到的原生质体经过清洗和沉淀,可获得明显的原生质体聚集层(图6-C). 用MMG溶液将收集到的原生质体稀释至浓度为4×105个·mL-1,按75 μg·mL-1原生质体的比例加入含GFP标签的外源质粒DNA,再加入等体积的400 g·L-1PEG溶液,混匀后,室温诱导约5 min,转化后的原生质体暗处孵育16 h后,在荧光显微镜下可观察到发出绿色荧光信号的原生质体(图6-E),说明含GFP荧光蛋白标签的质粒可高通量导入茉莉花花瓣原生质体,并得到稳定表达.

A.用于制备原生质体的盛开的茉莉花;B.切成细丝状的花瓣浸泡于酶解液中;C.沉淀后的花瓣原生质体(虚线所示);D.明场下的转化后的花瓣原生质体;E.绿色荧光通道下转化后瞬时表达GFP蛋白的花瓣原生质体.标尺=49 μm.图6 茉莉花瓣原生质体的分离和转化Fig.6 Isolation and transformation of jasmine petal protoplasts
进一步利用含有转录因子JsLHY-GFP融合载体,进行目标基因的原生质体表达研究.以p35S-GFP空载体为对照,分别转入茉莉花瓣原生质体后,通过激光共聚焦显微镜扫描检测它们的亚细胞定位.观察显示GFP表达载体转入花瓣原生质体后,其细胞核、细胞质和细胞膜等部位均有明显绿色荧光信号,这与其他植物原生质体转化中观察到的结果一致[12,16,17],而转入JsLHY-GFP融合载体的花瓣原生质体产生的绿色荧光信号主要集中在细胞核中(图7),说明转录因子JsLHY定位于茉莉花细胞的细胞核中行使功能.
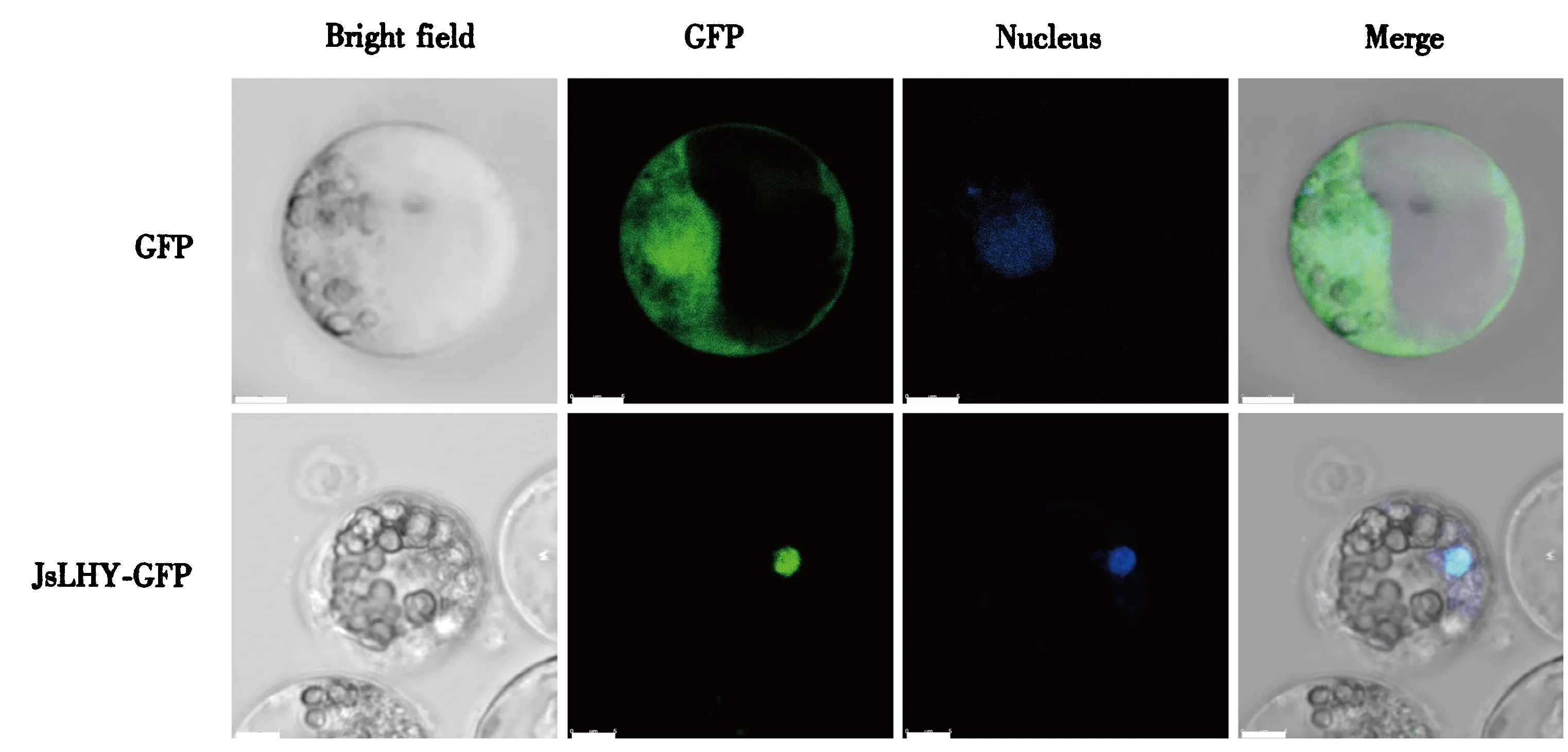
Bright field:明场下原生质体状态;GFP:GFP荧光;Nucleus:DAPI染色的原生质体细胞核;Merge:明场下细胞状态,GFP荧光和DAPI染色的原生质体细胞核的叠加.标尺=5 μm.图7 GFP和JsLHY-GFP在茉莉花瓣原生质体中的分布Fig.7 Distribution of GFP and JsLHY-GFP in the transformed jasmine petal protoplasts
2.4 茉莉花蛋白JsSWEET1和JsSWEET17的亚细胞定位分析
为检验茉莉花来源的蛋白在茉莉花原生质体和异源表达体系中的亚细胞定位是否一致,本研究选择了茉莉花的2个糖转运蛋白家族成员JsSWEET1和JsSWEET17[14],采用上述优化建立的茉莉花花瓣原生质体瞬时转化系统来分析它们的亚细胞分布,同时以拟南芥叶片原生质体系统[12]作为对照.由于白色花瓣原生质体中不含叶绿体,无法检测到叶绿体产生的自发荧光,激光共聚焦显微镜观察结果显示,JsSWEET1-GFP融合蛋白分布于茉莉花瓣原生质体细胞膜上,同时在胞质中有明显的斑点状分布,而在拟南芥叶肉原生质体中JsSWEET1-GFP主要以斑点状分布于细胞质中(图8-A和C).JsSWEET17-GFP在茉莉花瓣原生质体和拟南芥叶片原生质体中均主要分布于细胞质或胞质内膜系统中(图8-B和D).

A-B.JsSWEET1-GFP和JsSWEET17-GFP在茉莉花瓣原生质体中的亚细胞定位;C-D.JsSWEET1-GFP和JsSWEET17-GFP在拟南芥叶片原生质体中的亚细胞定位.Bright field:明场下原生质体状态;GFP:GFP荧光;Chlorophyll:叶绿体自发荧光;Merge:明场下细胞状态,GFP荧光和叶绿体自发荧光的叠加.标尺=10 μm.图8 JsSWEET1-GFP和JsSWEET17-GFP在茉莉花瓣原生质体和拟南芥叶片原生质体中的亚细胞定位Fig.8 Subcellular localization of JsSWEET1-GFP and JsSWEET17-GFP in jasmine petal protoplasts and Arabidopsis mesophyll protoplasts
3 小结与讨论
茉莉花作为一种有重要经济价值的花卉植物,由于其转基因技术的缺少使得其在遗传转化等方面的研究极其困难,而使用原生质体进行瞬时转化则在一定程度上克服了这一障碍.目前,关于茉莉花原生质体制备方法的研究尚未见报道.因此,本研究在借鉴拟南芥原生质体制备的基础上,探索了茉莉花植株上适合分离出原生质体的组织器官,系统地改良了其原生质体的制备条件和转化条件,获得了拥有较高数量和活力的花瓣原生质体,并表现出较好的转化效果.茉莉花花瓣原生质体转化体系的建立,为茉莉花基因和蛋白的研究提供了快捷且更有针对性的受体材料和实验平台,避免了利用其他模式植物瞬时转化体系可能带来的表达或定位紊乱,使得研究结果更具说服力.
获得高质量的植物原生质体,需要考虑到合适的外植体、酶液组合与浓度、酶解时间和酶液渗透压等关键因素[18-20],幼嫩外植体常是分离原生质体的最佳材料,研究表明,盛开的茉莉花花瓣相较于叶片具备组织幼嫩、细胞排列松散等特点,更适合作为原生质体游离的材料.本研究还发现果胶酶对茉莉花花瓣原生质体的分离有关键作用,当酶液中缺少果胶酶时游离出的原生质体数量稀少,而在纤维素酶、离析酶和果胶酶同时使用时,原生质体产量有明显改善.经综合分析,本试验中分离茉莉花瓣原生质体的最适宜酶类组合为:15 g·L-1纤维素酶+4 g·L-1离析酶+8 g·L-1果胶酶,最优酶解时间为5 h.
由于可以清晰看见其细胞膜与细胞器,使原生质体在蛋白亚细胞定位上更具有优势, 利用原生质体进行简易的基因瞬时表达及亚细胞定位是当前研究植物分子与细胞生物学中最常用且高效的方法[21].本实验室在研究茉莉花开花过程相关功能基因时,鉴定到一系列在茉莉花瓣中特异性高度表达的基因[14],采用已建立的茉莉花瓣原生质体表达系统,成功鉴定了拟南芥生物钟调控转录因子AtLHY[13]在茉莉花中的同源蛋白JsLHY具有细胞核定位特性.此外,茉莉花的糖转运蛋白家族可能介导跨细胞膜的糖运输与储存,其家族多个成员在开花过程中表达量显著上调,烟草叶片瞬时表达显示它们多分布于细胞膜或胞质内膜中[14],研究也表明,JsSWEET1-GFP和JsSWEET17-GFP分别定位于茉莉花瓣原生质体的细胞膜和细胞质中,同时JsSWEET1-GFP还以斑点状分布于细胞质中,猜测其可能通过高尔基体或囊泡等细胞器参与糖分运输,这些结果意味着它们介导的生物学功能发生在不同的细胞器中.在拟南芥叶片原生质体中,JsSWEET17-GFP的分布与其在茉莉花瓣原生质体中的定位基本一致,而JsSWEET1-GFP在细胞膜上定位信号较弱,主要以斑点状分布于胞质中,说明其亚细胞分布可能具有组织细胞特异性.
相较于成熟的拟南芥叶肉原生质体瞬时表达体系,本研究中茉莉花瓣原生质体的活性和转化率还有待提升,不过由于栽培容易、自然盛开的茉莉花瓣容易收集、酶解时间短等优点,使得花瓣原生质体的分离和转化试验可在1 d内完成,有效促进了某些基因功能的研究分析.受限于组织特异性,花瓣原生质体中不含叶绿体,所以研究与叶绿体相关的蛋白或基因可能需要共转化对照质粒,未来对茉莉花叶片的原生质体分离体系仍需进一步优化.

