茧蜂标本形态无损提取DNA的新方法
夏慧敏, 黄 珺, 郑敏琳, 陈 湜, 陈家骅
(1.福建农林大学植物保护学院益虫研究所; 2.联合国(中国)实蝇防控研究中心; 3.闽台作物有害生物生态防控国家重点实验室; 4.生物农药与化学教育部重点实验室,福建 福州 350002)
茧蜂科(Braconidae)隶属于膜翅目(Hymenoptera)细腰亚目(Apocritia)锥尾部(Terebrantia)姬蜂总科(Ichneumonoidea)[1],是一类重要的害虫寄生性天敌.为了有效保护和利用该类天敌资源,有必要对茧蜂科标本进行系统分类研究.
相对于传统分类方法来说,DNA条形码技术可高效且准确地区分不同种,同时可作为辨认隐存种或姊妹种等关系紧密物种的潜在工具,对推动分类学发展起到了至关重要的作用[2-3].对于茧蜂这类小型且虫体结构脆弱的昆虫,一般采用常规试剂盒提取DNA(柱离心法)[4]或CTAB法研磨整个虫体提取DNA[5-6],但这些方法无法完整保留标本形态.昆虫标本特别是模式标本的完整性对于昆虫传统分类的研究非常重要.为此,学者们在无损提取方面做了不少尝试.例如:用DNeasy®Blood and Tissue Kit提取试剂盒提取了鞘翅目等昆虫的DNA[7-10],用TNBS方法提取了螨的DNA[11],但提取时间均较长;Casquet et al[12]和Aoyama et al[13]分别在对蜘蛛和跳虫的DNA提取中运用了改进的Chelex 100提取方法,该方法操作简单、成本低廉,但只适用于新鲜标本[12];Castalanelli et al[14]所采用的ANDE法可在短时间内快速、高效地提取DNA,但该方法所用的设备造价高,且不易获得.目前尚未见茧蜂科无损提取方法的报道.全式金生物技术有限公司的TransDirect Animal Tissue PCR Kit®试剂盒与DNeasy®Blood and Tissue Kit提取试剂盒类似,但操作更加简单、快速,无需振荡、离心等步骤,且价格较低.因此,本研究尝试用该试剂盒提取整头茧蜂酒精液浸标本的DNA,并对其操作步骤进行优化,以尽可能地缩短试验时间和降低对标本的伤害;同时,尝试将该方法用于无损提取保存时间较长的茧蜂针插干标本的DNA.
1 材料与方法
1.1 材料
1.1.1 供试标本 福建农林大学益虫研究所保存的体长为1.8~4.5 mm的茧蜂科离颚茧蜂族成虫95%乙醇液浸标本若干头,以及1988、2001和2008年采集并干燥保存至今的干标本各3头.
1.1.2 试剂 全式金生物技术有限公司的TransDirect Animal Tissue PCR Kit®试剂盒,Trans2K DNA Marker®.
1.2 方法
1.2.1 液浸标本的预试验方案 参照TransDirect Animal Tissue PCR Kit®试剂盒说明书,部分步骤有改动:①将AD1、AD2缓冲液按4∶1配制,加入0.5 mL离心管中吹吸混匀,2 h内备用;②视虫体大小,用移液枪移取适量AD1和AD2的混合缓冲液,加入0.5 mL离心管中;③将昆虫标本从95%乙醇中取出,待酒精风干,用金属镊将昆虫移入AD1和AD2的混合液中,确保昆虫被淹没在液面以下,静置10 min;④将含有标本和缓冲液的离心管放入95 ℃恒温水浴锅中,加热3 min;⑤取出离心管,加入与AD1等量的AD3缓冲液,吹吸混匀,静置10 min;⑥用移液枪枪头将标本从缓冲液中取出,重新放入95%酒精中保存;⑦将DNA模板放入4 ℃冰箱中临时保存(-20 ℃长期保存).
1.2.2 液浸标本提取方案的优化 试验前后用LEICA M205C体视镜对试虫进行拍照取证,以判断试验对虫体的损伤程度,进而确定优化条件的有效性.
(1)浸泡时间的优化.标本在缓冲液中的浸泡时间直接影响DNA的提取效果,时间过短会导致提取不充分,过长又会腐蚀标本且延缓试验进度.现将预试验步骤③和⑤的浸泡时间分别设置为3和5 min,并以原方案中的10 min为对照,每个处理重复3次.
(2)热激时间的优化.通过缩短热激时间可减小高温对虫体的损害,提高操作效率.现将步骤④中的热激时间分别设置为30和90 s,并以原方案中的3 min为对照,每个处理重复3次.
综合浸泡时间与热激时间优化所得的试验数据,选取效果较佳的时间,通过组合试验,进一步确定最佳浸泡时间和热激时间.
(3)操作工具的优化.由于试虫虫体小且脆弱,预试验中用金属镊和枪头挑取试虫的方法易对虫体造成机械损伤.因此,自制了一种利用水表面张力与环口托力挑取试虫的取虫环(图1).实践证明,利用该工具转移试虫不会损伤虫体.
A.手柄;B.托环.图1 自制取虫环Fig.1 Hand-made insect picker
(4)试验后对试虫的处理优化.预试验中,试虫用完后被直接放回95%乙醇中保存,发现残余的试剂会对虫体产生一定腐蚀性.因此,通过漂洗来降低残余试剂对标本的损伤:在5 mL离心管内,用200 μL纯水分别对3组重复组精漂(移液枪轻缓抽吸10次左右再静置3 min)3、2、1次,然后用200 μL 75%与95%的酒精粗漂(移液枪抽吸5次左右)1次.
1.2.3 PCR扩增验证DNA质量 使用SMA4000微量分光光度计测定优化操作后提取到的DNA样品在260和280 nm波长下的光密度(D)值,后用4对引物(表1)基因序列片段对样品进行PCR扩增.PCR反应体系(20 μL):ddH2O 5 μL,2×supermix 10 μL,上、下游引物(10 mol·L-1)各0.5 μL,模板4 μL.PCR反应条件见表2.

表1 引物信息Table 1 Information of primers

表2 PCR反应条件Table 2 Reaction conditions of PCR
PCR反应完成后,将产物在100 V条件下经1%琼脂糖凝胶电泳检测(1×TBE为电泳缓冲液,Trans2K DNA Marker作为电泳标准对照),检测结果为单一、明亮目的条带的产物委托上海铂尚公司直接进行纯化和正反向测序,将测序结果整理上传至NCBI进行序列比对.
1.2.4 干标本无损提取DNA 用优化后的试验步骤分别提取3个年份的干标本,每个处理重复3次,且干标本需进行预处理(0.9% NaCl→无菌水→75%乙醇→95%乙醇)[20].
2 结果与分析
2.1 预试验结果

A.肢体碎裂;B.翅褪色萎缩.图2 预试验中损坏严重的试虫标本Fig.2 Specimens damaged in the preliminary experiment
通过预试验方案提取,可得到一定量的DNA,证明TransDirect Animal Tissue PCR Kit®试剂盒对于提取整只茧蜂试虫DNA基本可行.测序表明,28S引物对离颚茧蜂族样本扩增的片段长度为388~399 bp.但预试验方案对虫体损伤较为严重(图2),试虫基本无法再被用于形态识别.
2.2 优化试验结果
2.2.1 液浸标本DNA的提取 (1)DNA提取优化方案.从表3和图3可看出,除第3试验组无法稳定提取出DNA外,其余几组均可提取到足量DNA,且试验组的D260 nm/D280 nm和DNA浓度与对照组差别不大.其中,D260 nm/D280 nm均小于1.7,说明DNA中含有蛋白质等大分子杂质,但并不影响测序结果.故选取最短的第1次和第2次静置时间(3 min)进行进一步组合试验,设置3个试验组(表4).由图4可看出,热激时间小于90 s后,DNA的质量都不够稳定.
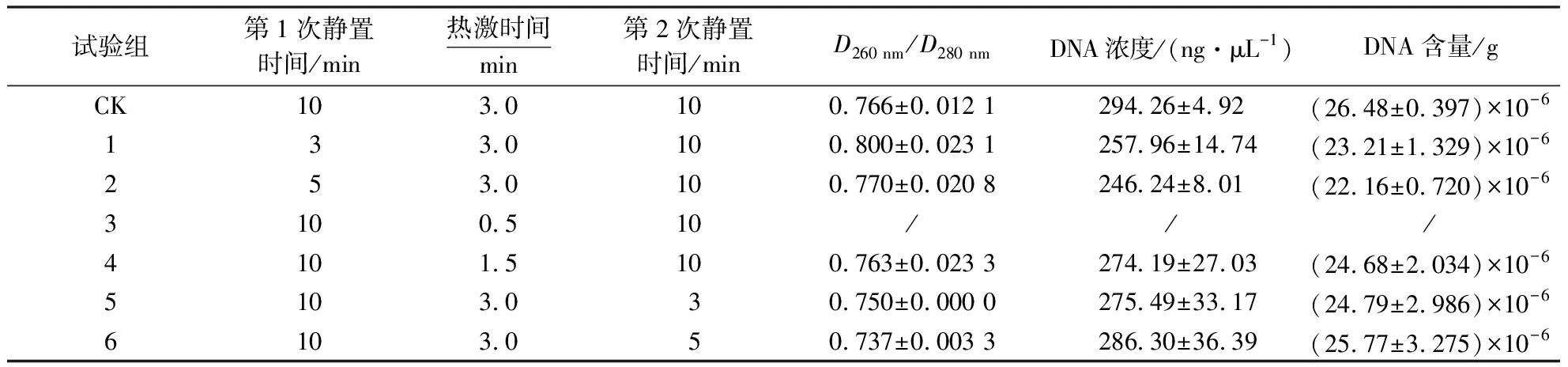
表3 处理不同时间所得的DNA含量与纯度1)Table 3 Contents and purities of DNA obtained from processes under different treatment time
1)表中数据为平均值±标准误.

A、B、C为3组重复;M.Marker;CK.对照组;1~6.试验组(试验条件见表3).图3 处理不同时间提取的DNA 28S片段扩增电泳图谱Fig.3 Electropherogram of 28S fragments amplified from DNA obtained from processes under different treatment time

试验组第1次静置时间/min热激时间min第2次静置时间/minD260 nm/D280 nmDNA浓度 /(ng·μL-1)DNA含量/g131.530.763±0.008 8285.37±12.41(25.68±0.117)×10-6231.030.750±0.010 0346.67±49.38(31.20±4.444)×10-6330.530.733±0.015 3321.64±10.19(28.95±0.917)×10-6
1)表中数据为平均值±标准误.
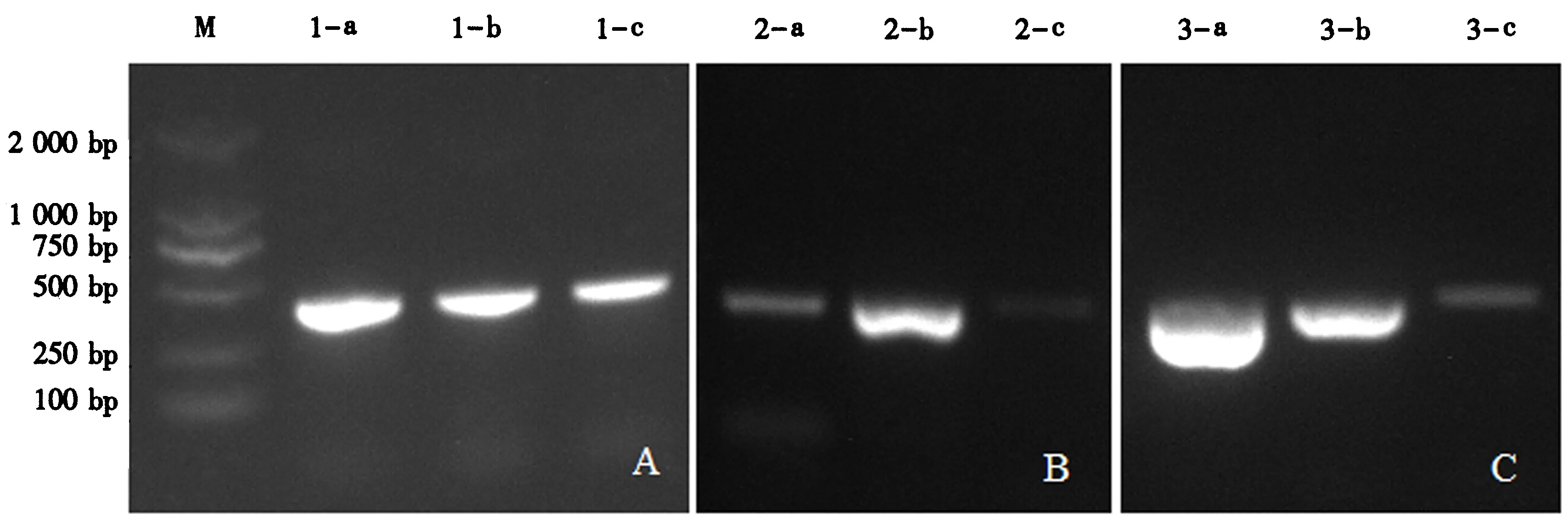
A、B、C分别为试验组1、2、3(试验条件见表4);M.Marker;a、b、c为3组重复.图4 缩短处理时间提取的DNA 28S片段扩增电泳图谱Fig.4 Electropherogram of 28S fragments amplified from DNA obtained from processes under shorter treatment time
(2)试验后对虫体的处理.观察发现,纯水漂洗1次的试虫中有2头翅膀出现了轻微皱缩的现象,而漂洗2次及以上的试虫在后期保存中未出现损伤情况(图5).因此,在实际操作中建议纯水漂洗次数至少为2次.

A.试验前;B.试验后1周;C.试验后6个月.图5 液浸标本优化处理前后对比图Fig.5 Comparison on specimens before and after optimized immersion experiment
(3)分别用4对引物对优化所得DNA进行PCR扩增,将测序结果经BLAST比对为正确的片段上传至NCBI,部分序列号见表5.
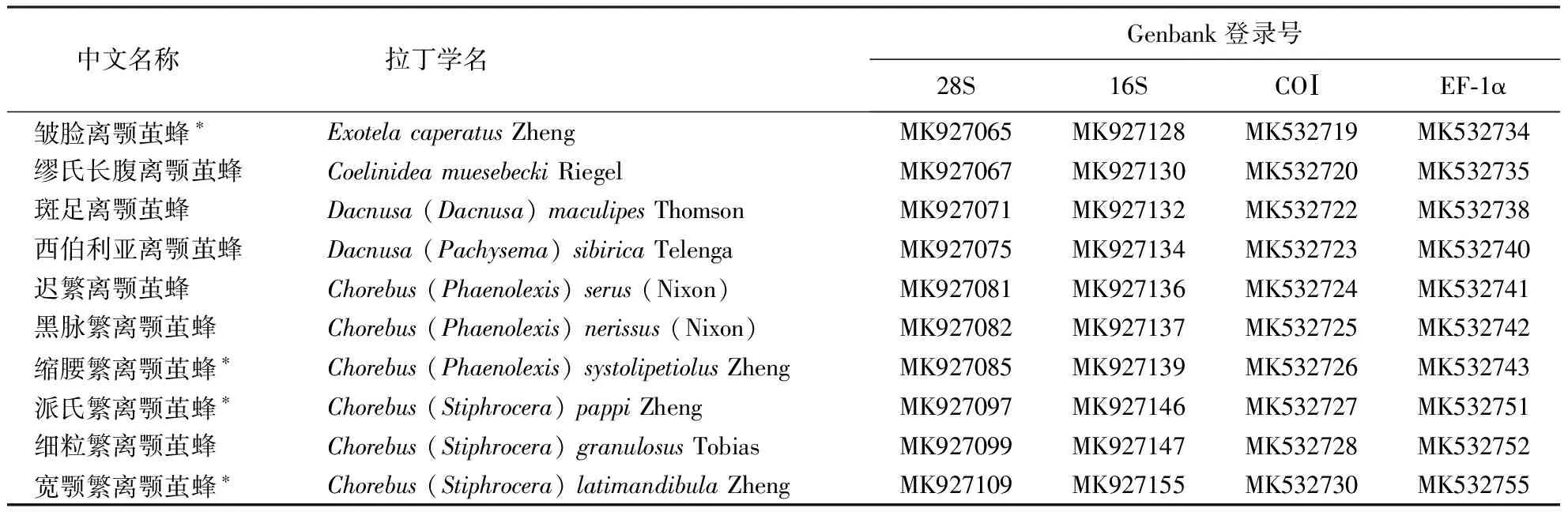
表5 所测样品及其在Genbank中的序列号1)Table 5 Samples examined and Genbank accession numbers
1)*为待发表的新种.
2.2.2 干标本DNA的提取 根据液浸标本DNA提取方案的优化经验,分别选取第1次浸泡5 min、热激2 min和第2次浸泡5 min,按操作步骤提取3个年份干标本的DNA,结果如图6.3个年份的干标本均可提取出DNA,且在操作规范的情况下,标本依然可以保存完好(图7).
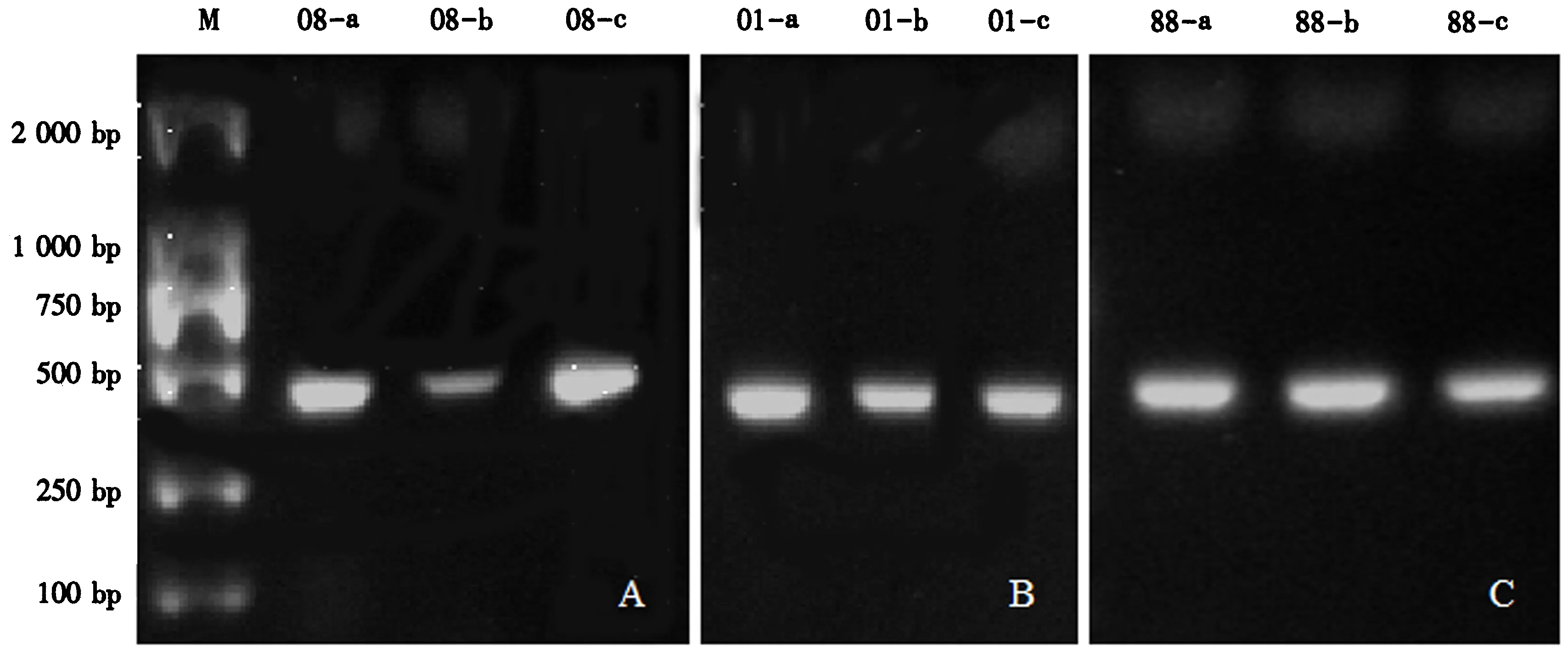
A.2008年标本;B.2001年标本;C.1988年标本;M.Marker;a、b、c为3组重复.图6 干标本DNA 28S片段PCR扩增电泳图谱Fig.6 Electropherogram of 28S fragments amplified from DNA obtained from dry specimen

A.试验前;B.试验后;C.试验后6个月.图7 干标本试验前后对比图Fig.7 Comparison on dry specimens before and after experiment
3 讨论
Miura et al[7]对Chelex方法、PrepMan®超样品试剂和DNeasy®试剂盒3种常规无损提取方法进行了比较,结果发现所有样本头部和腿部硬度较大的部分均保存完好,但PrepMan®对膜翅目前翅和触角的损伤较大,经DNeasy®试剂盒处理的样本触角也出现了一定程度的皱缩.本试验运用全式金生物技术有限公司的TransDirect Animal Tissue PCR Kit®试剂盒,对离颚茧蜂酒精液浸标本和超过20年的针插干标本DNA进行无损提取,成功得到其完整DNA.通过优化试剂盒说明书操作步骤,整个提取过程只需10~20 min,且提取后干标本与液浸标本均无损伤.
离颚茧蜂液浸标本DNA提取的完整优化方案:①将AD1、AD2缓冲液按4∶1配制,加入0.5 mL离心管中吹吸混匀,2 h内备用;②用取虫环将昆虫标本从95%乙醇中取出,待酒精风干,将昆虫移至0.5 mL离心管中;③视虫体大小,用移液枪移取50 μL混合缓冲液,加入离心管中,确保昆虫被淹没在液面以下,静置3 min;④将含有标本和缓冲液的离心管放入95 ℃恒温水浴锅中,加热1.5 min;⑤取出离心管,静置5 min,待管体冷却至室温后加入与AD1等量的AD3缓冲液(40 μL),吹吸混匀,静置3 min;⑥用已消毒的取虫环将标本从缓冲液中取出并放在5 mL离心管内,用200 μL纯水对标本精漂(移液枪轻缓抽吸10次左右再静置3 min)2次,然后用200 μL 75%与95%的酒精粗漂(移液枪抽吸5次左右)1次,再重新放入95%酒精中保存;⑦DNA模板放入4 ℃冰箱中暂时保存(-20 ℃冰箱中长期保存).
该方法的局限性:由于提取到的DNA未经纯化,其光密度值可能会受蛋白质或其他成分的影响,真正的DNA浓度可能略低于本研究测得的数值; TransDirect Animal Tissue PCR Kit®试剂盒所提取的DNA不适合长期保存,根据说明书提示,提取物可于4 ℃保存3个月,-20 ℃保存6个月,且需避免反复冻融.
将得到的序列片段在NCBI上进行同源性比较时发现,有些片段属于白纹伊蚊(Aedesalbopictus)、橘小实蝇(Bactroceradorsalis)、蛾蠓(Psychodidae)等.据文献记载,这些双翅目昆虫可能为离颚茧蜂族的寄主[21-22].这些片段是来自寄主还是样本亦或DNA提取过程中的污染,仍有待进一步研究.本试验还发现同一试虫可进行2次提取,第2次提取获得的DNA也可用于后续的片段扩增,且试虫形态仍不会被破坏.本方法提取单只试虫DNA的极限次数还需进一步研究.

