卡那霉素和壮观霉素对油菜外植体再生芽的影响
傅 淑, 刘昭霞, 陈 进, 杨 广
(1.福建农林大学应用生态研究所/闽台作物有害生物生态防控国家重点实验室;2.农业部闽台作物有害生物综合治理重点实验室;3.福建农林大学害虫绿色防控福建省高等学校重点实验室;4.教育部害虫生态防控国际合作联合实验室,福建 福州 350002)
通过转基因技术获得理想性状的油菜新品种已被广泛报道,但以市场上商业化应用的栽培种为背景材料进行的基因转化研究则相对较少[1-2].以油菜商业化栽培种为材料进行的基因转化不仅在原品种优点的基础上添加了新的目的性状,而且显著缩短了育种周期,提高了新品种的推广速率;但由于不同油菜品系间的基因转化效率存在差异,针对模式油菜开发的成熟基因转化体系并不适用于商业化栽培种.因此,针对特定的商业化栽培种开发相应的基因转化体系具有重要的应用价值[1,3-4].通过农杆菌介导法获得转基因油菜是目前报道最多的方法[5-6].然而,在建立农杆菌介导的植物基因转化体系中,抗生素浓度的设置是基因转化成功与否的关键.若抗生素浓度较低,会产生大量的嵌合体或假阳性现象;反之,抗生素毒性增强,影响转化细胞的分化及生长[7-10].
卡那霉素(kanamycin, Kan)是油菜基因转化研究的常用抗生素,其浓度因油菜品种的不同而存在差异,最低仅为10 mg·L-1,最高达100 mg·L-1[11-13].壮观霉素(spectinomycin, Spe)是植物叶绿体基因转化研究中使用最频繁的抗生素,相比于传统的核基因转化,叶绿体基因转化表现出了明显的优势,如表达量增大、母系遗传和定点插入等[14-15].目前,在油菜的基因转化研究中选择Spe为抗生素的报道较少,已报道使用的Spe浓度为10~20 mg·L-1[16-17].
本研究以市场上的油菜品种“浙大622”为背景材料,通过比较其外植体(子叶柄和下胚轴)在不同浓度Kan或Spe中的愈伤鲜重、外植体再生芽率、单个外植体再生芽数和再生芽白化率,筛选出相应的最适抗生素浓度,为该商业化品种的基因转化研究奠定基础.
1 材料与方法
1.1 材料
甘蓝型油菜(BrassicanapusL.)种子选用商业化栽培种“浙大622”品种,购买于福州市种子零售店.75%酒精和NaClO原液(有效氯≥8%)购自福州伯乐林生物技术有限公司,MS固体培养基粉末、2,4-二氯苯氧乙酸(2,4-D)、硝酸银(AgNO3)、6-苄氨基腺嘌呤(6-BA)、Kan、Spe、蔗糖和琼脂粉等购自索莱宝生物科技有限公司.
1.2 外植体准备
外植体的获得参考Jiang et al[12]的方法,并进行了部分改进.挑选饱满且无伤痕的种子放在水中浸泡1 h,转移至超净工作台做灭菌处理(75%酒精消毒1 min后用3% NaClO灭菌20 min),无菌水漂洗5~6遍,转移至无菌滤纸上晾干待播种.种子播于MS1培养基(2.22 g·L-1MS+30 g·L-1蔗糖+8 g·L-1琼脂粉)5 d后,切取小苗的子叶柄(去除生长点)和下胚轴(0.2~0.4 cm)作为外植体,在MS2预培养基(4.43 g·L-1MS+30 g·L-1蔗糖+8 g·L-1琼脂粉+1 mg·L-16-BA+1 mg·L-12,4-D)中预培养3 d后进行试验.
1.3 方法
将外植体(子叶柄和下胚轴)分别转移至含不同浓度(0、10、20、30、40、50和100 mg·L-1)Kan或Spe的MS3分化培养基(4.43 g·L-1MS+30 g·L-1蔗糖+8 g·L-1琼脂粉+3.5 mg·L-16-BA+5 mg·L-1AgNO3)[18]上培养,25~33个外植体为一个处理,共设3次重复.试验温度25 ℃,相对湿度60%~70%,光暗比16 h∶8 h,光照度2 000 lx.分化培养20 d(10 d继代一次)后,称量外植体上的愈伤鲜重(子叶柄愈伤鲜重为切除原子叶部分的鲜重),并记录外植体上再生芽数及其白化芽数.
1.4 数据分析
将外植体的再生芽率和再生芽白化率做平方根的反正炫(arcsin)转换后再进行分析.采用SPSS 22.0软件对所有数据进行单因素方差分析,用Duncan′s法进行多重比较(P=0.05).
外植体再生芽率/%=(生芽的外植体数/总外植体数)×100;单个外植体再生芽数=外植体再生芽总数/生芽的外植体数;再生芽白化率/%=(再生的白化芽数/外植体再生芽总数)×100.
2 结果与分析
2.1 Kan/Spe对外植体愈伤鲜重的影响
由表1可知,子叶柄在含不同浓度Kan培养基中的愈伤鲜重差异显著(F=51.315,df1,2=6,14,P<0.05),愈伤鲜重随着Kan浓度的升高而下降,低浓度Kan(0~20 mg·L-1)中的愈伤鲜重为255.0~292.4 mg,显著高于其他处理组(10.2~160.3 mg)(表1).子叶柄在不同浓度Spe下的愈伤鲜重差异不显著(F=2.036,df1,2=6,14,P=0.128),为178.7~255.0 mg,但随着Spe浓度的升高愈伤鲜重呈下降的趋势(表1).
下胚轴在含不同浓度Kan培养基中的愈伤鲜重差异显著(F=74.101,df1,2=6,14,P<0.05),变化趋势与子叶柄一致,低浓度(0~10 mg·L-1)中的愈伤鲜重为100.6~114.8 mg,显著高于其他处理组(15.3~62.5 mg)(表1).下胚轴在不同浓度Spe下的愈伤鲜重差异也显著(F=12.817,df1,2=6,14,P<0.05),0 mg·L-1Spe下的愈伤鲜重显著高于其他处理组(30.7~66.8 mg)(表1).这表明外植体愈伤鲜重随着Kan/Spe浓度的升高而降低,其中,低于100 mg·L-1的Spe对子叶柄的愈伤鲜重影响不显著.
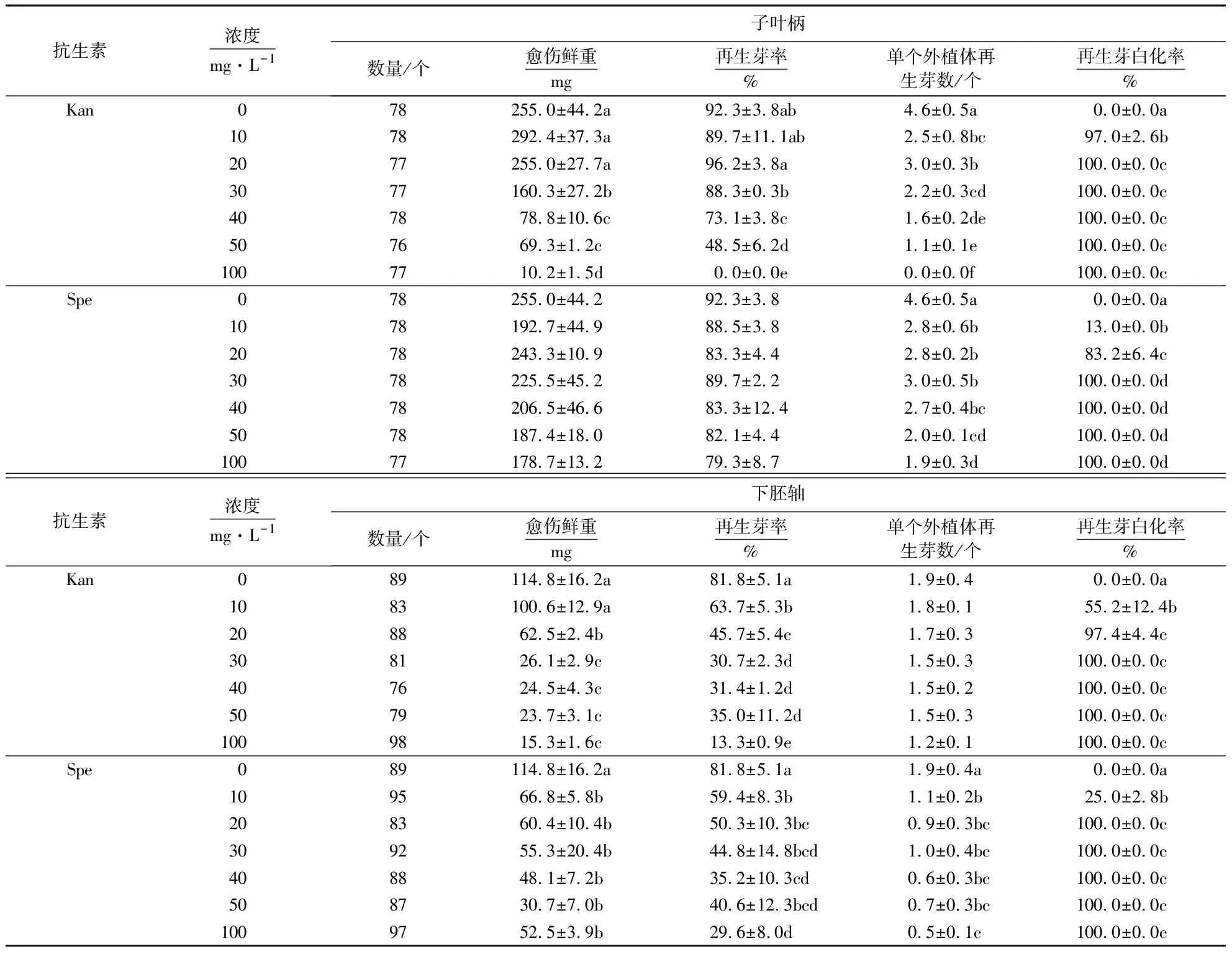
表1 不同浓度Kan/Spe中的外植体愈伤鲜重、再生芽率、单个外植体再生芽数及再生芽白化率1)Table 1 Fresh weight of callus, rate of regenerated shoots, number of regenerated shoots and albino rate of regenerated shoots from explants at different concentrations of Kan/Spe
1)同列数据后附不同字母者表示差异显著(P<0.05),附相同字母或无字母者表示差异不显著(P≥0.05).
2.2 Kan/Spe对外植体再生芽率的影响
子叶柄在不同浓度Kan中的再生芽率差异显著(F=79.671,df1,2=6,14,P<0.05),再生芽率随着Kan浓度的升高而下降,低浓度Kan(0~30 mg·L-1)下的再生芽率为88.3%~96.2%,显著高于其他处理组(0.0%~73.1%)(表1).但是,子叶柄在不同浓度Spe下的再生芽率差异不显著(F=1.642,df1,2=6,14,P=0.170),为79.3%~92.3%,但具有随着Spe浓度的升高而降低的趋势(表1).
下胚轴在不同浓度Kan中的再生芽率差异显著(F=52.298,df1,2=6,14,P<0.05),变化趋势与子叶柄一致,0 mg·L-1Kan中的再生芽率为81.8%,显著高于其他处理组(13.3%~63.7%)(表1).下胚轴在不同浓度Spe下的再生芽率差异也显著(F=9.011,df1,2=6,14,P<0.05),再生芽率随着Spe浓度的升高而下降,0 mg·L-1Spe下的再生芽率显著高于其他处理组(29.6%~59.4%)(表1).这表明外植体再生芽率随着Kan/Spe浓度的升高而降低,其中,低于100 mg·L-1的Spe对子叶柄的再生芽率影响不显著,同时,子叶柄在100 mg·L-1Kan下无法再生芽.
2.3 Kan/Spe对单个外植体再生芽数的影响
不同浓度Kan中的单个子叶柄再生芽数差异显著(F=40.337,df1,2=6,14,P<0.05),单个子叶柄再生芽数随着Kan浓度的升高而下降,0 mg·L-1Kan中的单个子叶柄平均再生4.6个芽,显著高于其他处理组(0.0~3.0个)(表1).不同浓度Spe下的单个子叶柄再生芽数差异显著(F=14.449,df1,2=6,14,P<0.05),单个子叶柄再生芽数随着Spe浓度的升高而减少,0 mg·L-1Spe下的单个子叶柄再生芽数显著高于其他处理组(1.9~3.0个)(表1).
不同浓度Kan中的单个下胚轴再生芽数差异不显著(F=2.513,df1,2=6,14,P=0.073),平均再生1.2~1.9个芽,但变化趋势与单个子叶柄一致(表1).不同浓度Spe下的单个下胚轴再生芽数差异显著(F=14.449,df1,2=6,14,P<0.05),0 mg·L-1Spe下的单个下胚轴平均再生1.9个芽,显著高于其他处理组(0.5~1.1个)(表1).这表明单个外植体再生芽数随着Kan/Spe浓度的升高而降低,其中,低于100 mg·L-1的Kan对单个下胚轴的再生芽数影响不显著.
2.4 Kan/Spe对外植体再生芽白化率的影响
子叶柄在不同浓度Kan中的再生芽白化率差异显著(F=472.215,df1,2=6,14,P<0.05),再生芽白化率随着Kan浓度的升高而升高,0 mg·L-1Kan中的再生芽白化率为0.0%,当浓度高于20 mg·L-1时,子叶柄的再生芽白化率均为100.0%,这表明20 mg·L-1Kan可完全干扰子叶柄再生芽的正常生长,使其叶片白化(表1、图1).子叶柄在不同浓度Spe下的再生芽白化率差异显著(F=220.237,df1,2=6,14,P<0.05),再生芽白化率随着Spe浓度的升高而升高,当浓度高于30 mg·L-1时,其再生芽白化率为100.0%,这表明30 mg·L-1Spe可以完全干扰子叶柄再生芽的生长(表1、图2).

A-G分别表示子叶柄在含0、10、20、30、40、50和100 mg·L-1 Kan培养基中的生长状况;H-N分别表示下胚轴在含0、10、20、30、40、50和100 mg·L-1 Kan培养基中的生长状况.图1 外植体在不同浓度Kan中的愈伤和再生芽生长情况Fig.1 Growth of callus and regenerated shoots of cotyledon petioles or hypocotyls at different concentrations of Kan
下胚轴在不同浓度Kan中的再生芽白化率差异显著(F=182.216,df1,2=6,14,P<0.05),变化趋势与子叶柄一致,0 mg·L-1Kan中的再生芽白化率为0.0%,当浓度高于30 mg·L-1时,下胚轴的再生芽白化率均为100.0%,这表明30 mg·L-1Kan对下胚轴再生芽的干扰明显,可以完全使其叶片白化(表1、图1).下胚轴在不同浓度Spe下的再生芽白化率差异显著(F=8 770.424,df1,2=6,14,P<0.05),变化趋势与子叶柄一致,当Spe浓度高于20 mg·L-1时,其再生芽白化率均为100.0%,这表明20 mg·L-1Spe对下胚轴再生芽的干扰明显,可以使再生芽叶片完全白化(表1、图2).

A-G分别表示子叶柄在含0、10、20、30、40、50和100 mg·L-1 Spe培养基中的生长状况;H-N分别表示下胚轴在含0、10、20、30、40、50和100 mg·L-1 Spe培养基中的生长状况.图2 外植体在不同浓度Spe中的愈伤和再生芽生长情况Fig.2 Growth of callus and regenerated shoots of cotyledon petioles or hypocotyls at different concentrations of Spe
3 讨论
本试验中的外植体(子叶柄和下胚轴)在不含抗生素的分化培养基中培养后,其愈伤鲜重(255.0和114.8 mg)、再生芽率(92.3%和81.8%)、单个外植体再生芽数(4.6和1.9个)均达到了相关报道的最优效果[9,19],这表明试验中使用的外植体再生芽体系较好,可以满足试验需求.子叶柄和下胚轴的愈伤鲜重、再生芽率和单个外植体再生芽数均随着Kan或Spe浓度的升高而降低,表明从这3个方面考虑时,应尽量选择低浓度抗生素;而子叶柄和下胚轴的再生芽白化率均随着Kan或Spe浓度的升高而上升,子叶柄在含浓度高于20 mg·L-1Kan或30 mg·L-1Spe培养基中的再生芽白化率为100%,下胚轴在含浓度高于30 mg·L-1Kan或20 mg·L-1Spe培养基中的再生芽白化率为100%.因此,20 mg·L-1Kan或30 mg·L-1Spe应作为以子叶柄为外植体的基因转化体系中抗生素的最高浓度;30 mg·L-1Kan或20 mg·L-1Spe应作为以下胚轴为外植体的基因转化体系中抗生素的最高浓度.本研究筛选出的以子叶柄为外植体的最适Kan浓度与黄昌蓉[20]的报道结果相似;但与林呐等[8]的报道结果存在差异,其认为子叶柄再生芽的最适Kan浓度应低于60 mg·L-1,这可能与不同油菜品种对Kan的敏感性存在差异有关.
从试验结果可知,油菜外植体对Kan和Spe的敏感性差异较大.例如:子叶柄在100 mg·L-1Kan中的愈伤鲜重和再生芽率分别为10.2 mg和0.0%,而在相同浓度Spe中的愈伤鲜重和再生芽率分别为178.7 mg和79.3%,这表明抗生素Kan对外植体的毒性强于Spe;外植体在100 mg·L-1Kan或Spe中的再生芽白化率均达到了100%,这表明在油菜基因转化抗性筛选中抗生素Kan和Spe的筛选效果相同.因此,在基因转化抗性筛选时,应优先选择以Spe为抗生素筛选的相应标记基因,这与Schröder et al[17]的报道相一致.Oreifig et al[10]也报道了Spe对水稻外植体再生芽的毒性比其他2种抗生素(潮霉素和草铵膦)更弱,且以Spe为抗生素筛选获得的转基因植株数是使用其他抗生素的2~3倍.
本研究基于抗生素Kan/Spe对油菜外植体再生芽生长的影响,筛选出其在基因转化中的最适浓度,但有关其转化效率仍然需要进一步研究;同时,不同的作物或同一作物不同品种对Kan/Spe的敏感性可能存在差异,本研究筛选出的油菜基因转化最适Kan/Spe浓度是否适合于其他作物或其他油菜品种仍需要进一步验证.

