维生素D辅助多西他赛化疗对前列腺癌患者疗效及安全性的Meta分析
谢英伟,金世鹏,刘 丹,闫 伟,王 伟,平 浩,刘跃新
(首都医科大学附属北京同仁医院泌尿外科,100730 北京)
前列腺癌是男性泌尿生殖系统最常见的肿瘤之一。近年来我国前列腺癌的发病率及死亡率呈上升趋势,且增长比欧美发达国家更为迅速[1-2]。1980年,法国学者发现前列腺癌患者血清钙离子浓度明显低于对照组,指出维生素D在前列腺癌发病中可能起作用[3]。这个假设在以后的多项研究中得到证实[4-6]。近年来几项临床试验试图研究高剂量维生素D给药对前列腺癌的影响,但结果并不一致[7-9]。本研究对已经发表的有关前列腺癌患者采用维生素D辅助多西他赛化疗的临床研究进行荟萃分析,以量化维生素D辅助化疗对以下因素的影响:①血清前列腺特异性抗原(prostate specific antigen,PSA)水平;②前列腺癌的死亡率。 此外,我们还分析了维生素D给药后出现的毒性和不良事件。
1 资料与方法
1.1 数据来源及搜索策略计算机检索配合手工系统检索,截至2019年3月。英文文献在Cochrane图书馆、PubMed、EMBASE、EBSCO和Elsiver、OVID、Springer、Blackwell、Wiley中检索。中文文献在中国生物医学文献数据库(CBMdisc),中国全文数据库、万方数据库中检索。
英文检索词:vitamin D、ergocalciferols、cholecalciferol、calcitriol、calcifediol、25-hydroxyvitamin D2、25-hydroxyvitamin D、23-difluorovitamin D3、25(OH)D、25-OH vitamin D、1,25(OH)(2)D、1,25(OH)D、vitamin D3、vitamin D2、docetaxel、prostate、prostatic neoplasms、prostatic cancer、cancer of prostate、prostate neoplasm、prostate cancer、prostate carcinoma。中文检索词:维生素D、麦角钙化醇、胆钙化醇、骨化三醇、骨化二醇、25-羟基维生素D2、25-羟基维生素D、25-OH维生素D、25-羟基维生素D、维生素D3、多西他赛、多西紫杉醇、前列腺、前列腺肿瘤、前列腺癌。
1.2 文献筛选纳入标准:研究类型为随机对照试验(randomized controlled trial,RCT),文献报道了前列腺癌的病死率、PSA应答率及不良反应。受试对象均明确诊断为转移性去势抵抗性前列腺癌;随机接受安慰剂或维生素D治疗;患者性别、年龄、国籍、种族不限;维生素D和安慰剂的剂量、疗程、给药途径不限。
排除标准:①重复报道的文献;②数据不准确;③相关信息少的文献。
1.3 文献质量评价采用Cochrane Collaboration风险偏倚评估工具对临床试验的质量进行评估[10]。从5个领域(随机序列生成,分配隐藏,结局评价盲法,结果数据的完整性,选择性报告研究结果)判断研究的质量。评价者将每项研究评定为低、高或不明确的偏倚风险。>3个领域的低风险研究为低风险偏倚,而≤2个领域的低风险研究为高风险偏倚[10]。文献质量评价由2位医生分别进行。
1.4 数据收集及分析根据样本量的大小以及PSA应答(与基线相比下降超过50%)的患者数量,计算PSA应答比例(事件率)。对于随机对照临床试验,采用干预组和对照组的有效率计算风险比,并采用风险比的自然对数及其相应的SE进行荟萃分析。DerSimonian-Laird随机效应模型用于汇总所有荟萃分析中的效应估计值。使用Cochran的Q检验和I2评估研究之间的统计异质性[11]。采用STATA12.0软件对纳入文献进行Meta分析。
绘出Meta分析的森林图,根据异质性检验,若I2<50%且P>0.1,采用固定效应模型进行分析;若I2>50%且P<0.1,采用随机效应模型进行分析;若亚组间各指标异质性过大或指标无法合并,则采用描述性分析。分类变量关系采用相对危险度(relative risk,RR)及其95%置信区间(confidence interval,CI)进行分析。对于计数资料使用样本量作为权重的衡量依据,样本量越大,权重越大。采用Egger’s检验与Begg’s检验分析评估发表性偏倚。P<0.05为差异具有统计学意义。
2 结 果
2.1 检索结果文献检索到1 391个可能相关的论文。通过对标题及摘要筛选后,选择了38篇可能相关的论文。对38篇论文全文进行评估,14项研究符合标准。我们选择其中的前瞻性随机对照试验,共3项[12-14]研究符合(图1)。样本量范围从70到953。试验组的用药为维生素D+多西他赛,对照组为安慰剂+多西他赛。纳入文献的基本情况见表1。
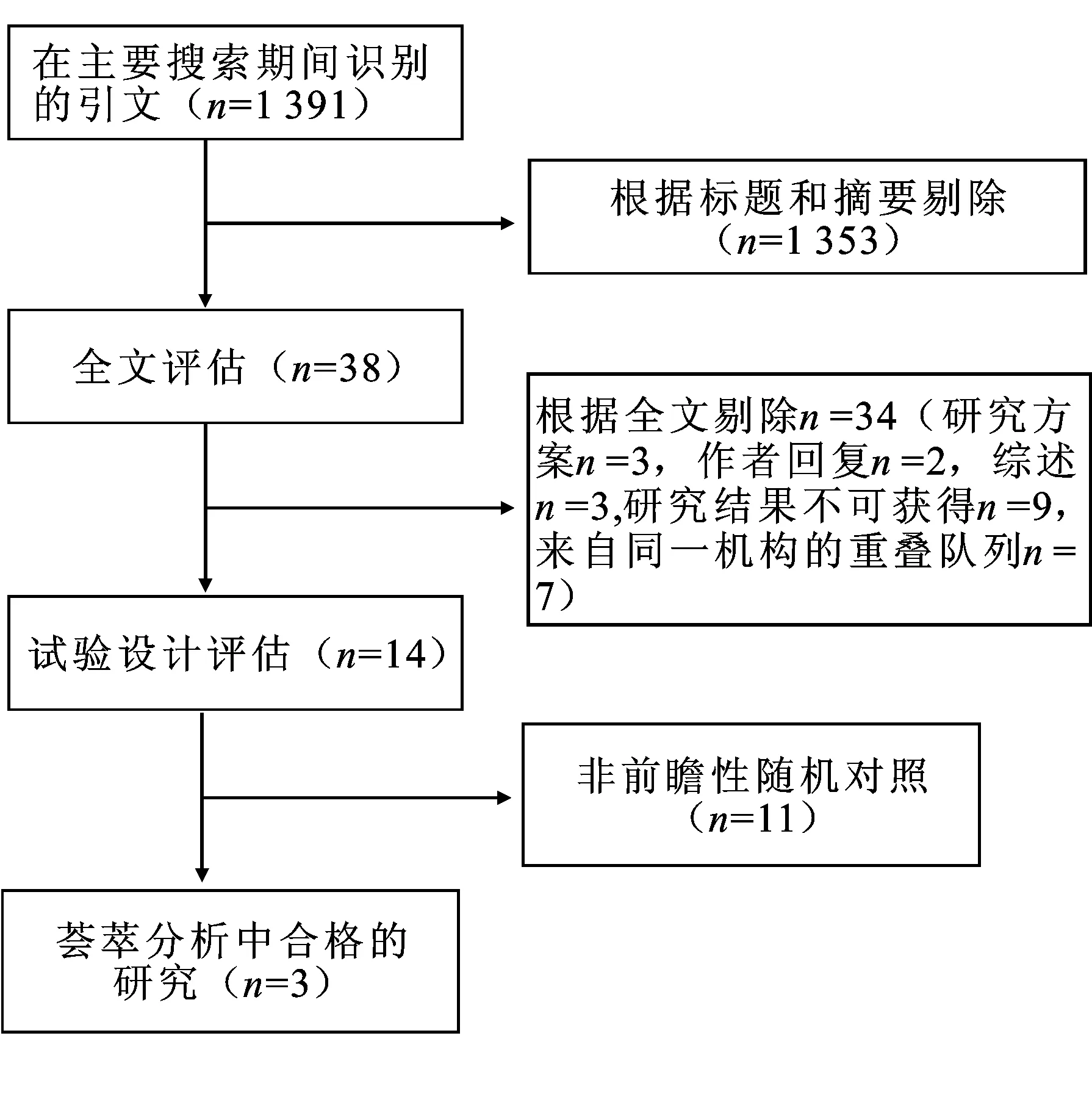
图1 文献筛选的流程图
表1 纳入发表的RCT资料相关信息
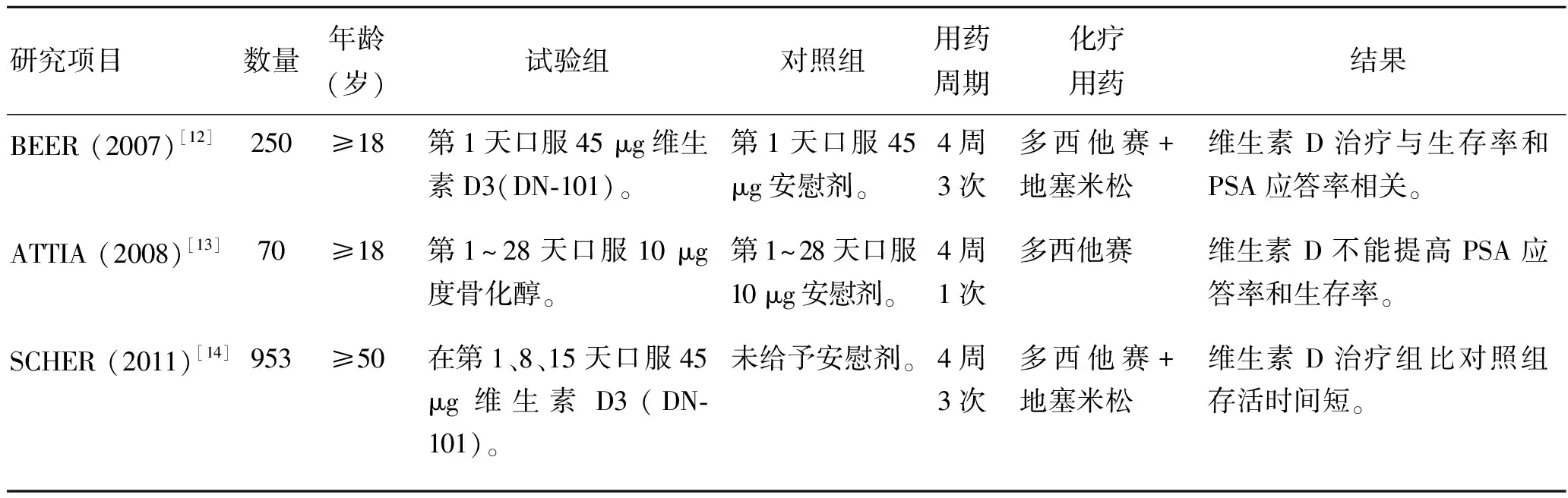
研究项目数量年龄(岁)试验组对照组用药周期化疗用药结果BEER (2007)[12]250≥18第1天口服45 μg维生素D3(DN-101)。第1天口服45 μg安慰剂。4周3次 多西他赛+地塞米松维生素D治疗与生存率和PSA应答率相关。ATTIA (2008)[13]70≥18第1~28天口服10 μg度骨化醇。第1~28天口服10 μg安慰剂。4周1次多西他赛维生素D不能提高PSA应答率和生存率。SCHER (2011)[14]953≥50在第1、8、15天口服45 μg维生素D3(DN-101)。未给予安慰剂。4周3次多西他赛+地塞米松维生素D治疗组比对照组存活时间短。
2.2 风险偏倚纳入研究的风险偏倚,根据Cochrane风险偏倚评估工具评估纳入研究的治疗[12-14]。所有研究均具有较低的风险偏倚(表2)。
表2 Cochrane风险偏倚评估
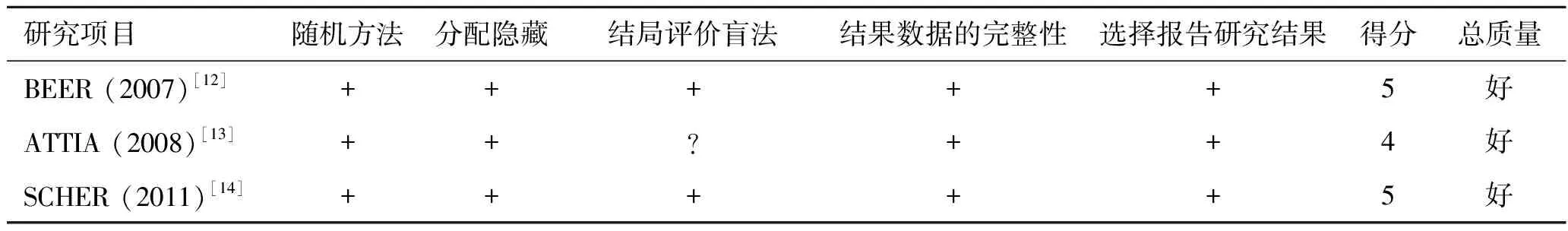
研究项目随机方法分配隐藏结局评价盲法结果数据的完整性选择报告研究结果得分总质量BEER (2007)[12]+++++5好ATTIA (2008)[13]++?++4好SCHER (2011)[14]+++++5好
+:低风险;-:高风险;?:未知。
2.3Meta分析
2.3.1PSA应答率分析 2项临床试验[12-13]将PSA应答率纳入到结果评价中。313例受试者中171例患者出现PSA应答,其中试验组93例,对照组78例。异质性分析:P=0.93,I2=0%;故认为纳入文献同质,用固定效应模型进行RR的合并。结果显示接受维生素D补充的患者与接受安慰剂的患者的PSA应答率无显著差异(RR=1.21,95%CI:0.99~1.48;P=0.06)(图2)。
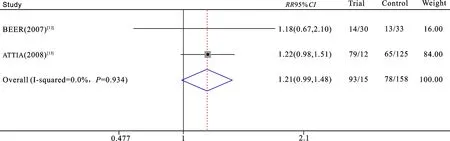
图2 维生素D是否辅助多西他赛化疗的前列腺癌患者PSA应答率比较森林图
2.3.2死亡率分析 3项临床研究都评估了维生素D辅助多西他赛化疗对前列腺癌患者死亡率的影响,1 273例受试者中477例死亡,其中试验组253例,对照组224例。异质性分析:P=0.02,I2=73%;故认为纳入文献不同质,用随机效应模型进行RR的合并。结果显示接受维生素D补充的患者与接受安慰剂的患者总死亡率无显著性差异(RR=1.05,95%CI:0.81~1.37;P=0.71)(图3)。然而,当我们对三项临床研究的化疗方案及周期进行评估后,剔除了ATTIA等[13]的研究,并重新进行异质性分析:P=0.34,I2=70%;故认为纳入文献同质,用固定效应模型进行RR的合并。结果显示对剩下的两项临床试验的分析[12,14]表明补充维生素D可使死亡风险增加24%(RR=1.24,95%CI:1.06~1.45;P=0.009)(图4)。
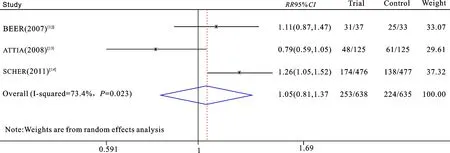
图3 3篇原始文献分析死亡率比较森林图
2.3.3毒性分析 3项临床试验都报道了与维生素D补充可能相关的副作用。我们对副作用进行了风险比的荟萃分析。虽然维生素D辅助多西他赛组和对照组的副作用总体相似,但是我们的分析显示与安慰剂组相比,维生素D辅助多西他赛组的恶心和味觉丧失更严重(表3)。
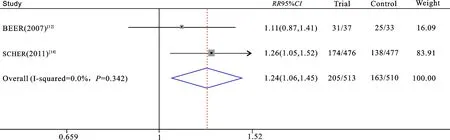
图4 2篇原始文献分析维生素D是否辅助多西他赛化疗的前列腺癌患者死亡率比较森林图
表3 3项临床试验副作用的荟萃分析
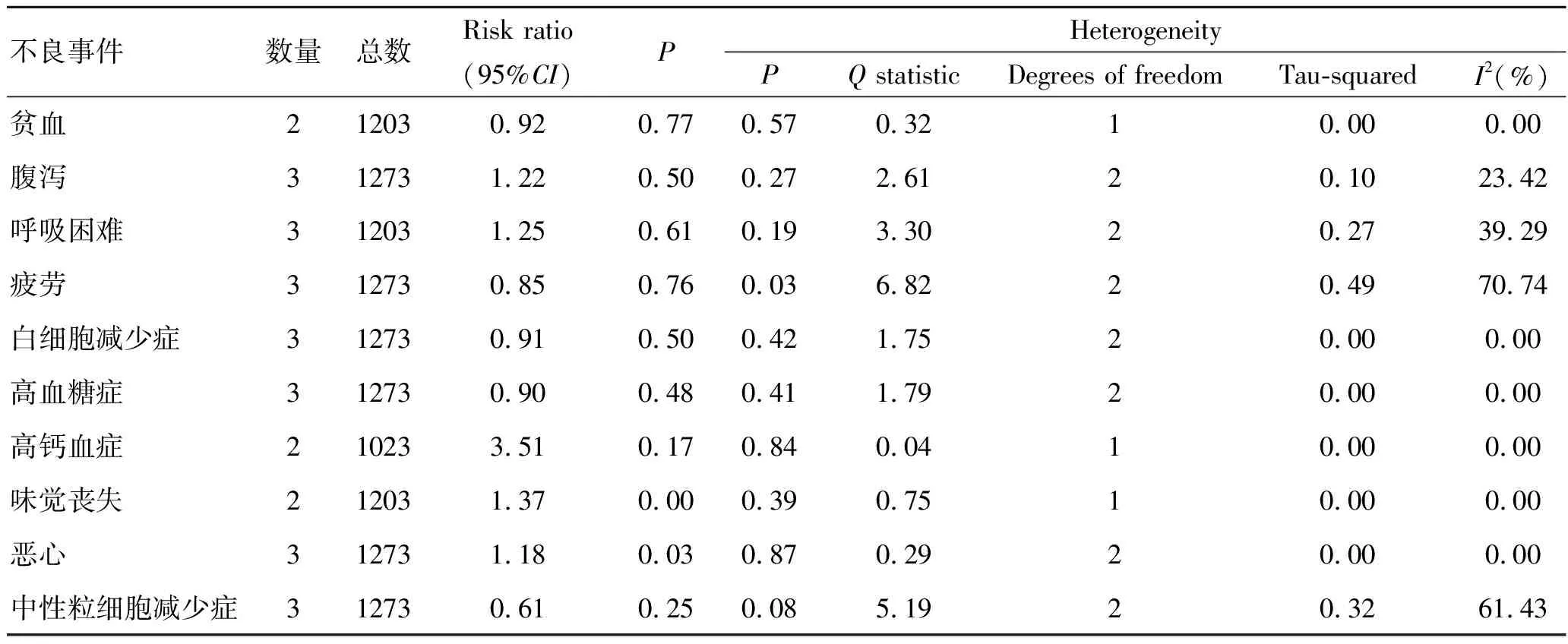
不良事件数量总数Risk ratio(95%CI)PHeterogeneityPQ statisticDegrees of freedomTau-squaredI2 (%)贫血212030.920.770.570.3210.000.00腹泻312731.220.500.272.6120.1023.42呼吸困难312031.250.610.193.3020.2739.29疲劳312730.850.760.036.8220.4970.74白细胞减少症312730.910.500.421.7520.000.00高血糖症312730.900.480.411.7920.000.00高钙血症210233.510.170.840.0410.000.00味觉丧失212031.370.000.390.7510.000.00恶心312731.180.030.870.2920.000.00中性粒细胞减少症312730.610.250.085.1920.3261.43
2.3.4发表偏倚 3项随机对照试验患者的死亡率分析(Egger检验P=0.201;Begg检验P=0.296),提示发表偏倚可能性小。
3 讨 论
我国PSA筛查存在地区差异,高危进展性及转移性前列腺癌(metastatic prostate cancer,mPC)患者所占比例较高[15-16]。从疾病发展进程上来看,mPC患者初始时大多对于激素治疗敏感,属于转移性激素敏感性前列腺癌,接受雄激素剥夺治疗有效,但随着疾病进一步进展,多数将转变为转移性去势抵抗性前列腺癌[17]。目前专家共识多西他赛作为转移性去势抵抗性前列腺癌患者的一线治疗药物[18]。
维生素D为固醇类衍生物。目前越来越多的证据表明,维生素D通过减少细胞增殖、侵袭和血管生成以及诱导细胞凋亡和细胞分化,对各种癌症的发生和发展产生抑制作用[19-21]。生态学研究表明,阳光照射较充足且维生素D水平较高的个体癌症的发病率和死亡率较低[22-23]。SHUI等[24]在一项前瞻性研究中提出血浆25-羟基维生素D水平与前列腺癌致死性风险降低相关,而在GILBERT等[25]的研究中未发现这种关联的证据。尽管如此,MEYER等[26]在一项研究中,通过对2 106例试验组和2 106例对照组患者进行观察发现25-羟基维生素D浓度增加与前列腺癌风险(RR=1.15,95%CI=1.04~1.27)呈正相关。TUOHIMAA等[27]研究报道血浆中高水平和低水平的维生素D都与前列腺癌高风险相关。因此,他们认为25-羟基维生素D与前列腺癌之间的关联很可能是非线性的。本研究对纳入的3项随机对照试验进行死亡率分析,并未发现维生素D的添加会增加患者的死亡率,但当我们剔除引起明显异质性一项研究[13]之后,对剩余两项研究[12,14]重新进行荟萃分析发现,维生素D辅助化疗增加了患者的死亡率。一个合理解释机制是维生素D补充剂增加胰岛素样生长因子(insulin-like growth-1,IGF-1)浓度,这与IGF-1可能增加前列腺癌风险的假设一致。
在一项大型临床试验中,研究中认为维生素D辅助多西他赛化疗可以提高抗肿瘤的疗效[12]。他们认为维生素D通过抵消多西他赛引起的胃肠毒性使患者获益,但这一假设需要确凿的证据。维生素D降低毒性的机制包括:对细胞增殖、基因表达、信号通路、细胞分化、凋亡、自噬、抗氧化防御、DNA修复、前列腺素合成和代谢、血管生成的影响和提高免疫反应[28]。最近基于微阵列数据分析的结果表明,维生素D通过上调前列腺素分解代谢酶15-前列腺素脱氢酶(PGDH)和下调前列腺素合成酶环氧合酶-2(COX-2)的表达抑制了前列腺素在前列腺癌细胞生长中的作用[29-31]。但是我们的研究结果不能证明这些机制作用在前列腺癌患者身上。
我们的研究结果表明,维生素D辅助多西他赛化疗适度改善了没有钙限制饮食患者的PSA应答率。有研究通过对12项前瞻性研究的荟萃分析得出结论:乳制品和钙摄入量与前列腺癌的风险直接相关[32]。高钙摄入通过抑制维生素D的生物活性代谢物导致前列腺癌的风险增加[33]。因此,我们在解释结果时,应考虑存在的一些局限性。其中包括研究没有报告基线和干预后受试者的维生素D状况。还有就是维生素D缺乏患者与正常患者补充维生素D的效果可能不同。
综上所述,在这项荟萃分析中我们发现维生素D辅助多西他赛化疗并没有使前列腺癌患者受益。根据我们的结果,不建议前列腺癌化疗的患者使用维生素D来辅助化疗。