紫丁香花精油的抗氧化和抗肿瘤活性研究
胡建燃 李平 铁军 金山
(长治学院,长治 046011)
紫丁香(Syringa oblataLindl.)为木樨科(Oleace)丁香属(Syringa)植物,落叶灌木或小乔木,在我国从西南到东北均有分布[1-2]。紫丁香花期较长,花淡紫色或紫红色,圆锥花絮,气味芳香浓郁。紫丁香不仅作为绿化和观赏植物,而且具有较高的药用价值和经济价值,也是提炼芳香精油的优质原料[3]。
植物精油是一类从植物中提取的具有一定挥发性的油状物质,大多数具有香气或其它特异气味,组分比较复杂[4-5]。具有抗氧化、抗衰老、抗肿瘤、抗菌、消炎、防腐、解热、镇痛等作用[6-10],广泛应用于化妆品、食品、医药等领域。目前,已有文献报道了紫丁香花精油的成分组成,张文静等[11]采用SDE 法提取新鲜紫丁香花精油,用GC/MS 法,鉴定出64 种挥发性成分。孙洁雯等[12]采用固相微萃取法分别提取不同花期的紫丁香花香气成分,经GC/MS 分析,共鉴定出44 种挥发性成分,不同花期的成分在种类和含量上也有所不同。在药理活性方面,国内外学者对紫丁香叶精油已有一定研究,表明其具有抗乙型肝炎病毒[13]、抗单疱病毒性角膜炎[14]以及流行性出血性结膜炎[15]等作用。然而,针对紫丁香花精油生物活性的研究,目前鲜有报道。
活性氧自由基(Reactive oxygen species,ROS)是机体在新陈代谢过程中不断产生的。在正常的生理状态下,生物机体通过酶类与非酶类体系来维持细胞内ROS 水平的动态平衡。ROS 在不断产生及清除的过程中保持氧化-还原系统的动态平衡[16]。如果ROS 产生增多或还原系统功能丧失导致ROS 过剩,则可能损伤细胞内包括DNA、蛋白质、糖类等生物大分子,破坏其功能,诱发肿瘤等多种疾病。近年来,植物挥发性成分在抗氧化和抗肿瘤方面的作用已逐渐引起国内外学者的注意,顾仁勇等[17]的研究表明牛至、丁香、连翘、山苍子及肉桂的精油成分均具有一定的抗氧化能力;陆占国等[18]发现芜荽茎叶精油能有效清除DPPH 自由基;魏凤香等[19]证实迷迭香精油可抑制HeLa 细胞的生长,并诱导其凋亡。但是,尚未有文献报道紫丁香花精油的抗氧化和抗肿瘤作用方面的研究。本研究以水蒸气蒸馏法提取的紫丁香花蕾精油,探讨其体外抗氧化活性,并进一步分析其对胃癌细胞MGC80-3 和HGC-27 的抑制作用,为紫丁香花精油的开发利用提供依据。
1 材料与方法
1.1 材料
1.1.1 材料和试剂 紫丁香花蕾于2017 年4 月25日15:00 至16:00 间采自山西省长治市长治学院校园内(东经113.143393,北纬36.217117),由长治学院生物科学与技术系铁军教授鉴定为木犀亚科丁香族丁香属紫丁香(Syringa oblataLindl.)。
胃癌细胞系MGC80-3 和HGC-27 购自武汉博士德生物工程有限公司;培养基RPMI-1640 购自美国Gibco 公司;胎牛血清购自杭州四季青生物工程材料有限公司;3-(4,5-二甲基-2-噻唑基)-2,5-二苯基四氮唑溴化物(3-(4,5-Dimethyl-2-thiazolyl)-2,5-diphenyl-2H- tetrazolium bromide,MTT)、二甲基亚砜(Dimethyl sulfoxide,DMSO)购自美国Sigma 公司;1,1-二苯基-2-三硝基苯肼(1,1-diphenyl-2-picrylhydrazyl,DPPH)购自北京依托华茂生物科技有限公司产品;总抗氧化试剂盒和羟自由基检测试剂盒购自南京建成生物工程研究所;TUNEL 细胞凋亡检测试剂盒购自碧云天生物技术研究所。其余所用的试剂,如无水乙醇、无水甲醇、乙醚等均为分析纯,实验用水均为双蒸水。
1.1.2 仪器 RE-5ZAA 旋转蒸发器(上海亚荣生化仪器厂),KQ-250 医用超声波清洗器(昆山市超声仪器有限公司),SHB 循环水式真空泵(巩义市子华仪器有限公司),BSA 124S-CW 电子天平(赛多利斯科学仪器有限公司),BPX-82 电热恒温培养箱(上海博讯实业有限公司医疗设备厂),CO2细胞培养箱(美国热电公司),SpectraMax M2 多功能酶标仪(美谷分子仪器(上海)有限公司),XSP-6C 光学倒置显微镜(日本Olympus 公司),超净工作台(上海博讯实业有限公司),ND2000 微量分光光度计(上海市精密科学仪器有限公司)。
1.2 方法
1.2.1 紫丁香花精油的提取 将采摘的新鲜的紫丁香花挑选出未开放的花蕾,蒸馏水清洗、吸水纸吸干后,称100 g 花蕾,放入烧杯中,加入600 mL 蒸馏水浸泡6 h,然后转移至水蒸气蒸馏装置中进行提取,蒸馏4 h,收集馏出液,无水乙醚萃取,合并萃取液,加入无水硫酸钠干燥,再蒸除乙醚,即得紫丁香花精油,-20℃保存备用。提取的精油为透明淡黄色液体,气味芳香。按照如下公式计算,精油提取率为0.412%。
提取率% = 所得精油质量/ 所用花蕾质量×100%
1.2.2 紫丁香花精油抗氧化活性测定 参照文献[20]中的方法测定精油抗氧化活性。
1.2.2.1 DPPH 自由基清除能力 用无水乙醇配制0.05 mg/mL 的DPPH 溶液,4℃ 避光保存,备用。用无水乙醇配制质量浓度为0.125、0.25、0.5、1.0、2.0 和4.0 mg/mL 的精油溶液。取不同浓度的样品100 μL 和100 μL 0.05 mg/mL 的DPPH 溶 液 加 入96孔板中,混匀,在室温下避光反应 30 min,利用酶标仪测定517 nm 处的吸光值OD1,同样测定100 μL样品溶液与100 μL 无水乙醇混合液在517 nm 处的吸光值OD2,再测定100 μL DPPH 溶液与100 μL 无水乙醇混合液在517 nm 处的吸光值OD3,清除率按下式计算,并以食品工业常用的化学抗氧化剂2,6-二叔丁基对甲酚(BHT)为阳性对照,平行测定3 次。
清除率%=[1-(OD1-OD2)/OD3]× 100%
1.2.2.2 羟自由基清除能力测定 用无水乙醇配制质量浓度为0.125,0.25,0.5,1.0,2.0 和4.0 mg/mL的精油溶液,并配制同样质量浓度梯度的BHT 溶液作为阳性对照,空白对照为无水乙醇。按试剂盒说明书的步骤进行测定,羟自由基清除率计算公式如下:
清除率%=(OD对照组-OD测定组)/OD对照组×100%
根据各样品在不同浓度下对羟自由基的清除率,通过拟合计算IC50值,即清除率为50%时的样品浓度,样品的IC50值越小,其对羟自由基的清除能力越强。
1.2.2.3 总抗氧化能力测定 用无水乙醇配制4.0mg/mL 的精油溶液,取0.1 mL 样品液,按照试剂盒说明书进行总抗氧化能力(Total antioxidant capacity,T-AOC)测定。以化学抗氧化剂2,6-二叔丁基对甲酚(3,5-Di-tert-butyl-4-hydroxytoluene,BHT)作为阳性对照,测定520 nm 处的吸光值。定义:在37℃时,每分钟每毫克精油使反应体系的吸光度值每增加0.01 时,为一个总抗氧化能力单位。计算公式为:
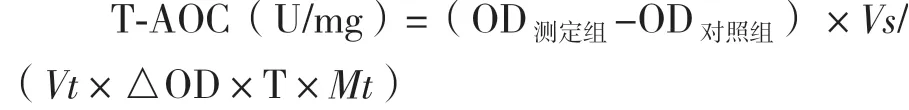
Vs为反应体积3.7 mL;Vt为参与反应的精油样品或阳性对照样品体积0.1 mL;△OD 为吸光值单位增加值0.01;T 为反应时间30 min;Mt为精油浓度或阳性对照浓度(4 mg/mL)。
1.2.3 紫丁香花精油抗肿瘤活性测定
1.2.3.1 细胞培养及药物处理 人胃癌细胞MGC80-3 采用含10% 胎牛血清的1640 培养基(100 U/mL 青-链霉素),置于37℃、5% CO2培养箱中培养。细胞贴壁生长,利用0. 25% 的胰酶-EDTA消化、传代。利用DMSO 溶解紫丁香花精油,配制成浓度为50 mg/mL 的母液,然后依次稀释成浓度为20 mg/mL、10 mg/mL、5 mg/mL、2.5 mg/mL、1.25 mg/mL、0.625 mg/mL 的工作液。取对数生长期的细胞,配制浓度为3×104个/mL 的细胞悬液,接种于96 孔细胞培养板中,每孔接种200 μL,培养12 h后,加入不同浓度的紫丁香花精油,使终浓度分别为:1.00 mg/L,0.50 mg/L,0.25mg/L,0.13 mg/L,0.06 mg/L,0.03mg/L。每组设5 个复孔,置培养箱中培养48 h。
1.2.3.2 MTT 法测定细胞活力 紫丁香花精油处理细胞48 h 后,避光加入20 μL MTT(5 mg /mL),置于细胞培养箱4 h 后,弃掉培养基,每孔加150 μL DMSO,避光振荡10 min,至结晶完全溶解。利用酶标仪测定波长490 nm 处的吸光值,按照如下公式,计算细胞生长抑制率。
细胞生长抑制率=(OD对照组-OD测定组)/OD对照组×100%
1.2.3.3 TUNEL 法检测紫丁香花精油对胃癌细胞凋亡的影响 参照文献[21]的方法,采用TUNEL 法检测紫丁香花精油对胃癌细胞凋亡的影响。具体步骤如下:将对数生长期的胃癌细胞MGC80-3 和HGC-27 分别接种于35 mm 细胞培养皿中,待汇合率达到40%左右,更换为新鲜的全培养基,并按照体积比1/20 分别加入浓度为10 mg/mL、2.5 mg/mL 和0.625 mg/mL 的紫丁香花精油工作液,使其终浓度分别达到0.5 mg/mL、0.13 mg/mL 和0.03 mg/mL;阳性对照组细胞则加入体积比1/20 的浓度为25 μg/mL 的顺铂(Diaminodichloroplatinum,DDP)溶液,使其终浓度为1.25 μg/mL;阴性对照组细胞加入等体积的DMSO。将细胞置于37℃、5% CO2培养箱中,培养48 h 后,弃去培养基,用4%多聚甲醛固定30 min。用磷酸盐缓冲液(Phosphate buffered solution,PBS)洗涤细胞1 次,然后用PBS 配制的0.3% Triton X-100在室温孵育5 min。用PBS 洗涤细胞1 次,然后用PBS 配制的0.3% H2O2在室温下处理细胞20 min。然后,按照试剂盒说明书步骤,加入生物素标记液,37℃避光孵育60 min 后,加入标记反应终止液,室温孵育10 min。PBS 洗涤3 次后,加入Streptavidin-HRP 工作液,室温孵育10 min。再用PBS 洗涤3 次后,加入DAB 显色液,室温孵育30 min。在光学显微镜下观察,随机选取5 个视野,每个视野统计300 个细胞,计算凋亡指数,公式如下:
细胞凋亡指数(AI)=凋亡细胞数/总细胞数×100%
2 结果
2.1 紫丁香花精油抗氧化活性测定
2.1.1 紫丁香花精油的DPPH 清除能力 由图1 可知,紫丁香花精油对DPPH 的清除能力与精油浓度呈明显的剂量依赖效应,随着精油浓度的增加,DPPH 清除能力随之增强。当精油浓度为4 mg/mL 时,其DPPH 清除率达到75.753%。通过计算得出,紫丁香花精油的IC50值为1.249 mg/mL,而高于化学抗氧化剂BHT 的IC50值为0.299 mg/mL,说明紫丁香花精油粗品具有一定的DPPH 清除能力,其清除能力弱于BHT。

图1 精油的DPPH 清除能力
2.1.2 紫丁香花精油的羟自由基清除能力 图2 中曲线显示,紫丁香花精油对羟自由基的清除能力呈剂量效应,清除率随着样品浓度的增加而增大,当精油浓度4.0 mg/mL 时,对羟自由基的清除能力达到77.116%。根据不同浓度下样品的羟自由基清除率,计算紫丁香花精油对羟自由基清除能力的IC50值是1.298 mg/mL,BHT 清除羟自由基的IC50值为0.268 mg/mL,表明紫丁香花精油具有一定的羟自由基清除能力,但是弱于BHT。上述结果表明在下一步的研究中,有必要进一步纯化该精油粗品的有效成分,提高其单位质量的羟自由基清除能力。

图2 精油的羟自由基清除能力
2.1.3 紫丁香花精油的总抗氧化能力 结果如图3所示,调整紫丁香花精油样品浓度至4 mg/mL,通过试剂盒检测,其T-AOC 值19.86±1.74 U/mg,高于化学抗氧化剂BHT(T-AOC 值为0.38±0.08 U/mg)。结果表明虽然紫丁香花精油对DPPH 和羟自由基的清除能力弱于BHT(图1-2),但是就总抗氧化能力而言,则显著强于BHT(P<0.01),提示紫丁香花精油具有开发为天然抗氧化剂的潜力。

图3 精油的总抗氧化能力
2.2 紫丁香花精油的抗肿瘤活性
2.2.1 紫丁香花精油抑制胃癌细胞增殖 利用不同浓度的紫丁香花精油处理胃癌细胞MGC80-3 和HGC-27 48 h 后,经MTT 实验检测其对上述细胞的抑制率。结果如图4-A 所示,当精油终浓度从0.03 mg/mL 增 大 至1.0 mg/mL 时,对MGC80-3 和HGC-27 细胞的抑制率分别从1.929%和6.144%升高至77.744%和73.886%,计算IC50分别为0.282 mg/mL和0.268 mg/mL。相比而言,阳性对照药物DDP 对MGC80-3 和HGC-27 细胞的IC50值分别3.049 μg/mL和1.238 μg/mL,如图4-B 所示,因此紫丁香花精油的抑制效应弱于经典抗癌药物DDP。上述结果表明,虽然抑制作用弱于DDP,但是紫丁香花精油能够抑制上述两种胃癌细胞的增殖,且具有浓度依赖性。
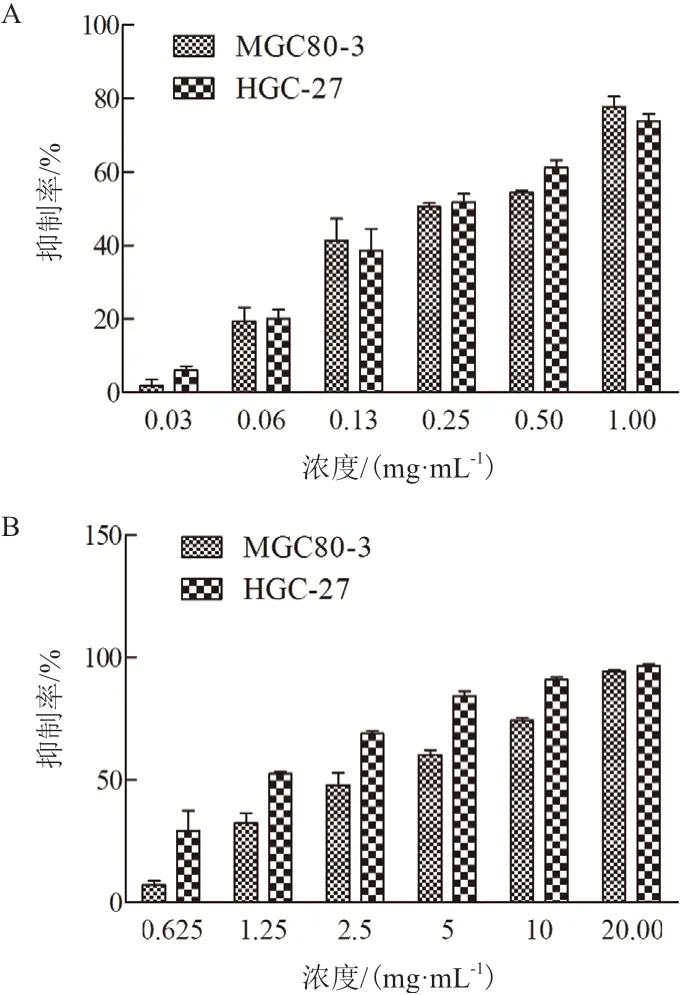
图4 紫丁香花精油和DDP 对胃癌细胞增殖的抑制效应
2.2.2 紫丁香花精油诱导胃癌细胞凋亡 用不同浓度的紫丁香花精油处理胃癌细胞MGC80-3 和HGC-27 48 h 后,通过TUNEL 法检测细胞凋亡情况,结果如图5 和图6 所示,精油终浓度越高,凋亡细胞(见图5 和图6 中B、C 和D 箭头所指)数量越多,也越接近1.25 μg/mL DDP 所导致的凋亡细胞数量。对视野下凋亡细胞进行统计,并计算凋亡指数,结果如图7 所示,与未加精油的对照组相比,上述两种细胞中凋亡细胞数量随精油浓度的提高,均显著增多(P<0.01),呈明显的量效关系。

图5 紫丁香花精油对MGC80-3 细胞凋亡的诱导作用
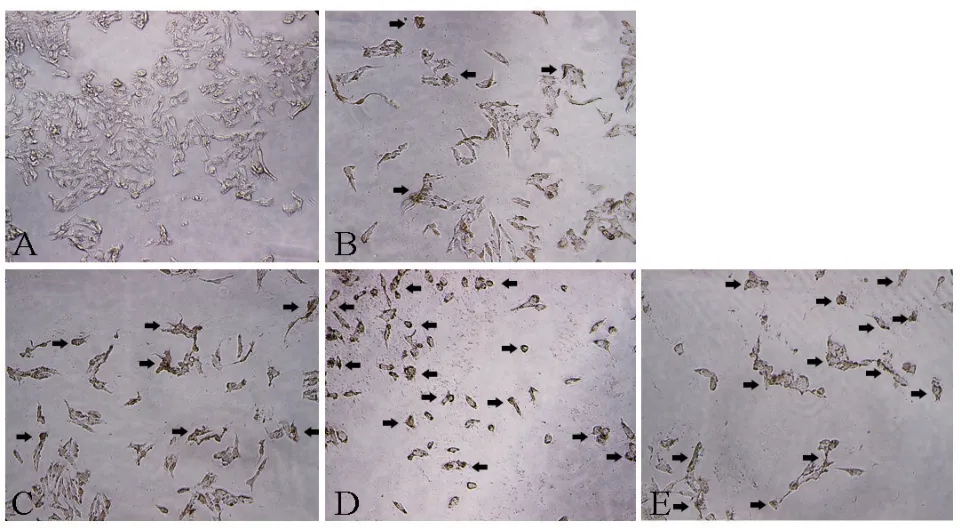
图6 紫丁香花精油对HGC-27 细胞凋亡的诱导作用
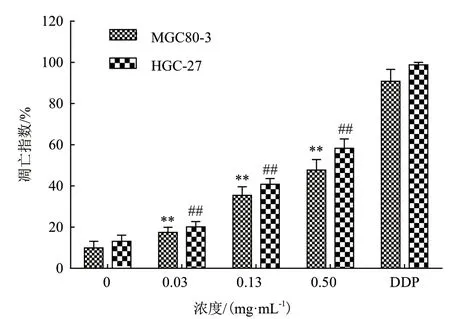
图7 紫丁香花精油诱导胃癌细胞凋亡情况的统计分析
3 讨论
精油是指具有芳香气味的植物挥发油,研究显示,植物精油具有抗菌消炎、抗氧化、抗肿瘤、健胃、解热、镇痛等多种生理活性,成为具有开发潜力的天然成分[22-26]。与化学合成的抗氧化剂相比,天然抗氧化剂具有安全、无毒、对人体健康无害等优点,而合成的抗氧化剂具有致畸、致癌作用和毒性,因此寻找天然抗氧化剂成为热点[27-29]。在抗氧化能力的评估中,总抗氧化能力(T-AOC)体现的是样本中各种抗氧化物质和抗氧化酶等构成总抗氧化水平,在生物学、医学和药学研究中常用来检测各种抗氧化物溶液的综合抗氧化活性;DPPH 自由基属于较稳定的有机物自由基,广泛应用于物质的体外抗氧化活性研究,因此分析样本对DPPH 自由基的清除能力是评估其抗氧化活性的重要方面;羟自由基是体内产生的氧自由基,能引起DNA、多糖和细胞膜的降解,杀伤红细胞,导致癌变和衰老等,研究羟自由基的清除能力有利于预防疾病和衰老[30-33]。大量研究报道[34-36],多种精油具有良好的抗氧化活性。李海亮等[37]研究表明芍药花精油且具有较好的体外抗氧化活性,对DPPH 自由基和ABTS 自由基及对亚油酸脂质过氧化具有一定的抑制作用,且抗氧化作用随着精油质量浓度的增大而增强。王健等[38]报道紫苏不同部位精油均具有一定的抗氧化能力,紫苏叶精油清除DPPH 自由基的能力较强,紫苏籽精油清除羟自由基的能力较强;权美平等[39]研究表明茜草精油可作为重要的天然抗氧化剂。本研究以不同体系评价紫丁香花精油的抗氧化活性,结果证实紫丁香花精油具有较好的总抗氧化和清除羟自由基的生物活性,但清除DPPH 的能力相对阳性对照BHT 较弱,表明紫丁香花精油在植物源天然抗氧化剂的开发方面,具有一定的应用价值。
药用植物精油的组成复杂,而且不同植物的精油化学成分均不同,主要包括萜类、芳香族、脂肪族以及含氮含硫化合物。因此,其抗肿瘤作用机制也多种多样。例如Jia 等[40]发现萜类化合物柠檬烯可以提高Bax 和细胞色素 C 的含量,降低Bcl-2 的表达和Akt 等多种蛋白的磷酸化水平,诱导人结肠癌细胞LS174T 凋亡;蔡剑等[41]的研究表明另一种萜类化合物广藿香醇可能通过增强 caspase-3 和Bax的表达,并下调 Livin 和Bcl-2 的表达,抑制人前列腺癌细胞DU145 的增殖;Jaganathan 等[42]证实芳香族化合物丁香酚能通过活化p53 和caspase-3,诱导结肠癌细胞凋亡;戴舒柳等[43]研究认为单萜类化合物柠檬醛能够通过降低细胞内谷胱甘肽含量,提高氧自由基的水平,抑制人白血病细胞K562 的增殖,并诱导其凋亡。目前,针对紫丁香有效成分在抗肿瘤方面的研究主要集中于紫丁香苷[44-45],而关于紫丁香花精油对肿瘤细胞的作用,尚未见文献报道。本研究通过传统的水蒸气蒸馏法获得紫丁香花精油粗品,利用常见的体外抗氧化能力检测系统分析精油的抗氧化活性,并通过经典的MTT 法和TUNEL 法分析其对两株胃癌细胞系增殖和凋亡的影响,结果发现紫丁香花精油能够显著抑制胃癌细胞MGC80-3 和HGC-27 的增殖(IC50值分别为0.282 mg/mL 和0.263 mg /mL),并诱导其凋亡,具备较强的抑制作用,表明紫丁香花精油在天然抗肿瘤药物开发方面具有一定的研究潜力。然而,需要更加深入的研究,揭示紫丁香花精油的成分组成及其抑制胃癌细胞的分子机制,为研制出新的天然抗氧化剂和抗肿瘤药物开辟新途径。
4 结论
利用水蒸气蒸馏法获得紫丁香花精油,体外抗氧化实验显示其具有较好的DPPH 自由基、羟自由基的清除作用,与精油浓度呈现出量效关系,并且其总抗氧化能力强于化学抗氧化剂BHT。此外,紫丁香花精油能显著抑制胃癌细胞MGC80-3 和HGC-27 增殖,并诱导其凋亡。

