稻瘟病菌精氨酸甲基转移酶基因MoHMT1 的功能分析
张文泽 张艳丽 门彦明 张玉娇 孙志昕 李文慧 鲁国东齐尧尧
(1. 临沂大学农林科学学院,临沂 276005;2. 福建农林大学植物保护学院,福州 350002)
由稻瘟病菌(Magnaporthe oryzae)引起的稻瘟病常常爆发成灾,造成水稻减产高达50%,每年造成的粮食损失足以养活六千万人口,严重威胁着全球粮食安全[1]。稻瘟病菌作为研究寄主-病原真菌相互作用、丝状真菌侵染致病机理的重要模式生物,其侵染水稻的过程经历了分生孢子的萌发、芽管的产生、附着胞和侵入栓的形成、以及侵染菌丝的生长和致病等过程[2],涉及到了复杂的蛋白质翻译后修饰。随着研究的深入,蛋白质精氨酸甲基化越来越受到研究者的青睐[3],且关于催化其发挥作用的蛋白质精氨酸甲基转移酶(Protein arginine methyltransferases,PRMTs)的研究也越来越多。
PRMTs 普遍存在于真核生物中,主要催化硫代腺苷甲硫氨酸(S-adenosylmethionine,SAM)上的甲基转移到靶蛋白精氨酸残基末的胍基上,进而调控着DNA 修复、信号转导、细胞发育以及癌症发生等过程[3-5]。根据催化形式的不同,PRMTs可以分为4 种类型:Type I 主要催化形成单甲基化(Monomethylated arginine,MMA)和非对称二甲基化(Asymmetric dimethylated arginine,ADMA);Type II 主要催化形成MMA 和对称二甲基化(Symmetric dimethylated arginine,SDMA);Type III 只 催 化 形成MMA,而Type IV 则 催 化 形 成δ-MMA[6-7]。到目前为止,报道最多的是Type I 和Type II 的PRMTs[4,6],而鉴定出的3 个Type III PRMTs 分别来自人类(human)[8]、酿酒酵母(Saccharomyces cerevisiae)[9]和布氏锥虫(Trypanosoma brucei)[10],Type IV PRMT 仅在S. cerevisiae[11]中有报道。
PRMT1 是Type I 中最主要的精氨酸甲基转移酶,在真核生物中是高度保守的。哺乳动物中对PRMT1 的研究最为透彻,研究发现人类中的PRMT1是正常胚胎、细胞周期进程、细胞移动和信号转导所必需的[4-5,12-13]。植物中对PRMT1 的研究相对较少,其中拟南芥(Arabidopsis thaliana)中初步鉴定出PRMT1 的同源蛋白是AtPRMT1a 和AtPRMT1b,这两个蛋白都定位于细胞质和细胞核中,在体外能催化RNA 甲基转移酶AtFib2、纤维蛋白和组蛋 白H4[14]。 此 外,AtPRMT1b(PRMT11) 能 与MBD7(methyl-DNA-binding protein 7)相互作用,但是AtPRMT1a和AtPRMT1b的单突变体或双突变体在长日照条件下都没有任何明显的表型[15]。水稻中PRMT1 的同源蛋白OsPRMT1 也定位于细胞质和细胞核中,且在水稻的各个组织中都能表达,其中成熟叶片中表达量最高,体外具有甲基转移酶的活性[16]。
在真菌中,酿酒酵母(S. cerevisiae)中的Hmt1p是首次报道的PRMT1 同源蛋白,该蛋白定位于细胞核中,虽然并不是酵母生长所必需的,但其催化活性却是Npl3p 和Cbp80(cap-binding protein 80)缺失突变体所必需的[17-19]。此 外Hmt1p 除甲基化组氨酸和非组氨酸蛋白外[17-18,20-22],还可以甲基化小核糖体蛋白S2(Small ribosomal protein S2,Rps2)[23]。白色念珠菌(Candida albicans)中的CaHmt1 与Hmt1p 功能类似[24]。近几年丝状真菌中的PRMT1/Hmt1p 同源蛋白的研究已取得了一些进展,例如禾谷镰刀菌(Fusarium graminearum)AMT1基因在菌丝生长、应对胁迫反应、产生毒素和侵染植物等过程中都发挥了重要的作用,且该蛋白调控着FgHrp1 的甲基化和核运输过程[25];粗糙脉孢菌(Neurospora crassa)中AMT-1基因缺失后导致菌丝伸长速率降低,并增强了对麦角固醇生物合成抑制剂伏立康唑的敏感性[26]。与此不同的是,构巢曲霉(Aspergillus nidulans)中RmtA基因缺失后并没有影响该菌的营养生长、有性孢子和无性孢子的产生,但是会导致氧胁迫条件下生长明显减慢[27]。此外,黄曲霉(Aspergillus flavus)RmtA 蛋白作为一个全局调控因子,既负调控着孢子的产生,又促进菌核的发育,正向调控着次生代谢过程,控制黄曲霉毒素和其他未知代谢物的产生[28]。
稻瘟病菌(M. oryzae)中含有4 个PRMT 基因(MoPRMT 1-4),生物信息学分析发现它们均含有保守的甲基转移酶结构域,在丝状真菌中是高度保守的[29],其中MoPRMT1 与MoPRMT2、MoPRMT3、MoPRMT4 的序列相似性分别为43%、44%和34%,表达谱分析结果表明MoPRMT1 在侵染后24 h 表达量达到最高峰,而其他阶段表达水平基本一致[29],然而该基因在稻瘟病菌侵染循环过程中发挥的具体作用尚未报道。根据真菌基因的命名规律,参照酵母中同源基因的名称,本研究将编码PRMT1 蛋白的基因MGG_04584 重新命名为MoHMT1(hnRNP arginine N-methyltransferase),并利用同源重组的基因敲除技术,分析其在稻瘟病菌生长发育和侵染致病过程中的作用,为进一步揭示稻瘟病菌MoHMT1的生物学功能及其参与的信号途径提供基础,也有利于进一步阐明稻瘟病菌的致病分子机理。
1 材料与方法
1.1 材料
稻瘟病菌菌株Ku80由美国普渡大学许金荣博士惠赠;大肠杆菌(Escherichia coli)DH5α、水稻品种CO39 均为本实验室所保存;PCR 试剂、限制性内切酶、T4 DNA 连接酶等均购于大连宝生物公司;其他常规生化试剂均为国产分析纯;引物合成(表1)及DNA 测序分析均由华大基因完成。
1.2 方法
1.2.1MoHMT1基因的敲除 根据同源重组的原理,以稻瘟病菌菌株Ku80基因组DNA 为模板,通过MoHMT1的上下游引物(表1)分别扩增其上下游片段A 和B,然后分别与潮霉素磷酸转移酶基因H 片段混合作为模板,利用SOE-PCR 技术扩增获得AH 和HB 片段,进行原生质体的转化[30]。挑选具有潮霉素抗性的转化子,利用PCR 的方法筛选基因敲除的阳性转化子。
1.2.2Mohmt1敲除突变体菌落形态观察和生长速率测定 将生长活力大致相同的野生型菌株Ku80、敲除突变体ΔMohmt1-14菌株、ΔMohmt1-19菌株和异位整合突变体Mohmt1-Ect菌株分别挑取大小相等的菌丝块,接种于淀粉酵母固体培养基(15 cm 培养皿)的中央,26℃ 倒置培养,并于接种后的3 d、5 d、7 d、9 d 测量菌落直径,第9 天对菌落进行拍照。每个样品重复3 皿,进行3 次独立实验,对数据进行单因素方差分析。
1.2.3Mohmt1敲除突变体产孢量的统计及形态观察 将野生型及突变体相关菌株接种到米糠培养基上直至菌丝长满培养皿(9 cm),然后刮去表面的气生菌丝,26℃ 开盖光照产孢2 d,用无菌水冲洗收集所有孢子。将孢子悬浮液于三层滤纸过滤后,用血球计数板对孢子数量进行统计。每个样品重复3皿,进行3 次独立实验,对数据进行单因素方差分析。
1.2.4Mohmt1敲除突变体孢子的萌发实验 将上述获得的野生型及突变体菌株的孢子悬浮液定容至浓度为1×104- 2×104个/mL,吸取12 μL 滴至Gelbond film 疏水表面上,26℃ 保湿培养,并于培养1 h、2 h、4 h、8 h、12 h 后统计孢子的萌发率。每个样品重复5 滴,在观察时间段每滴观察3 个视野,并进行3 次独立实验,对数据进行单因素方差分析。

表1 本研究所用的引物序列
1.2.5Mohmt1敲除突变体洋葱表皮侵染实验 撕取约 4 mm×4 mm 大小的洋葱表皮第3 层(从外到内)内表皮,置于每孔含有2 mL 蒸馏水的24 孔培养板孔洞内。调整野生型及突变体菌株的孢子悬浮液的浓度至4×104个/mL,吸取10 μL 孢子悬浮液滴至洋葱表皮上,26℃ 培养,分别于培养24 h 和48 h后观察侵染情况。
1.2.6Mohmt1敲除突变体活体接种实验 调整野生型及突变体菌株的孢子悬浮液浓度为1×105个/mL(含 0.02% Tween),喷雾接种于水稻品种CO39(三叶期)上,于温室内黑暗保湿处理24 h 后光照培养5 d,观察叶片的致病情况,其中叶瘟分级的具体分级标准参考 Valent 等[31]的方法。本实验独立重复3 次。
2 结果
2.1 稻瘟病菌MoHmt1敲除突变体的筛选与鉴定
为了明确MoHMT1基因的生物学功能,本研究根据同源重组的原理对MoHMT1基因进行敲除,利用潮霉素磷酸转移酶基因(HPH)重组替换MoHMT1基因完整的ORF 片段,并将潮霉素作为筛选标记获得若干候选转化子。首先利用PCR 技术对候选的转化子进行DNA 水平验证,如图1-A 所示,凡是ORF(表1MoHMT1OF/R)无阳性扩增(约632 bp)且UAH(表1MoHMT1UAF/R)有阳性扩增(约1 450 bp)的转化子即为Mohmt1敲除突变体菌株,本研究将其命名为ΔMohmt1-14和ΔMohmt1-19,而ORF 有阳性扩增而UAH 无阳性扩增的转化子即为异位整合突变体,命名为Mohmt1-Ect。
其次,为了确认敲除突变体的可靠性,本研究进一步通过RT-PCR 技术对获得的两个敲除突变体和异位整合突变体进行了验证。结果如图1-B 所示,在ΔMohmt1-14和ΔMohmt1-19两个敲除突变体中,几乎检测不到MoHMT1的表达;而阳性对照和异位整合突变体中检测到MoHMT1的表达。
2.2 MoHMT1基因的缺失导致稻瘟病菌菌丝体生长明显减慢
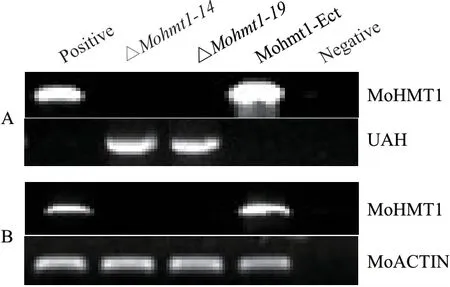
图1 Mohmt1 敲除突变体的筛选鉴定
为了明确MoHMT1基因在稻瘟病菌营养生长过程中的作用,本研究对Mohmt1相关突变体进行了分析。结果如图2 所示,在淀粉酵母培养基上,与野生型菌株Ku80 相比,ΔMohmt1-14和ΔMohmt1-19突变体菌落明显变小(图2-A),生长速率明显减慢(图2-B),且表面的气生菌丝量明显减少变薄(图2-C),而Mohmt1-Ect 则与野生型相比无明显变化。
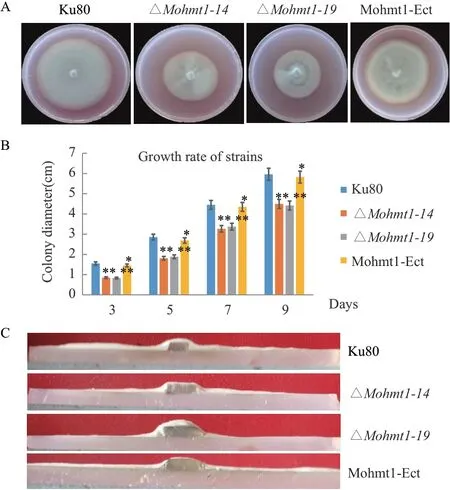
图2 Mohmt1 敲除突变体的菌落形态和生长速率
2.3 MoHMT1基因的缺失导致稻瘟病菌产孢明显减少但不影响孢子的萌发
本研究继而对Mohmt1相关突变体的产孢量和孢子萌发率进行了统计分析。结果如图3-A 所示, 与 野 生 型 菌 株Ku80 相 比,ΔMoHmt1-14和ΔMoHmt1-19的产孢量明显减少,仅为野生型的20%左右,暗示了ΔMoHmt1-14和ΔMoHmt1-19突变体在产孢量方面存在明显缺陷。然而,尽管产孢量显著下降,但是在4 h 时孢子萌发率几乎达到100%,接近野生型的水平(图3-B),说明突变体的孢子能进行正常地萌发。MoHmt1-Ect则在产孢量和孢子萌发率方面与野生型相比无明显变化。
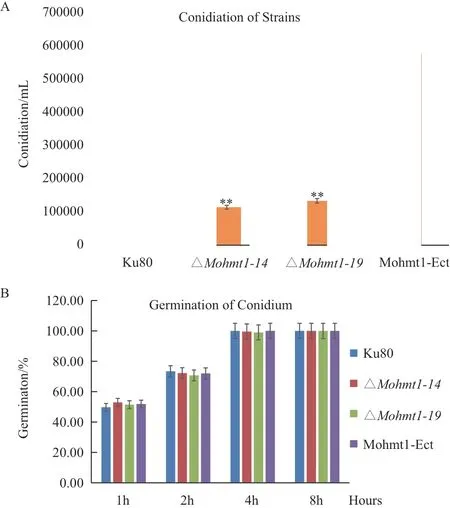
图3 Mohmt1 敲除突变体的产孢量和萌发率统计
2.4 MoHMT1基因的缺失导致对稻瘟病菌的致病性明显减弱
为了明确MoHmt1缺失突变体在稻瘟病菌侵染过程中发挥的作用,本研究首先进行了洋葱表皮侵染实验。结果如图4-A 所示,在接种到洋葱表皮48 h 后,与野生型和异位整合突变体相比,尽管Mohmt1缺失突变体产生的次生菌丝略微减少,但是能成功扩展侵入到邻近的细胞中,暗示了Mohmt1缺失突变体在疏水表面能够进行正常的侵染和扩展。
进一步将Mohmt1相关突变体的孢子悬浮液喷雾接种到水稻叶片上观察其致病性,结果如图4-B所示,野生型和异位整合突变体形成的病斑几乎连接成片,且叶片枯黄,多为4-5 级病斑,而Mohmt1缺失突变体仅仅形成零星的褐色针眼状病斑,病斑数目明显减少,多为1 级病斑,偶尔见2 级病斑,表明稻瘟病菌Mohmt1缺失突变体对水稻的致病性明显减弱。上述实验表明,MoHMT1基因缺失后尽管孢子能够正常侵入到水稻叶片并进行扩展,但是其对稻瘟病菌的致病性却明显减弱,暗示MoHMT1基因可能在稻瘟病菌的致病过程中发挥了重要的作用。
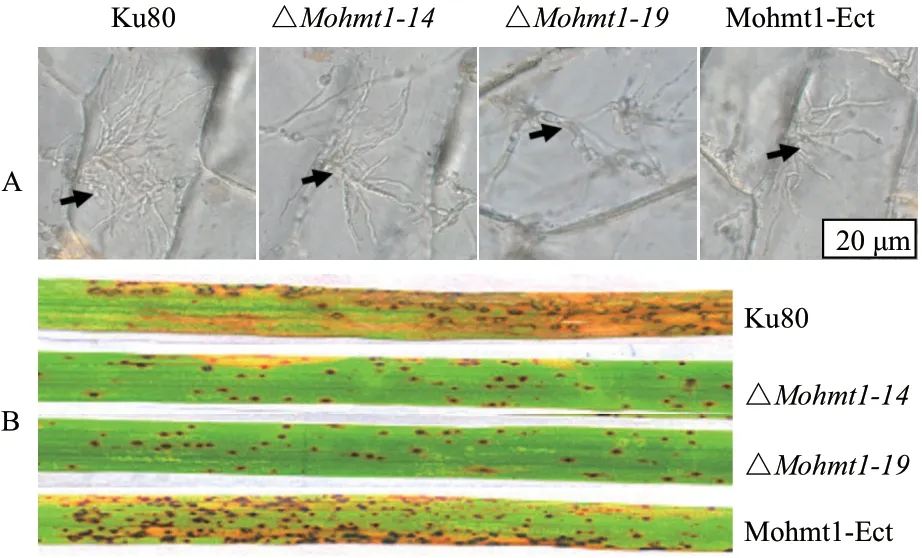
图4 Mohmt1 敲除突变体的洋葱表皮和水稻叶片侵染
3 讨论
精氨酸的甲基化是真核生物中普遍存在的蛋白质翻译后修饰,其作为转录表观调控因子在premRNA 剪接、DNA 修复、mRNA 转录、细胞信号等过程扮演了重要的角色[3],该修饰过程受到PRMTs的调控。研究表明该家族中最保守的成员PRMT1,在不同丝状真菌中的功能既有保守性又有特异性,例如,禾谷镰刀菌(F. graminearum)和黄曲霉(A.flavus)中AMT1/RmtA 参与真菌的生长发育和侵染致病过程,并调控着毒素和其他未知代谢物的产生[25,28]。而构巢曲霉(A. nidulans)中的RmtA 却并不是真菌生长发育和侵染致病所必需的[27],这与酿酒酵母(S. cerevisiae)和白色念珠菌(C. albicans)的研究结果一致[17,24]。另外,禾谷镰刀菌(F.graminearum)中RmtA基因缺失后对氧胁迫超级敏感[25],而黄曲霉(A. flavus)中RmtA基因缺失后则增强了对氧胁迫的耐受力[28]。这些研究结果为研究稻瘟病菌中MoHmt1(PRMT1 的同源蛋白)的功能指明了方向。
鉴于此,本研究根据同源重组的原理获得Mohmt1缺失突变体,并对相关突变体进行表型分析,结果发现MoHMT1缺失后减慢了菌丝生长发育减慢、孢子量降低、对水稻叶片的致病性减弱,然而其具体的调控机制尚未明确,其功能的发挥是否与其催化活性密切相关有待于进一步地研究。
在 酿 酒 酵 母(S. cerevisiae)中,Hmt1p 能 够甲基化Hrp1/Nab2/Npl3 等底物蛋白,从而促进其从细胞核中运输出来[18-19,32],而禾谷镰刀菌(F.graminearum)中AMT1仅仅是核运输FgHrp1 而不是FgNab2 所必需的[25],暗示了甲基化作用位点在不同的真菌中存在差异。因此稻瘟病中MoHmt1 的底物蛋白及其作用位点有哪些,也有待于今后进一步研究。
4 结论
从稻瘟病菌(M. oryzae)中鉴定出PRMT1 的同源蛋白MoHmt1,根据同源重组的原理获得Mohmt1缺失突变体,对其进行生物学功能分析发现,与野生型相比,Mohmt1缺失突变体的菌落明显变小,生长速率明显减慢,且表面的气生菌丝量明显减少变薄;MoHMT1的缺失也导致产孢量明显下降,仅为野生型的20%左右,但是这些孢子能够正常萌发形成附着胞,并能在洋葱表皮细胞中成功地定殖和扩展;进一步对水稻叶片进行接种发现,Mohmt1缺失突变体的病斑数量明显少于野生型,病情指数下降,致病性减弱。综上所述,MoHmt1 蛋白可能在稻瘟病菌的生长发育和致病过程中发挥了重要的作用。

