鲫鱼鱼鳞抗菌多肽的制备纯化及其抑菌活性
顾晨涛,黄 洒,王雪燕,李明岩,施永清*
(浙江工商大学食品与生物工程学院,浙江 杭州 310018)
抗菌肽(antimicrobial peptides,AMPs)是一种天然低分子质量多肽,在机体免疫系统中起着重要的作用[1-2],广泛存在于细菌、植物、软体动物、两栖类动物、鱼类、鸟类和哺乳动物等体内,其具有活性强、功能广泛、广谱杀菌等特点[3]。由于其天然的抗菌性能和较弱的细菌耐药性,是化学防腐剂、抗生素等防腐抗菌药物很好的替代品[4-5],正如乳酸链球菌素Nisin已成功作为天然食品防腐剂应用于鱼类等食品防腐保鲜领域中[6-7]。
鱼类是水生动物群的主要组成部分,其中也存在着多种抗菌肽。关于鱼类抗菌肽的相关报道很多,如Lin Weiju等[8]从石斑鱼(Epinephelus coioides)中得到抗菌肽Epinecidin-1。研究表明鱼类抗菌肽还具有独特特性,如在极高盐浓度下也能发挥作用[9],所以鱼类抗菌肽表现出良好的发展和应用前景[10-12]。
我国是鱼类养殖大国,而鱼鳞作为鱼的副产物,常被当作废弃物而丢弃,这不仅会导致环境污染,还会造成资源的大量浪费,因此提高鱼鳞综合利用率就显得尤为重要[13-14]。本研究以鲫鱼鱼鳞为原料,通过酶解法并分离纯化得到鲫鱼鱼鳞抗菌多肽,这既充分利用了废弃鱼鳞资源,使低值的鱼鳞高值化,也为以后进一步开展此类研究或以此为基础应用于食品或医药行业提供理论依据和数据基础。
1 材料与方法
1.1 材料与试剂
鲫鱼鱼鳞 杭州市海天农贸市场;LB培养基、PDA培养基 杭州微生物试剂有限公司;胃蛋白酶(1∶3 000)美国Amresco公司;透析袋 上海源叶生物科技有限公司;Sephadex G-15、Sephadex G-50 上海宝曼生物科技有限公司;纤维素DEAE-52 英国Whatman公司;宽分子质量标准蛋白Marker 日本TaKaRa公司;其他试剂均为国产分析纯。
菌种:金黄色葡萄球菌(Staphylococcus aureus)、枯草芽孢杆菌(Bacillus subtilis)、白色葡萄球菌(Staphylococcus albus)、大肠杆菌(Escherichia coli)、沙门氏菌(Salmonella choleraesuis)、副溶血性弧菌(Vibrio parahaemolyticus)、希瓦氏菌(Shewanella putrefaciens)、假单胞菌(Pseudomonas fluorescens)、黑曲霉(Aspergillus niger)、产黄青霉(Penicillium chrysogenum)、毛霉(Mucor wutungkiao),由浙江工商大学食品与生物工程学院微生物实验室提供。
1.2 仪器与设备
ZX98-1旋转蒸发仪 上海豫康科教仪器设备有限公司;YXQ-LS-18SI自控型手提式灭菌器 上海博迅医疗生物仪器股份有限公司;SW-CJ-1D单人净化工作台 浙江苏净净化设备有限公司;普通玻璃层析柱(1.6 cm×20 cm、2.6 cm×20 cm、1.6 cm×60 cm)上海沪西分析仪器厂有限公司;BT100-2J精密蠕动泵保定兰格恒流泵有限公司;HD-5电脑紫外检测仪、SBS-100数控计滴自动部分收集器 上海青浦沪西仪器厂;FD-1A-50冷冻干燥机 北京博医康实验仪器有限公司;Mini电泳仪、电泳槽、Gel Doc XR+凝胶成像系统 美国Bio-Rad公司;Spectra Max 190酶标仪美国Molecular Devices公司。
1.3 方法
1.3.1 鲫鱼鱼鳞抗菌多肽粗酶液的提取
将收集的新鲜鲫鱼鱼鳞用清水反复清洗,洗去鱼鳞表面的黏液和银屑等杂质,于40 ℃鼓风干燥箱中烘干后冷藏备用。
取5 g干燥鲫鱼鱼鳞,用剪刀将其剪碎,然后加入0.5 mol/L NaOH溶液,液料比10∶1(mL/g),磁力搅拌3 h,每1.5 h换液一次,以除去鱼鳞中的杂蛋白并使鱼鳞结构酥松,用蒸馏水清洗至中性。然后加入0.2 mol/L EDTA-2Na[15],液料比15∶1(mL/g),超声辅助脱钙2 h,以除去鱼鳞中的钙盐等矿物质,使胶原蛋白较易溶出,用蒸馏水清洗至中性[16-17]。
取预处理后的鲫鱼鱼鳞,加入10%柠檬酸溶液[18],液料比14∶1(mL/g),然后置于50 ℃恒温水浴锅中提取12 h。将提取的鱼鳞胶原蛋白溶液调节至pH 1.5左右,然后加入质量分数0.8%的胃蛋白酶,在37 ℃恒温水浴振荡2 h完成酶解[19]。酶解后将样品置于80 ℃恒温水浴锅中10 min进行灭酶处理[20]。灭酶后的样品溶液在4 ℃、4 000 r/min离心20 min,得到的上清液即为澄清鱼鳞抗菌多肽粗酶液。继续将澄清粗酶液在40 ℃旋蒸浓缩至20 mL,即4 mL/g鱼鳞,最终得到浓缩后的鲫鱼鱼鳞抗菌多肽粗酶液,测得其pH值约为1.5,-40 ℃冻藏备用。
1.3.2 抑菌活性测定
采用双层牛津杯抑菌圈法[21]。在无菌条件下,取无菌培养皿,倒入约10 mL灭菌LB培养基,静置待其凝固后,将灭菌牛津杯用无菌镊子夹出,在酒精灯外焰迅速过火,垂直放置于培养基表面。另用移液枪吸取1 mL受试菌菌悬液(1×106CFU/mL),加入到100 mL冷却至50 ℃左右的灭菌LB培养基中摇匀,制成混有受试菌的LB培养基,并取约20 mL倒入到培养皿中。静置待其凝固后,用镊子取出牛津杯,用移液枪吸取100 μL鱼鳞抗菌多肽试样加入到孔中。并添加生理盐水、等pH值的盐酸和50 μg/mL氯霉素溶液分别作为空白对照、阴性对照和阳性对照。将培养皿放入37 ℃恒温培养箱中培养24 h后,用游标卡尺十字交叉法测量抑菌圈直径大小,以此评价鲫鱼鱼鳞抗菌多肽的抑菌活性。霉菌为PDA培养基,以0.1%山梨酸钾溶液作为阳性对照,培养条件为28 ℃培养48 h,其他操作过程同细菌。实验重复3 次,测量取平均值。
1.3.3 鲫鱼鱼鳞抗菌多肽的分离纯化
1.3.3.1 透析
将浓缩后的鲫鱼鱼鳞抗菌多肽粗酶液装于截留分子质量为3 000 Da的透析袋中,以蒸馏水为透析液,置于4 ℃冰箱中透析12 h,每4 h更换一次透析液。将透析后的抗菌多肽粗酶液冷冻干燥后备用。
1.3.3.2 Sephadex G-15凝胶过滤层析
将透析后的抗菌多肽粗酶液样品经Sephadex G-15凝胶过滤层析柱对样品进行粗分离[22]。样品适当浓度溶解后取4 mL,经0.45 μm滤膜过滤,上样于经超纯水平衡后的Sephadex G-15凝胶过滤柱(1.6 cm×20 cm),用超纯水进行洗脱,流速为0.5 mL/min,自动部分收集器收集5 mL/管,用电脑紫外检测仪检测280 nm波长处吸光度并绘制洗脱曲线。收集各峰对应组分,测定其对金黄色葡萄球菌和大肠杆菌的抑菌活性,将有抑菌性的组分冷冻干燥后进行下一步分离。
1.3.3.3 Sephadex G-50凝胶过滤层析
取Sephadex G-15凝胶过滤层析后的冻干样品,经超纯水溶解成质量浓度为20 mg/mL的蛋白溶液后用0.45 μm滤膜过滤,取5 mL上样于经超纯水平衡后的Sephadex G-50凝胶过滤柱(1.6 cm×60 cm),以超纯水为流动相,控制流速0.5 mL/min。自动部分收集器每3 mL收集1 管,调整电脑紫外检测仪灵敏度,在280 nm波长处检测吸光度信号并绘制洗脱曲线。收集各洗脱峰对应组分,装入透析袋后用PEG20000浓缩[23],分别测定各峰组分对金黄色葡萄球菌和大肠杆菌的抑菌活性。收集具有较好抑菌活性的峰组分,冷冻干燥后备用。
1.3.3.4 DEAE-52阴离子交换层析
取Sephadex G-50凝胶过滤层析后的冻干蛋白样品,用0.02 mol/L、pH 6.8磷酸盐缓冲液(phosphate buffer saline,PBS)溶解,配制成蛋白质量浓度为10 mg/mL的上样液。0.22 μm滤膜过滤后,取10 mL蛋白液加样于经0.02 mol/L、pH 6.8的PBS平衡后的DEAE-52阴离子交换柱(2.6 cm×20 cm),先用PBS充分洗脱掉未被吸附的蛋白,然后用含0.1~0.5 mol/L NaCl的PBS分段梯度洗脱,流速为1 mL/min,自动部分收集器收集5 mL/管,调整紫外检测仪灵敏度,检测280 nm波长处吸光度信号,并绘制出相应洗脱曲线[24]。收集各洗脱峰对应的蛋白液,装入透析袋后用PEG20000浓缩,分别测定各组分对金黄色葡萄球菌和大肠杆菌的抑菌活性,将有抑菌活性的峰组分冷冻干燥后置于干燥器中保存。
1.3.4 鲫鱼鱼鳞抗菌多肽SDS-PAGE分析
将纯化后鲫鱼鱼鳞抗菌多肽和标准蛋白质Marker利用十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(sodium dodecyl sulfate polyacrylamide gel electrophoresis,SDS-PAGE)分析[25]。采用分离胶15%,浓缩胶5%。标准蛋白质Marker上样量5 μL,纯化后的蛋白样品上样量10 μL。加入电泳缓冲液后,调节初始电压80 V开始电泳,当溴酚蓝染料指示前沿到达分离胶时,电压升至130 V,跑至分离胶底部时电泳结束。电泳后于水平摇床,先将凝胶置于固定液中固定30 min,然后在考马斯亮蓝R-250染色液中染色2 h,再用脱色液进行脱色处理,中间更换两次脱色液直至条带清晰可见。利用凝胶成像系统进行拍照和分子质量分析。
1.3.5 鲫鱼鱼鳞抗菌多肽广谱抑菌活性测定
将分离纯化后的鲫鱼鱼鳞抗菌多肽进行广谱抑菌活性测定分析[26]。采用双层牛津杯抑菌圈法,分别测试其对金黄色葡萄球菌、枯草芽孢杆菌、白色葡萄球菌等革兰氏阳性菌,对大肠杆菌、沙门氏菌、副溶血性弧菌、假单胞菌、希瓦氏菌等革兰氏阴性菌,以及对黑曲霉、产黄青霉、毛霉等真菌的抑菌性能。
1.3.6 鲫鱼鱼鳞抗菌多肽MIC测定
采用二倍稀释法[27-28]测定鲫鱼鱼鳞抗菌多肽对金黄色葡萄球菌、枯草芽孢杆菌、白色葡萄球菌、大肠杆菌、副溶血性弧菌、 假单胞菌、希瓦氏菌和沙门氏菌的最小抑菌浓度(minimal inhibitory concentration,MIC)。
取新鲜活化的各细菌菌悬液,用LB液体培养基稀释至1×106CFU/mL,然后依次加入96 孔板的第1~12孔,每孔100 μL。配制质量浓度为1 024、512、256、128、64、32、16、8、4、2 μg/mL的抗菌多肽溶液,然后取各质量浓度的抗菌多肽溶液100 μL分别加入到第2~11孔中,各孔抗菌多肽质量浓度即降为512、256、128、64、32、16、8、4、2、1 μg/mL。其中第1孔添加等量空白LB液体培养基,第12孔添加等量50 μg/mL氯霉素溶液,分别作为阴性对照和阳性对照。37 ℃培养20 h后,用酶标仪测定各孔600 nm波长处OD值,并根据下式计算抑菌率:
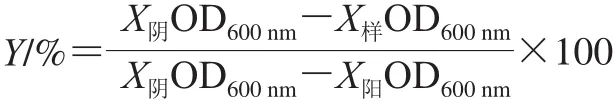
式中:Y为抑菌率;X样为待测样品;X阴为阴性对照;X阳为阳性对照。将抑菌率Y大于95%的最小质量浓度定义为该菌的MIC[29]。
1.4 数据分析
采用Excel 2010和Origin 8.0软件进行数据处理和绘图,采用Image Lab 5.2.1进行电泳凝胶成像和分析。
2 结果与分析
2.1 鲫鱼鱼鳞抗菌多肽粗酶液抑菌活性测定
以大肠杆菌和金黄色葡萄球菌为受试菌,测定鲫鱼鱼鳞抗菌多肽粗酶液的抑菌活性,结果如表1所示。

表1 鲫鱼鱼鳞抗菌多肽粗酶液抑菌活性Table 1 Antimicrobial activity of enzymatic hydrolysate of crucian carp scales
由表1可知,鲫鱼鱼鳞抗菌多肽粗酶液具有很好的抑菌活性,抑菌效果也显著好于阳性对照组。可能是由于浓缩后的鲫鱼鱼鳞抗菌多肽粗酶液较黏稠,浓度较高,并且浓缩后的粗酶液呈轻微黄色,故需对鲫鱼鱼鳞抗菌多肽粗酶液进一步分离纯化。
2.2 Sephadex G-15凝胶过滤层析结果分析
由图1a可知,透析后的鲫鱼鱼鳞抗菌多肽粗酶液经Sephadex G-15分离后出现两个吸收峰,分别对两个峰按顺序标号为A和B,并以金黄色葡萄球菌和大肠杆菌为受试菌进行抑菌活性测定,如图1b所示,其中0为空白对照,结果显示仅A组分有明显抑菌活性,所以取A组分进行下一步分离纯化。
2.3 Sephadex G-50凝胶过滤层析
从图2a可知,粗分离后的A样品溶液经过Sephadex G-50凝胶柱后,产生4 个紫外吸收峰,分别对其标号为Aa、Ab、Ac、Ad。再分别对4 个峰组分浓缩后进行抑菌活性测定,如图2b所示,其中0为空白对照,Aa与Ab并未出现抑菌圈,说明该蛋白组分无抑菌活性,Ac与Ad均有抑菌圈出现,但考虑Ad抑菌圈较小抑菌效果不明显,故选择抑菌活性更强的Ac组分进行下一步分离纯化。

图2 Sephadex G-50凝胶过滤层析洗脱图谱(a)及各洗脱峰组分抑菌活性(b)Fig. 2 Elution curve from Sephadex G-50 gel filtration chromatography (a)and antimicrobial activity of all elution peaks (b)
2.4 DEAE-52阴离子交换层析

图3 DEAE-52阴离子交换层析洗脱图谱(a)及各洗脱峰组分抑菌活性(b)Fig. 3 Elution curve from DEAE-52 anion-exchange chromatography (a)and antimicrobial activity of all elution peaks (b)
由图3a可知,将Sephadex G-50分离后的Ac组分上样于纤维素DEAE-52阴离子交换柱,先用PBS洗脱未被吸附的蛋白。然后分别用含0.1、0.3 mol/L和0.5 mol/L NaCl的PBS阶段洗脱,共出现3 个洗脱峰,分别标注为AcI、AcII和AcIII,浓缩后分别测定各抑菌活性。如图3b所示,0为空白对照,仅AcIII有抑菌圈表现出其抑菌活性,故将AcIII确定为分离纯化后的鲫鱼鱼鳞抗菌多肽并冻干保存。
2.5 SDS-PAGE结果
将经过透析,Sephadex G-15、Sephadex G-50和DEAE-52层析柱分离纯化后得到的鲫鱼鱼鳞抗菌多肽AcIII组分样品进行SDS-PAGE分析,结果见图4。
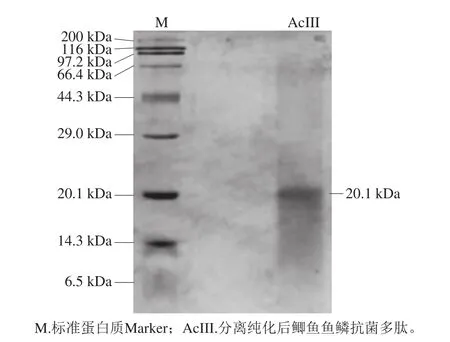
图4 鲫鱼鱼鳞抗菌多肽SDS-PAGE图Fig. 4 SDS-PAGE pattern of purified antimicrobial peptide
由图4可知,分离纯化后的鲫鱼鱼鳞抗菌多肽AcIII只显示出单一条带,说明鲫鱼鱼鳞抗菌多肽AcIII已达到电泳级纯。利用凝胶成像系统软件分析得出其分子质量约为20.1 kDa。
2.6 鲫鱼鱼鳞抗菌多肽广谱抑菌活性效果

图5 鲫鱼鱼鳞抗菌多肽对革兰氏阳性菌、阴性菌和霉菌的抑菌活性Fig. 5 Antibacterial activities of antimicrobial peptide AcIII against G+ bacteria, G- bacteria and molds
由图5可知,鲫鱼鱼鳞抗菌多肽对所有受试细菌与霉菌均有较好的抑菌作用,与各阳性对照间均存在显著性差异(P<0.05)。其对细菌的抑菌圈直径都能达到20 mm以上,其中对革兰氏阳性菌中的金黄色葡萄球菌有最大抑菌圈,直径为24.31 mm,显著大于Li Tao等[30]从非洲鲶鱼(Clarias gariepinus)副产物中得到的抗菌肽对金黄色葡萄球菌和大肠杆菌的抑菌圈直径(8.34 mm和6.13 mm)。对霉菌的抑菌效果相对细菌较弱,但抑菌圈直径也均能达到15 mm以上,其中对毛霉有最大抑菌圈,直径为19.98 mm。由此可得,鲫鱼鱼鳞抗菌多肽具有很好的广谱抑菌活性。
2.7 鲫鱼鱼鳞抗菌多肽MIC测定结果

表2 鲫鱼鱼鳞抗菌多肽对各细菌的MICTable 2 MICs of antimicrobial peptide AcIII against bacteria
由表2可知,鲫鱼鱼鳞抗菌多肽对金黄色葡萄球菌、枯草芽孢杆菌、白色葡萄球菌、副溶血性弧菌、假单胞菌和希瓦氏菌的MIC为16 μg/mL,对大肠杆菌和沙门氏菌的MIC为32 μg/mL,相较于Li Chunlei等[31]发现的AI-hemocidin 2抗菌多肽对革兰氏阳性和阴性菌的MIC为37.5~300 μg/mL,其具有更高的抑菌活性。
3 结 论
本研究利用鲫鱼鱼鳞为基础原料,通过预处理后酸提酶解等过程获得鲫鱼鱼鳞抗菌多肽粗酶液,并经过透析,Sephadex G-15、Sephadex G-50凝胶过滤柱层析和纤维素DEAE-52阴离子交换柱层析对其进行分离纯化,最后得到一个具有较强抑菌活性的蛋白组分AcIII。该组分SDS-PAGE显示为单一条带,表明其已达到电泳纯级,分析得其分子质量约为20.1 kDa。同时通过测定分离纯化后的鲫鱼鱼鳞抗菌多肽对多种细菌和霉菌的抑菌活性和MIC,证明其具有很好的广谱抑菌活性,且对金黄色葡萄球菌、枯草芽孢杆菌、白色葡萄球菌、副溶血性弧菌、假单胞菌和希瓦氏菌的MIC为16 μg/mL,对大肠杆菌和沙门氏菌的MIC为32 μg/mL。这为进一步利用鲫鱼鱼鳞抗菌多肽在医药或食品方面开发天然抗菌药物、防腐保鲜剂等提供了一定的科研基础和数据支持。

