不同产地加工及炮制方法对鹿茸中胶原蛋白含量的影响
宫瑞泽,赵 卉,曲 迪,王燕华,2,张 磊,刘 畅,刘政波,孙印石,*
(1.中国农业科学院特产研究所,吉林 长春 130112;2.吉林农业大学中药材学院,吉林 长春 130118)
鹿茸(Cornu Cervi Pantotrichum)是鹿科动物梅花鹿(Cervus nippon Temminck)或马鹿(C. elaphus Linnaeus)雄鹿未骨化密生茸毛的幼角,具有壮肾阳、益精血、强筋骨、调冲任、托疮毒的作用[1]。商品鹿茸常见的产地加工方法有煮炸、冻干、排血和带血;按切制部位分成蜡片、粉片、纱片和骨片[2];炮制品有鹿茸粉和鹿茸片[1]。本课题组前期对不同产地加工方法、不同部位及不同炮制品鹿茸中的粗蛋白、氨基酸、脂肪酸、多糖、硫酸软骨素、矿质元素、核苷、生物胺等[3-9]成分进行了比对分析,结果表明不同加工方法、部位及炮制方法对鹿茸上述化学成分均有较大影响。
目前,鹿茸的质量控制标准匮乏,缺乏统一的标准评价质量。胶原蛋白是动物组织中一种特有的重要结构蛋白,约占总蛋白的25%~30%,个别组织其质量分数可高达50%以上[10-11],主要存在于动物结缔组织(皮肤、肌肉)、骨骼、软骨等[12-14],研究表明,胶原蛋白具有促进伤口愈合、润滑关节等[15]功能,同时也与组织的衰老及钙化密切相关[16-18]。胶原蛋白的一级结构中以甘氨酸(Gly)、丙氨酸(Ala)、脯氨酸(Pro)和羟脯氨酸(Hyp)等氨基酸残基为主,其中Gly含量最高,约占总氨基酸的25%~30%,故通常采用(Gly-X-Y)n表示胶原蛋白的一级结构,其中X通常指Pro,Y通常指Hyp[19-20]。有研究表明[1]采用异硫氰酸苯酯柱前衍生高效液相色谱法可测定阿胶、龟甲胶和鹿角胶等胶类药材中构成胶原蛋白的主要氨基酸Gly、Ala、Pro和Hyp,进而对饮片质量进行控制[1]。
胶原蛋白是一类分子质量在2~300 kDa的生物大分子,无法通过仪器直接检测。利用酸法、碱法和酶法等方法提取后折算样品中的胶原蛋白含量,受提取率、样品基质效应等的影响,误差较大。Hyp是构成胶原蛋白的特异性氨基酸,不参与其他蛋白质的合成,约占胶原蛋白含量的10%。在胶原蛋白的合成过程中,已合成肽链中的Pro被羟化酶转化成Hyp。Hyp是一种亚氨基酸,结构稳定,无紫外吸收和荧光特性,可以通过测定Hyp的含量进而转化成胶原蛋白的含量。Hyp的检测通常采用比色法和柱前衍生高效液相色谱法,比色法灵敏度低、稳定性差,柱前衍生高效液相色谱法操作步骤繁琐、衍生后干扰物质较多[21-22]。氨基酸自动分析法是一种快速、准确、灵敏度高的测定方法,适用于构成胶原蛋白的Gly、Ala、Pro和Hyp等多种氨基酸的分析[23]。
赵玉红等[24]对不同生长阶段鹿茸中的胶原蛋白含量进行比较,结果表明鹿茸二杠较毛桃和三岔含有更多的胶原蛋白,但鲜见不同产地加工方法、部位及炮制品鹿茸中胶原蛋白含量的报道。本研究建立以氨基酸自动分析仪测定组成胶原蛋白的4 种氨基酸含量,进而转化为胶原蛋白含量的方法,并应用该方法研究不同产地加工、部位及炮制方法对鹿茸中胶原蛋白含量的影响。结果表明,不同产地加工及炮制方法对鹿茸中胶原蛋白含量的影响较大。该方法的建立为鹿茸产地初加工及质量评价和控制提供理论依据。
1 材料与方法
1.1 材料与试剂
鲜鹿茸21 对,购于吉林省长春市双阳区鹿乡镇,经中国农业科学院特产研究所李春义研究员鉴定为梅花鹿的茸角(二杠)。
L-羟脯氨酸(Hyp,批号:Z26M7H11979)、L-脯氨酸(Pro,批号:S30J6G1)、甘氨酸(Gly,批号:SM0315GA14)、L-丙氨酸(Ala,批号:S20A6G17672)(纯度均≥99%) 上海源叶生物科技有限公司;不同pH值柠檬酸钠缓冲盐、茚三酮衍生化试剂 日本日立公司;盐酸、柠檬酸钠(均为分析纯)北京化工厂;超纯水(电阻率≥18.25 MΩ·cm)由实验室超纯水机制备。
1.2 仪器与设备
L-8900高效全自动氨基酸自动分析仪 日本日立公司;EX125D2H电子天平 奥豪斯仪器(常州)有限公司;TG16-WS台式高速离心机 湖南湘仪实验室仪器开发有限公司;GZX-9140 MBE数显鼓风干燥箱 上海博讯实业有限公司医疗设备厂;HH-4A数显恒温水浴锅常州国华电器有限公司;FW177中草药粉碎机 天津市泰斯特仪器有限公司;0.22 μm水系(聚醚砜)针头式过滤器 天津市津腾实验设备有限公司。
1.3 方法
1.3.1 不同产地加工及炮制方法鹿茸的制备
参考文献[25]的方法,随机选取鲜鹿茸6 对进行沸水煮炸与冷冻干燥的对比加工,另外6 对进行排血茸与带血茸的对比加工。随机选取其中3 对煮炸茸与冻干茸和3 对排血茸与带血茸进行整支粉碎。将剩余的6 对鹿茸按蜡片、粉片、纱片和骨片进行分段、切片、粉碎、过筛(60 目);剩余9 对鹿茸按传统工艺进行沸水煮炸加工,将加工好的鹿茸分成A、B、C 3 组,每组3 对,每对鹿茸的2 支分别参照文献[1]方法炮制加工成鹿茸粉和体积分数分别为40%、50%、60%的乙醇溶液润制鹿茸片,鹿茸片进一步粉碎、过筛(60 目)。
1.3.2 对照品溶液的制备
精密称取一定量的Hyp、Pro、Gly和Ala对照品置于50 mL容量瓶中,用柠檬酸钠缓冲液(柠檬酸钠19.6 g,加超纯水稀释到1 000 mL,用盐酸调pH值至2.2)定容,混匀,配成各氨基酸组分质量浓度为100 ng/mL的对照品储备液,4 ℃低温保存。
1.3.3 供试品溶液的制备
准确称取制备好的鹿茸样品30.0 mg(约合20.0 mg蛋白质)于氨基酸水解管中,每个样品3 份。加20 mL 6 mol/L的盐酸后密封水解管,将水解管置于110 ℃恒温干燥箱中,水解24 h。取出冷却至室温后离心,用移液器吸取800 μL上清液至蒸发皿中水浴70 ℃条件下蒸发至干,残留物用2 mL上机用柠檬酸钠缓冲液复溶,后用0.22 μm水系滤膜过滤,作为供试品溶液。
1.3.4 色谱条件

表1 氨基酸自动分析仪氨基酸梯度洗脱及茚三酮柱后衍生化程序Table 1 Amino acid gradient elution and postcolumn ninhydrin derivatization procedure

续表1
强酸型氨基酸自动分析仪专用离子交换色谱柱(4.6 mm×60 mm);No.2622不锈钢柱加保护柱;柱温57 ℃;反应池温度135 ℃;流动相:B1~B4为不同pH值的柠檬酸钠缓冲溶液,B5为水(清洗流动相),B6为再生溶液(清洗样品),B1~B6由泵1控制,流速为0.400 mL/min;R1~R3是茚三酮衍生化剂及其缓冲溶液,由泵2控制,流速为0.350 mL/min;氨基酸梯度洗脱及茚三酮柱后衍生化程序参考GB/T 5009.124—2016《食品中氨基酸的测定》及相关文献方法[7,26],具体洗脱程序见表1;其中Hyp和Pro经茚三酮衍生后显黄色,在440 nm波长处有最大吸收,Gly和Ala经茚三酮衍生后显蓝紫色,在570 nm波长处有最大吸收;进样体积20 μL。
1.3.5 方法学考察
1.3.5.1 线性关系、检出限与定量限测定
精密吸取1.3.2节的氨基酸混合对照品储备液,加入机用柠檬酸钠缓冲液稀释成系列梯度,按1.3.4节色谱条件进样测定各氨基酸的峰面积,每个质量浓度平行进样3 次。以各氨基酸质量浓度为横坐标(X),峰面积的平均值为纵坐标(Y),绘制标准曲线,计算回归方程。将1.3.2节对照品储备液加入机用柠檬酸钠缓冲液逐级稀释后,按信噪比为3的对照品溶液质量浓度为检出限,以信噪比为10的对照品溶液质量浓度为定量限。
1.3.5.2 精密度测定
精密吸取同一质量浓度(100 ng/mL)的氨基酸混合对照品溶液20 μL,按1.3.4节色谱条件进行分析,连续进样5 次,测定各氨基酸峰面积及相对标准偏差(relative standard deviation,RSD)。
1.3.5.3 重复性测定
精密称取同一鹿茸样品(煮炸茸整支)6 份,每份30.0 mg,按1.3.3节方法制得供试品溶液,精密吸取6 份供试品溶液各20 μL,按1.3.4节色谱条件进样分析,测定各氨基酸峰面积,通过回归方程计算样品中各氨基酸含量及RSD。
1.3.5.4 稳定性测定
精密吸取1.3.3节制备的鹿茸(煮炸茸整支)供试品溶液20 μL,分别在0、2、4、8、16、24 h按1.3.4节色谱条件进样分析,测定各氨基酸峰面积,考察仪器稳定性。
1.3.5.5 回收率测定
精密称取已知4 种氨基酸含量的鹿茸样品(煮炸茸整支)粉末9 份,每份15.0 mg,分成低、中、高3 组,每组3 个平行,按照低、中、高水平加入适量的4 种氨基酸混合对照品,按1.3.3节方法制备供试品溶液,按1.3.4节色谱条件进样分析,测定峰面积,计算胶原蛋白含量及回收率。
1.3.6 胶原蛋白含量的计算
鹿茸样品中胶原蛋白质量分数按下式计算:

式中:A为通过标准曲线得到的样品中Hyp的质量浓度/(ng/mL);m为称取鹿茸的质量/mg;50为氨基酸水解液定容后的体积/mL。
1.4 数据处理
2 结果与分析
2.1 胶原蛋白测定方法的选择

图1 4 种氨基酸混合标准品(A)和鹿茸样品(B)色谱图Fig. 1 Chromatograms of mixed standard of four amino acids (A) and velvet antler sample (B)
采用酸水解法将鹿茸样品中的胶原蛋白水解成游离态氨基酸,后经氨基酸自动分析仪测定构成胶原蛋白的4 种氨基酸Gly、Ala、Pro和Hyp含量(图1),参考赵玉红[24]和贡雯玉[27]等的方法按照Hyp的含量换算胶原蛋白含量,进而分析不同产地加工方法、部位和炮制方法对鹿茸中胶原蛋白的影响。
评估方法:以地区统调负荷最高时点校验10(20)千伏负荷组“N-1”,负荷组“N-1”校验通过率(%)=通过“N-1”校验的负荷组数/负荷总组数,对未通过“N-1”校验的负荷组进行原因分析,并与上一年负荷组“N-1”校验通过率实绩值进行比对,对降低的情况进行原因分析,提出解决建议和规划方案。
2.2 方法学考察结果

表2 4 种氨基酸的回归方程、相关系数(R2)、线性范围、检出限和定量限Table 2 Regression equations, correlation coefficients, linear ranges,limits of detection and limits of quantification of four amino acids
4 种氨基酸的回归方程、线性范围、检出限和定量限见表2。精密度实验结果,Hyp、Pro、Gly和Ala的RSD分别为1.78%、1.99%、2.01%和2.17%,表明氨基酸自动分析仪精密度良好;重复性实验结果,Hyp、Pro、Gly和Ala的RSD分别为1.82%、2.03%、1.74%和2.81%,表明本实验重复性良好;稳定性实验结果,Hyp、Pro、Gly和Ala峰面积的RSD分别为1.86%、2.14%、1.78%和2.41%,表明氨基酸自动分析仪在24 h内稳定性良好;加样回收实验结果,胶原蛋白的回收率介于95.74%~102.35%之间,RSD小于5%,表明加样回收率良好。
2.3 冻干茸与煮炸茸4 种氨基酸及胶原蛋白含量
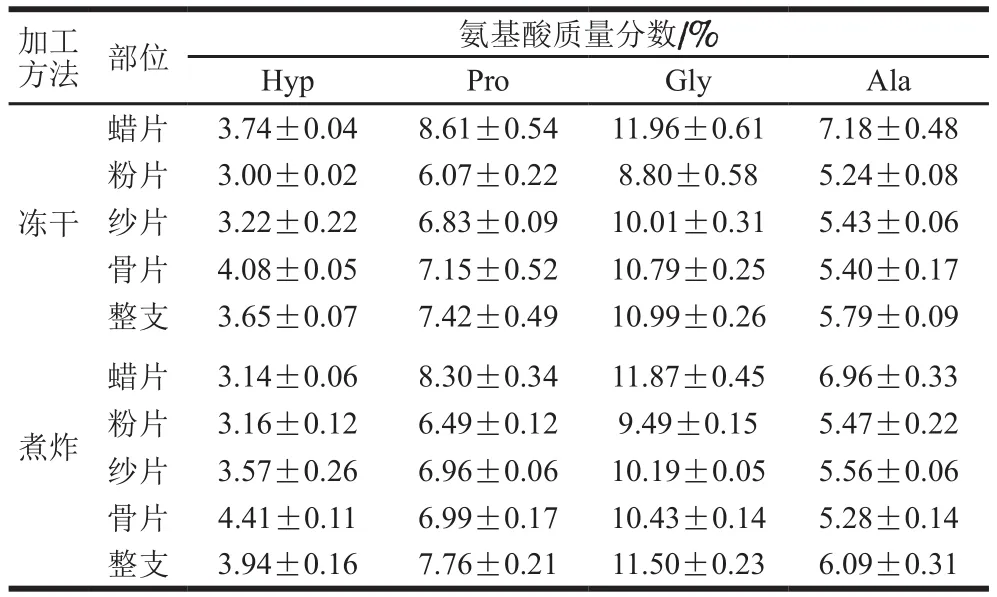
表3 冻干茸与煮炸茸中4 种氨基酸含量Table 3 Contents of four amino acids in freeze-dried and boiled velvet antler
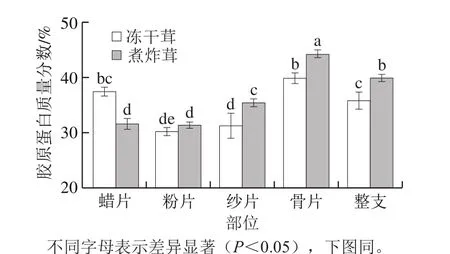
图2 煮炸茸与冻干茸中胶原蛋白含量Fig. 2 Collagen contents in boiled and freeze-dried velvet antler
由表3和图2可知,通过对比煮炸茸和冻干茸不同部位鹿茸中构成胶原蛋白的4 种氨基酸Hyp、Pro、Gly和Ala发现,4 种氨基酸中Gly含量最高,Pro、Ala和Hyp依次递减。鉴于Hyp为胶原蛋白中的特异性氨基酸,因此采用其含量对胶原蛋白含量进行换算,但通过对其他3 种氨基酸比较发现三者表现出如下特点:同一部位煮炸茸高于冻干茸(除蜡片、骨片);蜡片含量较高,粉片、纱片和骨片含量逐渐增大(除Ala)。冻干茸蜡片、粉片、纱片、骨片和整支中胶原蛋白质量分数分别为37.43%、30.01%、32.16%、40.81%和36.47%;煮炸茸相应部位胶原蛋白质量分数分别为31.40%、31.59%、35.69%、44.07%和39.44%。对于煮炸茸和冻干茸,除蜡片和粉片外,煮炸茸纱片、骨片和整支中胶原蛋白的含量均显著高于相同部位的冻干茸(P<0.05);对于同一加工方法的不同部位,冻干茸蜡片中胶原蛋白含量显著高于粉片、纱片(P<0.05),与骨片无显著性差异(P>0.05),粉片、纱片和骨片中胶原蛋白含量逐渐增加;煮炸茸蜡片中胶原蛋白含量与纱片无显著差异(P>0.05),粉片、纱片和骨片中胶原蛋白含量逐渐增加。鹿茸的蜡片、粉片、纱片和骨片分别对应发育程度不同的软骨组织[28],其中蜡片部位对应分生组织旺盛的软骨组织其胶原蛋白含量较高;粉片、纱片和骨片越靠近基部骨组织的发育越成熟,骨组织中含有大量的胶原蛋白,因此不同部位胶原蛋白含量呈现出粉片、纱片和骨片逐渐增加的规律。
2.4 排血茸与带血茸4 种氨基酸及胶原蛋白含量

表4 排血茸与带血茸中4 种氨基酸含量Table 4 Contents of four amino acids in unexsanguinated and exsanguinated velvet antler
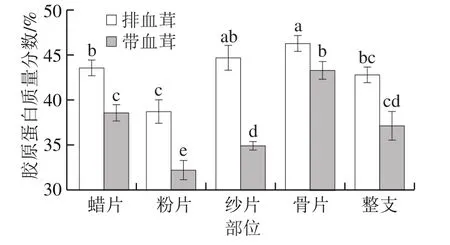
图3 排血茸与带血茸中胶原蛋白质量分数Fig. 3 Collagen contents in unexsanguinated and exsanguinated velvet antler
由表4和图3可知,通过对比排血茸和带血茸不同部位鹿茸中构成胶原蛋白的4 种氨基酸Hyp、Pro、Gly和Ala发现,Gly含量最高,Pro、Ala和Hyp含量依次递减。排血茸和带血茸相比,同一部位排血茸中4 种氨基酸显著高于带血茸(P<0.05)(整支除外);同一加工方法不同部位之间,排血茸和带血茸中Hyp表现出蜡片含量较高,粉片、纱片和骨片含量逐渐增加的规律,带血茸中Gly、Pro和Ala表现出蜡片、粉片含量较高,纱片、骨片含量逐渐增加的规律,排血茸中Gly表现出蜡片、粉片、纱片和骨片含量依次递减的规律,Pro和Ala表现出蜡片、纱片含量较高,粉片、骨片含量依次递减的规律。
排血茸蜡片、粉片、纱片、骨片和整支中胶原蛋白质量分数分别为43.89%、39.04%、45.94%、46.23%和42.24%;带血茸相应部位胶原蛋白质量分数分别为37.84%、32.24%、35.11%、43.62%和37.64%。对于排血茸和带血茸,同一部位排血茸中胶原蛋白的含量均显著高于带血茸(P<0.05)(整支除外),排血茸加工过程中通过物理离心排出茸体内的血液,血液中几乎不含胶原蛋白,因此单位质量的排血茸中胶原蛋白的含量高于带血茸;对于同一加工方法的不同部位,排血茸蜡片中胶原蛋白含量显著高于粉片(P<0.05),与纱片无显著性差异(P>0.05),且显著低于骨片(P<0.05),粉片、纱片和骨片中胶原蛋白含量逐渐增加;带血茸蜡片中胶原蛋白含量显著高于粉片和纱片,且显著低于骨片(P<0.05),粉片、纱片和骨片中胶原蛋白含量逐渐增加,不同部位的软骨组织其生长发育程度不同仍是造成不同部位胶原蛋白含量差异的主要原因。
2.5 炮制方法对鹿茸中4 种氨基酸及胶原蛋白含量影响
带血煮炸加工后的每对鹿茸分成2 支分别按文献[1]方法炮制,一支直接粉碎成鹿茸粉,另一支乙醇润制后切制成鹿茸片后再干燥、粉碎。如表5所示,其中直接粉碎的3 组鹿茸粉胶原蛋白质量分数分别为25.51%、24.93%和26.12%,采用40%、50%和60%乙醇溶液润制的鹿茸片胶原蛋白含量分别为26.93%、28.89%和29.08%。

表5 鹿茸不同炮制品中4 种氨基酸和胶原蛋白含量Table 5 Contents of four amino acids and collagen in different processed products of velvet antler
由表5可知,通过乙醇润制处理的鹿茸片中Hyp含量均高于未经乙醇处理直接粉碎的鹿茸粉,40%乙醇溶液润制的鹿茸片中Pro、Gly和Ala含量较未经乙醇处理直接粉碎的鹿茸粉均有一定程度的减少,50%和60%乙醇溶液润制的鹿茸片中Pro、Gly和Ala含量较未经乙醇处理直接粉碎的鹿茸粉均有一定程度的增加。通过不同体积分数乙醇溶液润制处理过的鹿茸片其胶原蛋白含量均显著高于未经处理直接粉碎的鹿茸粉,且随着润制鹿茸用乙醇溶液体积分数的增加,鹿茸片中胶原蛋白含量不断增加。原因可能是鹿茸片加工过程中使用乙醇润制,不同体积分数乙醇溶液中水占比较大,鹿茸中的游离氨基酸、无机盐等物质能被水溶出[9],但胶原蛋白为生物大分子不易溶出,因此乙醇润制后单位质量的鹿茸中胶原蛋白含量增加;随着乙醇溶液体积分数的增加其含水量降低对游离氨基酸、无机盐等物质的溶出能力减弱,因此随着润制鹿茸用乙醇体积分数的增加,鹿茸片中胶原蛋白含量不断增加。
3 结 论
本实验采用氨基酸自动分析法建立同时分析组成胶原蛋白的4 种主要氨基酸Hyp、Pro、Gly和Ala,通过胶原蛋白的特异性氨基酸Hyp定量胶原蛋白的含量,对比分析不同产地加工炮制方法和不同部位对鹿茸中胶原蛋白含量的影响,该方法具有专属性强、稳定性高、重复性好的特点,适用于鹿茸中胶原蛋白含量的分析和检测。
通过比较不同产地加工、炮制方法和不同部位鹿茸中胶原蛋白含量的影响发现:不同产地加工方法对鹿茸中的胶原蛋白含量影响较大,煮炸茸中胶原蛋白含量高于冻干茸(蜡片除外),排血茸中胶原蛋白含量高于带血茸;不同部位鹿茸之间表现出蜡片胶原蛋白含量较高,粉片、纱片和骨片中胶原蛋白含量依次递增的规律;不同炮制方法的鹿茸炮制品中,乙醇润制处理的鹿茸片中胶原蛋白含量高于直接粉碎的鹿茸粉,随着润制鹿茸乙醇溶液体积分数的增大鹿茸片中胶原蛋白含量逐渐增加。
综上所述,仅以胶原蛋白含量评价鹿茸质量,总体煮炸、排血产地初加工的鹿茸较冻干、带血加工的鹿茸中胶原蛋白含量更高;鹿茸的蜡片、骨片较粉片、纱片含有更多的胶原蛋白;乙醇润制的鹿茸片比直接粉碎的鹿茸粉更好地保留了鹿茸中的胶原蛋白。

