嗜热甘露聚糖酶毕赤酵母工程菌的表达及该酶在果汁澄清中的应用
陈 伟,谷新晰,黄 蕾,李 晨,田洪涛,卢海强*
(河北农业大学食品科技学院,河北 保定 071000)
β-甘露聚糖酶(EC 3.2.1.78)是一类作用于β-1,4-甘露糖苷键的内切水解酶,简称甘露聚糖酶[1]。依据氨基酸序列和结构的差异,目前甘露聚糖酶可分为4 个家族,分别是GH5家族、GH26家族、GH113家族和GH134家族[2]。甘露聚糖酶广泛地分布于软体动物、植物和微生物之中,其中微生物是生产用甘露聚糖酶的主要来源[3]。甘露聚糖酶在寡糖的制备、饮料的澄清及浓缩加工过程中存在着巨大的应用潜力[4]。然而随着甘露聚糖酶在实际生产中的应用,逐步暴露出一些亟待解决的问题,如较低的酶活力以及较差的耐受性。
嗜热酶具有较高的酶促反应温度和较好的耐受性,已经成为酶制剂研发的重要领域[5]。迄今为止,人们已经从不同环境中成功获得了30 个嗜热甘露聚糖酶[6],其中来源于Talaromyces leycettanus JCM12802菌株的Man5A(AJF11663)的酶促反应温度最高(90 ℃),且在70 ℃具有良好的热稳定性[7]。Yang Hong等[8]从嗜热真菌Neosartorya sp. P1中获得了嗜热甘露聚糖酶Man5P1,并在豆乳加工过程取得了较好的应用效果。因此,积极挖掘甘露聚糖酶资源,已成为研究的热点领域。
近年来,果汁饮料在我国发展潜力巨大,而加工过程中出现的果汁浑浊制约着果汁产业的快速发展[9]。果汁中除含维生素、单宁和果糖等物质外,还含有淀粉、果胶、纤维素和半纤维素等非水溶性物质,而这些非水溶性物质极易造成果汁的浑浊。当前,研究人员已将果胶酶、阿拉伯聚糖酶、蛋白酶和淀粉酶等酶类用来进行果汁澄清处理并取得了一定的效果[10]。甘露聚糖作为一种重要的半纤维素广泛地分布在水果中,而利用甘露聚糖酶提高果汁澄清相关报道较少,探究嗜热甘露聚糖酶作为果汁澄清用酶的潜力具有较强的理论和应用价值。
本研究拟对嗜热真菌Neosartorya sp. HBFH9中GH5家族甘露聚糖酶基因进行克隆、表达及相关酶学性质的研究,并探究其在果汁澄清中的应用潜力,这对丰富食品酶类资源及提高果汁加工质量具有一定的理论意义。
1 材料与方法
1.1 材料与试剂
真菌HBFH9(Neosartorya sp. HBFH9),巴斯德毕赤酵母GS115和质粒pPIC9k由本实验保存;Trans 1-T1北京全式金生物技术有限公司;质粒pMDTM19-T、Fast pfu DNA聚合酶、T4 DNA酶、EcoR I、Not I和Bgl II等酶大连宝生物公司;PDA培养基 上海博微生物科技有限公司。
参照毕赤酵母表达手册制备MD琼脂板、生长培养基(BMGY)和诱导培养基(BMMY);引物合成和核酸测序由生工生物工程(上海)股份有限公司完成。发酵培养基:角豆胶(0.3%),NH4NO3(0.5%),KCl(0.05%),MgSO4·7H2O(0.05%),MnSO4·4H2O(0.03%),FeSO4·7H2O(0.03%),pH 6.0。
1.2 仪器与设备
立式高速低温离心机 日本Hitachi公司;Biometra Tprofessional聚合酶链式反应(polymerase chain reaction,PCR)仪 德国Biometra公司;TU-1810紫外分光光度计 北京普析通用仪器有限公司;1652100电穿孔仪 美国Bio-Rad公司。
1.3 方法
1.3.1 甘露聚糖酶基因的克隆
菌株Neosartorya sp. HBFH9在PDB培养基中30 ℃培养72 h后,离心收集菌体。采用CTAB法对真菌HBFH9提取基因组,-20 ℃保藏备用。采用兼并引物(MP1和MP2)扩增保守序列[11],通过琼脂糖电泳检测扩增产物,将符合大小的片段和pEASY-T3载体进行连接和转化,阳性转化子由生工生物工程(上海)股份有限公司进行序列测定。
将真菌HBFH9接种于发酵培养基中,45 ℃摇床诱导培养3 d,收集菌体。使用SV Total RNA Isolation System试剂盒提取菌株HBFH9总RNA,采用反转录试剂盒对RNA进行反转录,获得cDNA的第一条链。参考Aspergillus fischeri NRRL 181中的XP_001262238.1基因序列设计引物(PF和PR),PF(CGGAATTCCAGGTTGG TCCTTGGGGCCAGTGTGG)和PR(GAATGCGGCCGC CTAGATTCGGCTGACATGATC),进行PCR测定,将扩增产物进行回收后连接T载体,构建pMDTM19T-nsMan5B质粒,转入Trans1-T1宿主,阳性转化子由生工生物工程(上海)股份有限公司进行测序。
1.3.2 序列信息分析
使用Vector NTI 11.0软件对测序结果进行分析。使用FGENESH(http://linux1.softberry.com/)软件对基因的内含子和外显子位点进行预测分析。使用BLAST工具(https://blast.ncbi.nlm.nih.gov/Blast.cgi)对基因序列进行比对分析。使用ExPASy(http://web.expasy.org/protparam/)在线工具预测酶蛋白的分子质量和等电点。使用SignalP 4.1Server(http://www.cbs.dtu.dk/services/SignalP/)软件进行酶蛋白信号肽位点预测。使用NetNGlyc 1.0(http://www.cbs.dtu.dk/services/NetNGlyc/)在线工具预测酶蛋白分子的N-糖基化位点。利用Swiss-Mode服务器(https://www.swissmodel.expasy.org)预测酶蛋白分子的三维结构,并利用Pymol软件进行分析。
1.3.3 重组菌株的构建
将pMDTM19T-nsMan5B质粒进行EcoR I和Not I双酶切,并与质粒pPIC-9k进行连接反应构建重组质粒pPIC9k-nsMan5B,并将阳性转化子送至生工生物工程(上海)股份有限公司进行测序分析。
提取阳性pPIC9k-nsMan5B质粒,使用限制性酶Bgl II酶切pPIC9k-nsMan5B质粒,并电转化至GS115感受态,利用酶活性筛选方法对转化子进行筛选,获得阳性转化子。
1.3.4 重组菌株诱导表达及十二烷基硫酸钠-聚丙烯酰氨凝胶电泳(sodium dodecyl sulfate-polyacrylamide gel electrophoresis,SDS-PAGE)分析
挑取单阳性转化子至50mL YPD培养基中,摇床培养(30 ℃,250 r/min)12 h后,将其以1%的接种量接种于200 mL BMGY中,在摇床中30 ℃培养48 h。参照毕赤酵母表达手册方法,收集菌体并转接至BMMY培养基摇床继续培养72 h,维持甲醇体积分数为0.5%。离心收集发酵液,即为粗酶液,进行活力测定及SDS-PAGE分析。
1.3.5 甘露聚糖酶酶学性质分析
甘露聚糖酶酶活测定参考Miller[12]的DNS方法。取100 µL适当稀释酶液和900 µL角豆胶(0.5%),在pH 5.0,50 mmol/L的磷酸氢二钠-柠檬酸缓冲液中,60 ℃反应10 min后,加入1.5 mL DNS终止反应。对照则在加入1.5 mL DNS后,再补加100 µL稀释酶液。沸水浴5 min并冷却至室温后在波长540 nm处测定吸光度。参照Sakai等[13]的方法,以甘露糖的量为横坐标,以吸光度为纵坐标,绘制标准曲线。
酶活单位:以每分钟生成1 µmol甘露糖所需的酶量定义为一个酶活单位(U)。
1.3.5.1 pH值对重组酶NsMan5B的影响
在pH 2.0~12.0范围条件下,测定重组酶NsMan5B的酶活力,以酶活力最高值为100%计算,分析该酶的pH值反应范围。将重组酶NsMan5B在pH 2.0~12.0的条件下,37 ℃处理1 h,对照为未进行处理的酶,按照标准酶活力测定方法测定酶活力,分析其pH耐受性。
1.3.5.2 温度对重组酶NsMan5B的影响
将重组酶NsMan5B在最适pH值下,分别在温度为30~70 ℃范围内,测定重组酶NsMan5B的酶活力,以酶活力最高值为100%计算,分析其反应温度范围。将重组酶在50、60、70 ℃条件下,分别孵育0、5、10、20、30 min和60 min后,测定酶活力,以0 min处理的酶活力值为100%计算,分析该酶的热稳定性。
1.3.5.3 金属离子和化学试剂对重组酶NsMan5B活性的影响
在标准反应条件下,分别测定终浓度为1 mmol/L和5 mmol/L的金属离子酶活力,探究金属离子和化学试剂对酶活力的影响,为重组酶的贮藏、纯化及应用提供一定的理论指导。
1.3.5.4 重组酶NsMan5B动力学参数测定
重组酶NsMan5B在最适反应条件下,以不同浓度(1.0~10.0 mg/mL)的角豆胶溶液为底物测定酶活力,根据米氏方程双倒数法(Lineweaver-Burk法)求得Km和Vmax。
1.3.6 重组酶NsMan5B在果汁澄清中的应用
果汁澄清度的测定[14]:苹果、杏、柿子、葡萄、梨和橘子,按照柿子与水质量比1∶4压榨,经胶体磨进一步处理,获得柿子汁样品。将苹果、梨、桃子、葡萄、柿子和橘子水果清洗干净、晾干水分,参照Hayrunnisa等[14]方法进行榨汁处理,并保存4 ℃备用。将2 mL酶液添加到10 g果汁中,在pH 5.0、60 ℃反应1 h后,在660 nm波长处测定吸光度,以透光率作为果汁澄清度指标参数,以添加等量灭活酶的果汁反应液作为空白对照组。
1.4 数据分析及处理
每次实验重复测定3 次,利用Excel和SPSS19.0软件对测定结果进行统计分析,数据结果采用表示。
2 结果与分析
2.1 nsMan5B基因序列分析
经对菌株Neosartorya sp. HBFH9的GH5家族甘露聚糖酶保守序列扩增,共获得2 个180 bp左右的片段。经分析均属于GH5家族甘露聚糖酶,分别命名为nsMan5A和nsMan5B,基因nsMan5A序列与已报道的Man5P1一致性最高(99%),基因nsMan5B序列与Aspergillus fischeri NRRL 181中的XP_001262238.1一致性为99%,而到目前为止,并无该基因相关功能报道。经分析,nsMan5B基因由1 491 bp核苷酸组成,2 个内含子(I内含子950~1 009 bp,II内含子1 140~1 199 bp),cDNA全长1 371 bp核苷酸,编码456 个氨基酸和1 个终止密码子。理论分子质量约为49.5 kDa,等电点为5.0,该蛋白含有1 个信号肽序列(1-18AA),不存在N-糖基化位点。经结构预测分析,成熟NsMan5B酶蛋白分子由3 部分组成:碳水化合物结合区(CBM1,1~30)、linker区(31~103)和催化区(104~423)。经序列比对分析(图1),nsMan5B基因序列与已报道的嗜热甘露聚糖酶ManBK基因序列(PDB:3wh9)一致性为46.7%,,与C.antarcticus中的甘露聚糖酶(PDB:4oou)基因序列一致性为12.7%,与Trichoderma reesei中甘露聚糖酶(PDB:1QNR)基因序列一致性为43.4%。经三维结构比对分析,NsMan5B具有典型的(β/α)8桶状结构,两个催化位点分别是281E和390E,属于GH5家族。

图1 甘露聚糖酶NsMan5B序列比对分析Fig. 1 Amino acid sequence alignment of NsMan5B using the ClustalW program
2.2 重组菌nsMan5B基因诱导表达及产物的SDS-PAGE分析
将重组菌株进行诱导表达之后,对细胞发酵液进行酶活检测,发酵液中酶活为7.8 U/mL。进一步对重组菌发酵液进行SDS-PAGE检测,结果见图2。发酵产物在约49 kDa处出现目标蛋白条带,这与NsMan5B酶蛋白分子理论分子质量基本上一致,不存在糖基化修饰。

图2 甘露聚糖酶NsMan5B的SDS-PAGE分析Fig. 2 SDS-PAGE analysis of recombinant NsMan5B
2.3 重组酶NsMan5B酶学特性分析
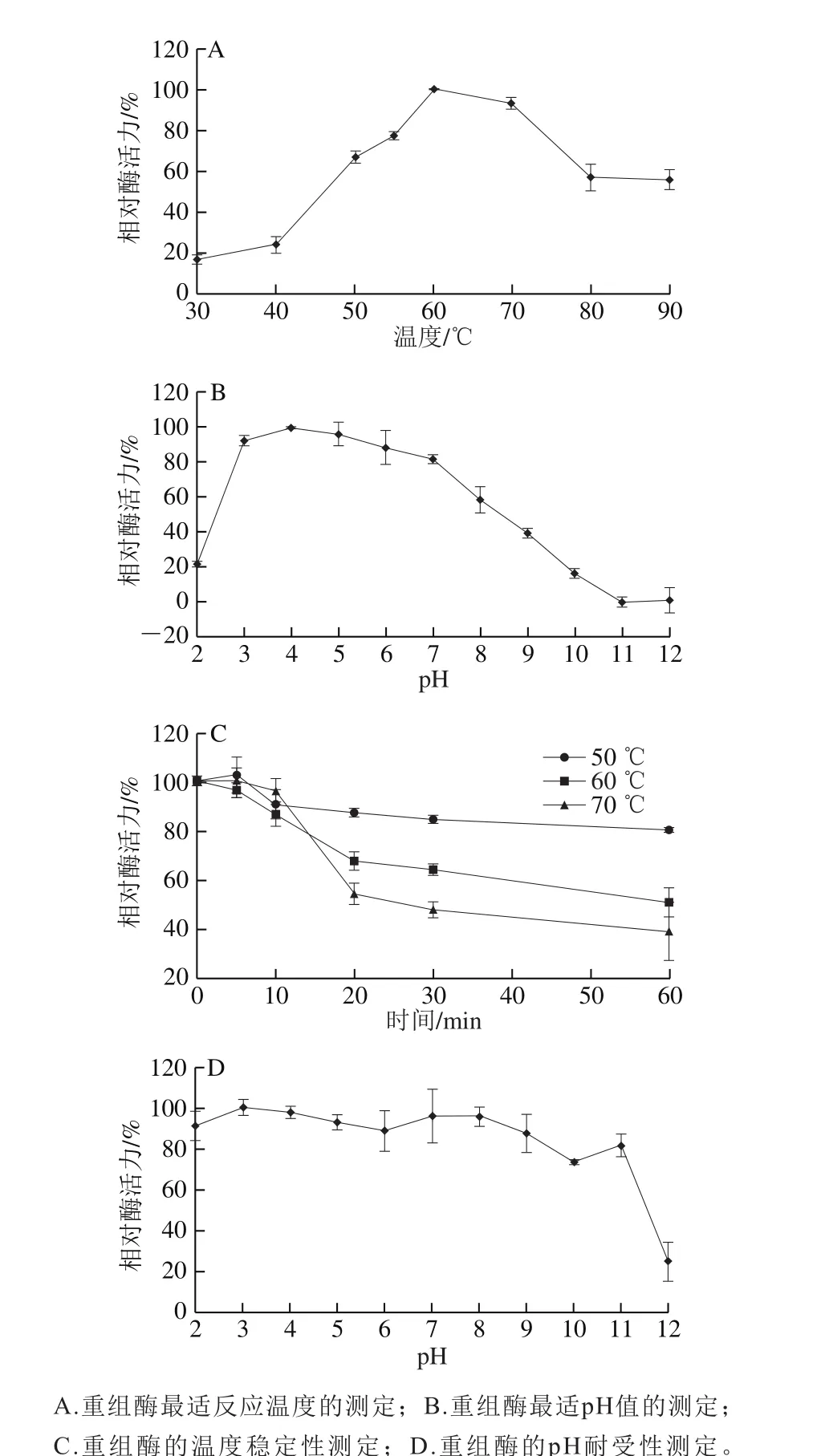
图3 甘露糖酶NsMan5B的酶学性质Fig. 3 Effects of pH and temperature on the β-mannanase activity of recombinant NsMan5B
由图3A、C可知重组酶NsMan5B的最适反应温度为60 ℃,属于嗜热酶。在70 ℃反应下具有90%以上的酶活性,即使在90 ℃时依然能够维持50%以上活性,该酶的反应温度范围较广,30~90 ℃都能够检测到该酶的活性。在50 ℃条件下,重组酶NsMan5B酶基本稳定,在处理1 h后,能够维持80%以上的酶活性;60 ℃处理1 h后,酶活损失约50%;而70 ℃条件处理1 h后能够维持原活性的40%。
由图3B、D可知,重组酶NsMan5B具有较广的pH值作用范围,在pH 2.0~11.0范围内都表现出一定的酶活性,该酶的最适反应pH值为4.0,在酸性范围内(3.0<pH<7.0)酶活性较高,能够维持80%以上的酶活性。随着pH值的逐渐升高,酶活性也随之降低,直至pH 11.0,该酶活性完全丧失。
经对重组酶NsMan5B的酸碱耐受性分析发现,该酶在pH 2.0~11.0范围内处理1 h后酶活力基本维持稳定,即使在碱性条件下(7.0<pH<11.0)依然能够维持75%以上的酶活力,而在pH 12.0条件下处理后酶活力丧失较明显,只能维持原酶活性的20%左右。经动力学性质测定该酶的Vmax为76.3 μmol/(min·mg),Km为1.26 mg/mL。
2.4 金属离子和化学试剂对重组酶活力的影响及动力学参数测定
金属离子对重组甘露聚糖酶活性的影响差异较大,且不同离子浓度会对酶活性造成不同影响。由表1可知,在低离子浓度(1 mmol/L)条件下,Zn2+、Fe3+和Cu2+显著促进了重组酶NsMan5B的活性,使其活性分别提升了66%、32%和23%。除了Ca2+和K+对重组酶NsMan5B起到了较明显抑制外,其他金属离子都未对重组酶的活性表现出强烈抑制。而在高离子浓度条件下,除了Mn2+外,其他金属离子都极显著的促进了重组酶NsMan5B的活性,其提升幅度从19%~244%不等。其中K+和Cu2+促进作用最为明显,分别使重组酶活性增加了2.4 倍和1.2 倍。不论是在高浓度还是低浓度,化学试剂并未同金属离子一样表现出明显的促进作用。醇类物质已被广泛用来进行酶液的初步浓缩[15],经对几种醇类物质影响分析发现,大体随着醇分子主链的延长,醇对重组酶NsMan5B活性的抑制作用越来越显著,醇体积分数越大,抑制越明显,如:在体积分数2.5%正丁醇溶液条件下,重组酶只能维持原活性的14%左右。表面活性剂吐温80和变性剂尿素都对重组酶表现出较强的抑制作用。
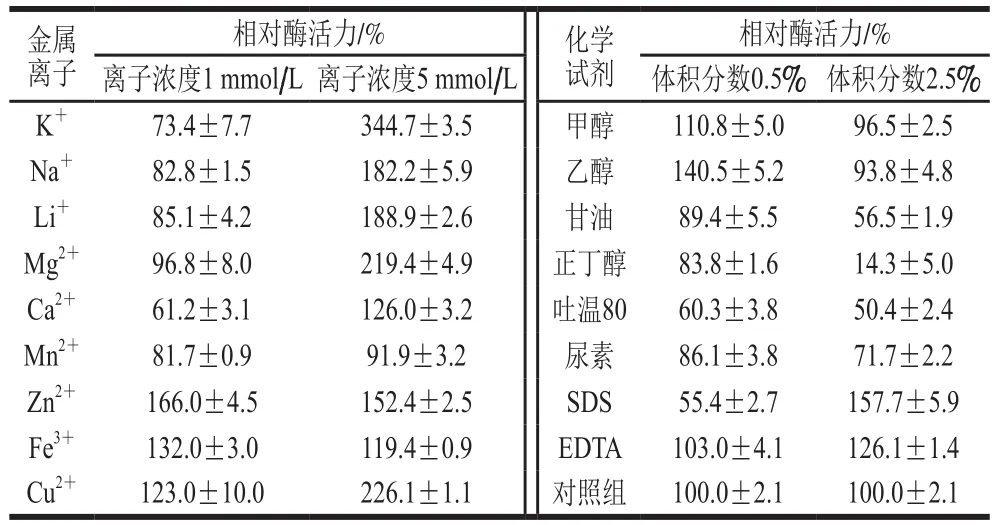
表1 不同金属离子和化学试剂对NsMan5B酶活力的影响Table 1 Effects of metal ions and chemical reagents on β-mannanase activity of recombinant NsMan5B
2.5 重组甘露聚酶NsMan5B对5 种果汁澄清品质的影响
采用酶制剂处理果汁原料提升果汁澄清度已被行业所认可并广泛应用,如果胶酶、纤维素、淀粉酶及蛋白酶等。甘露聚糖作为一种重要的半纤维素成分,广泛存在于植物的果实中[16]。因此,利用甘露聚糖酶降解果汁中的甘露聚糖,继而提高果汁的澄清度是一条可行策略,并已被Nadaroglu等[17]的研究证实。本研究用重组甘露聚糖酶NsMan5B分别处理柿子汁、苹果汁、桃子汁、葡萄汁和橘子汁。表2显示,重组酶除对橘子汁外,对其他果汁的澄清度都有不同程度的提高,其中柿子汁最为明显,提高了31.8%,其他3 种果汁分别提高了7%、4%和4%。

表2 甘露聚酶对果汁澄清效果Table 2 Clarification efficiency of fruit juice by using recombinant NsMan5B %
3 讨 论
嗜热甘露聚糖酶具有能够提高催化反应速率,降低杂菌污染,简化生产工艺等优点,使得该类酶在食品工业领域具有较广的应用前景[18-19]。菌株Neosartoryasp.HBFH9为本课题组从中高温大曲中筛选获得,并初步确认为嗜热真菌(>45 ℃)。通过对该菌基因组DNA中的GH5家族甘露聚糖酶保守序列的扩增,共获得2 条GH5家族的甘露聚糖酶基因的保守序列,分别命名为nsMan5A和nsMan5B基因。迄今为止并无nsMan5B基因功能的相关报道。经结构分析,NsMan5B酶蛋白分子的功能结构单元较完整,除具有催化功能的催化区外,还具有底物识别的碳水化合物结合区(CBM)和连接两功能结构单元的Linker区。大量研究发现,Linker区域对酶分子的稳定性有较大相关性[20],该区域的序列改造是后续提升重组NsMan5B稳定的重要靶点。
大部分真菌来源的甘露聚糖酶最适反应温度为40~70 ℃[21-23],重组甘露聚糖酶NsMan5B的最适反应温度为60 ℃,在70 ℃反应下具有90%以上的酶活性,即使在90 ℃时依然能够维持50%以上活性,属于嗜热酶。当前,已报道的甘露聚糖酶Man5A(AJF11663)的酶促反应温度最高(90 ℃),但该酶的pH值范围较窄,当pH>7.0时,酶活力完全消失,而重组酶NsMan5B却表现出较出色的pH值反应范围及较强的酸碱耐受特性。
甘露聚糖酶N s M a n 5 B的最适p H值为4.0,这与T.terrestris来源的甘露聚糖酶(pH 4.5),P. chrysosporium来源的甘露聚糖酶(pH 4.0)及A. nigerBK01来源的甘露聚糖酶(pH 4.5)较一致[24-25]。在pH 8.0条件下,重组酶NsMan5B能够维持60%的酶活性;即使在pH 9.0条件下,依然能保持30%以上的酶活性。真菌来源的甘露聚糖酶在酸性和中性条件下稳定,只有很少的一些酶能够在pH 8.0及以上的碱性条件下稳定[26-27],甘露聚糖酶NsMan5B是一个为数不多在碱性条件下稳定的甘露聚糖酶,即使在pH 10.0碱性条件下处理1 h,酶活力基本能够维持80%以上,表明该酶较其他嗜热甘露聚糖酶具有较好的pH值稳定性,因此具有更加宽广的应用范围。金属离子和化学试剂对重组酶NsMan5B活性表现出不同的影响,这与该酶的分子结构特点有直接关系。乙醇在低体积分数条件下对酶活性有一定的促进作用,在高浓度下受到的抑制作用较小,可以用来作为发酵酶液的初步浓缩。
酶制剂在果汁加工生产中的应用显著提高了果汁的出汁率和澄清效果,如果胶酶、纤维素和淀粉酶等酶制剂在果汁加工中的广泛应用[28]。Nadarouglu等[17]对甘露聚糖酶在果汁中的应用进行探索,发现甘露聚糖酶在果汁的澄清中发挥着重要作用,其中对杏汁的作用最为明显,使澄清度从34%提高到47%。本研究发现重组甘露聚糖酶NsMan5B同样对果汁的澄清有提升作用,而对不同品种果汁的澄清效果存在较大的差异,其中对柿子汁的效果最为明显,这很可能与果汁中的物质组成有很大关系[29]。柿子是我国北方山区重要的一种水果,目前,柿子深加工还存在较多困难因素,而可应用于柿子汁加工的酶制剂相关研究较少。重组酶NsMan5B在柿子汁加工的应用潜力还需进一步挖掘,相关的技术参数还需进一步完善。
4 结 论
本研究成功从嗜热真菌Neosartorya sp. HBFH9获得嗜热甘露聚糖酶nsMan5B基因并进行了表达及相关性质的研究,结果表明重组甘露聚糖酶NsMan5B属于嗜热酶,具有较好的pH耐受性,在果汁的澄清中具有较好的应用效果。本研究不仅丰富了甘露聚糖酶资源,同时也为甘露聚糖酶在果汁加工中的应用提供了一定的理论指导。

