牛蒡苷元在仔猪体内的药物动力学研究
何斌,吴利军,陈夏冰,杨文海,邵志勇, 陈洁,金尔光,周华,李杰,刘志伟
(1.武汉市农业科学院畜牧兽医研究所,武汉 430208;2.武汉市动物疫病预防控制中心,武汉 430000)
牛蒡子的主要有效成分为木脂素类化合物,包括牛蒡苷和牛蒡苷元等,牛蒡苷在胃肠道微生物作用下转化为牛蒡苷元发挥药理作用,即牛蒡苷元为牛蒡子的直接有效成分[1-2]。牛蒡苷元具有抗炎[3]、抗病毒[4]、抗菌[5]、抗肿瘤[6]、抗糖尿病[7]等众多药理作用,具有良好的研发和应用前景;试验研究了静脉注射牛蒡甘元在仔猪体内的药物代谢动力学特征,为新兽药的研发和临床用药提供理论依据和参考,为中兽药现代化进行有意义的探索。
1 材料与方法
1.1 材料
1.1.1 药品及配制 牛蒡苷元标准品(批号:160509)含量≥98.1%,由上海融禾医药科技有限公司生产;准确称取牛蒡苷元标准品,甲醇溶解加水定容,制备含牛蒡苷元1.0 mg/mL的标准贮备液;准确称取牛蒡苷元标准品,丙二醇溶解加水定容,制备含牛蒡苷元10.0 mg/mL的注射液。乙腈、甲醇色谱级,购自美国 Themo公司;二氯甲烷、丙二醇等分析纯,购于上海国药集团化学试剂有限公司。
1.1.2 仪器 1200型高效液相色谱仪,自动进样器、紫外检测器,美国AgiLent公司;D3024R 高速离心机,SCILO-GEX公司;电子天平(±0.0001 g),德国赛多利斯公司;N-EVAPTM111型氮吹仪,美国路易公司。
1.1.3 动物 杜×长×大三元仔猪8头,雌雄各半,编号1-8号,体重:30.0±5.0 kg;购于武汉博牧生物科技有限公司。试验前正常饲养观察1周,自由饮水和采食,饲料为不含任何药物的全价日粮。
1.2 方法
1.2.1 药物动力学试验设计 给药前12.0 h 禁食,对每头仔猪进行称重,并采集血样作为空白对照。1~8号仔猪以2.0 mg/kg.bw的牛蒡甘元耳静脉注射给药。静脉注射给药后,每头仔猪于0.167、0.333、0.5、0.75、1.0、1.5、2.0、3.0、4.0、5.0、6.0、8.0、10.0、12.0 h采血5.0 mL左右;所采集血样置于已加肝素钠的聚丙烯离心管中,以3000 r/min离心15.0 min分离血浆,取上清液于-20 ℃冷冻保存,待测定[12]。
1.2.2 色谱条件 色谱柱为AgiLent SB-C18柱 (250 mm×4.6 mm,5 μm);检测波长为280 nm;流动相为甲醇:乙腈:水(31∶20∶49 V∶V∶V);流速为0.8 mL/min;进样量为30 μL;柱温为(30±0.1)℃[8-9]。
1.2.3 血浆样品处理 将血浆样品从-20 ℃冰箱中取出,室温下自然解冻,准确吸取0.5 mL于5.0 mL离心管中,加入2.0 mL二氯甲烷,涡旋振荡60 s后以10 000 r/min离心10.0 min吸取二氯甲烷层,同法提取两次,合并两次二氯甲烷层,置于15.0 mL离心管中,40 ℃水浴氮气吹干,残渣用200 μL流动相溶解,10 000 r/min离心10.0 min,上清液经0.22 μm滤膜过滤后以30 μL进样分析,记录色谱图[10-11]。
1.2.4 血浆标准曲线的建立 向7支5.0 mL聚丙烯离心管中各加入500 μL空白血浆,然后依次加入一系列已稀释好的牛蒡苷元标准工作液,得到药物浓度依次为0.05、0.1、0.25、0.5、1.0、2.5、5.0 μg/mL的血浆样品。分别按照血浆样品处理方法处理,进行HPLC分析,记录色谱图。以测得的牛蒡苷元峰面积(x)为横坐标,浓度(y)为纵坐标,建立血浆标准曲线,拟合回归方程,求出相关系数(r)。
1.2.5 方法学验证 取空白血浆500 μL置于5.0 mL聚丙烯离心管中,然后依次加入已稀释好的牛蒡苷元标准工作液高、中、低三个浓度,充分混合均匀,配制成含牛蒡苷元浓度分别为5.0、1.0、0.1 μg/mL的血浆样品,按照血浆处理方法进行处理,进行HPLC检测分析,每个浓度一天内设置5个平行进行检测,以考察日内变异系数;连续重复检测5 d,以测定日间变异系数。并计算方法的回收率、准确度、精密度以及灵敏度。
1.2.6 猪血浆中药物浓度的测定 将给药后不同时间点获得的血浆,按“血浆样品的处理”方法处理后进行HPLC分析,计算牛蒡苷元的峰面积,代入标准曲线回归方程,计算出血浆中牛蒡苷元的浓度。
1.2.7 数据分析 采用ExceL软件分析处理方法学数据并绘制血浆标准工作曲线及药-时曲线图;药物动力学模型拟合及参数计算均采用中国药理学会数学专业委员会编制的3p97药物动力学软件分析。
2 结果与分析
2.1 牛蒡苷元在血浆中的色谱行为 在本研究所建立的方法下,牛蒡苷元保留时间为14.0 min,峰形对称性良好,基线平稳,与杂质峰分离良好,检测效率高。空白血浆色谱图如图1,空白血浆添加牛蒡苷元(1.0 μg/mL)色谱图如图2,样品(0.55 μg/mL)血浆色谱图如图3。

图1 空白血浆色谱图Fig 1 Chromatogram of blank plasma
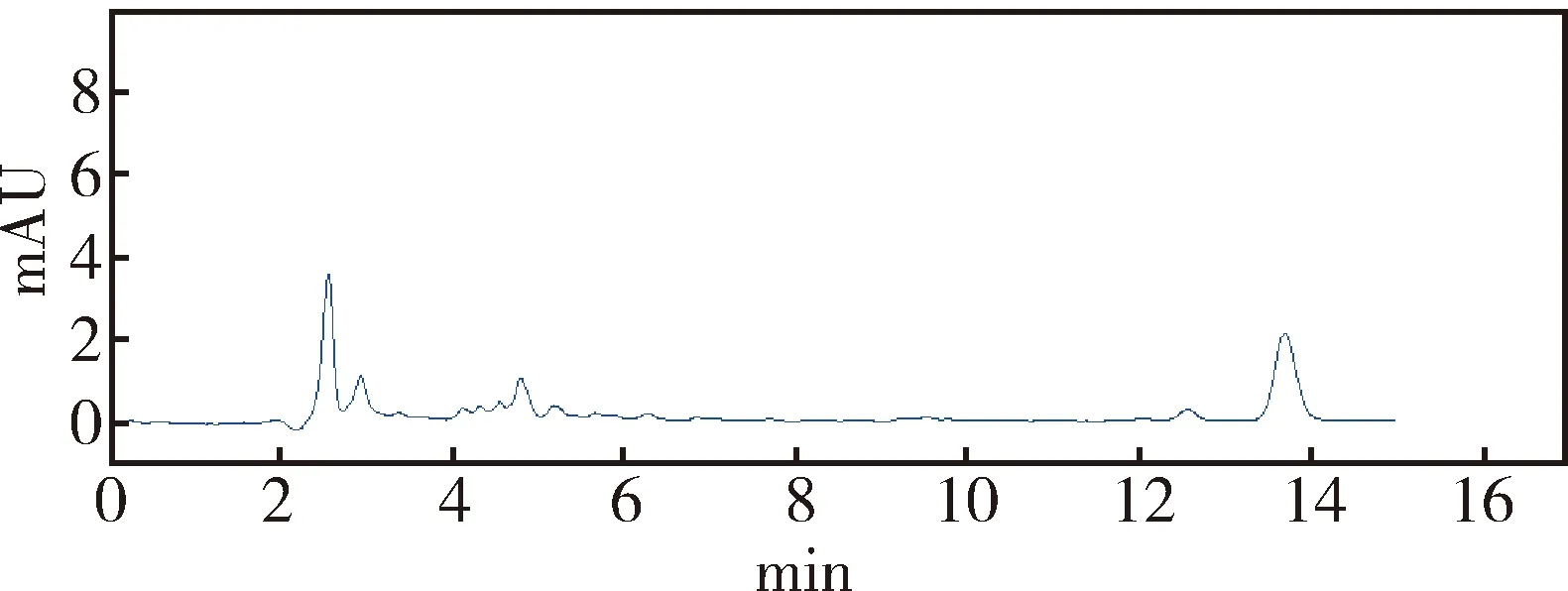
图2 空白血浆中添加牛蒡苷元(1.0 μg/mL)色谱图Fig 2 Chromatogram of plasma with arctigenin (1.0 μ g/mL)

图3 给药后血浆中牛蒡苷元(0.55μg/mL)色谱图Fig 3 Chromatogram of arctigenin in plasma (0.55 μg/mL) after administration
2.2 血浆标准工作曲线 由图4可知,牛蒡苷元标准品在0.05~10.0 μg/mL范围内线性关系良好,相关系数r=0.9998,线性方程为y=0.0265x-0.0328(x表示牛蒡苷元的峰面积;y表示牛蒡苷元在血浆中的浓度)。
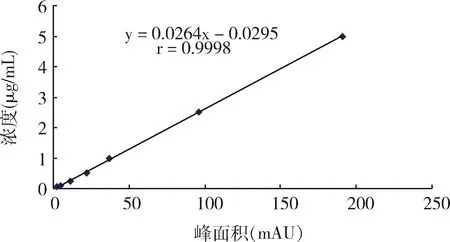
图4 牛蒡苷元在血浆中标准工作曲线Fig 4 Calibration curve of arctigenin in piglet plasma
2.3 方法学验证结果 由表1和表2可知,牛蒡苷元在仔猪血浆中的最低检测限为0.025 μg/mL,最低定量限为0.05 μg/mL。牛蒡苷元在0.05~5.0 μg/mL范围内线性关系良好,回归方程为y=0.0264x-0.0295,相关系数为r=0.9998。该方法回收率大于83.35%,日内变异系数均在3.51%以内,日间变异系数均在5.90%以内
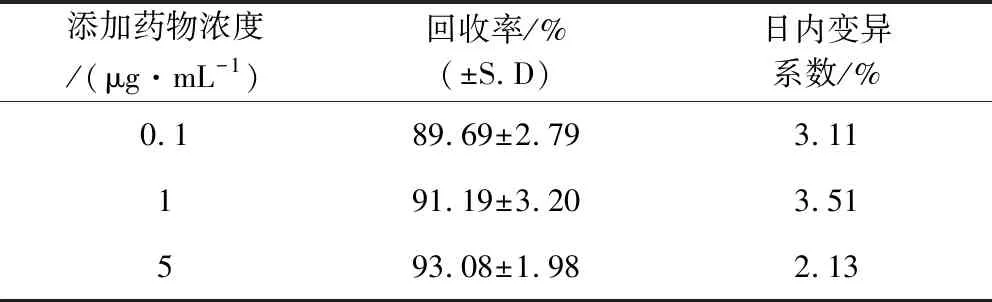
表1 仔猪空白血浆中添加ACT的回收率和 日内变异系数考察结果(n=5)Tab 1 Intra-day recovery and precision vaLues for the determination of ACT in pig plasma(n=5)

表2 仔猪空白血浆中添加ACT的回收率和 日间变异系数考察结果(n=5)Tab 2 Inter-day recovery and precision values for the determination of ACT in pig plasma(n=5)
2.4 药物动力学试验结果 单剂量静脉注射牛蒡苷元(2.0 mg/kg.bw)后,在仔猪体内的血药浓度如表3,主要药物动力学参数如表4,血药浓度-时间曲线如图5。
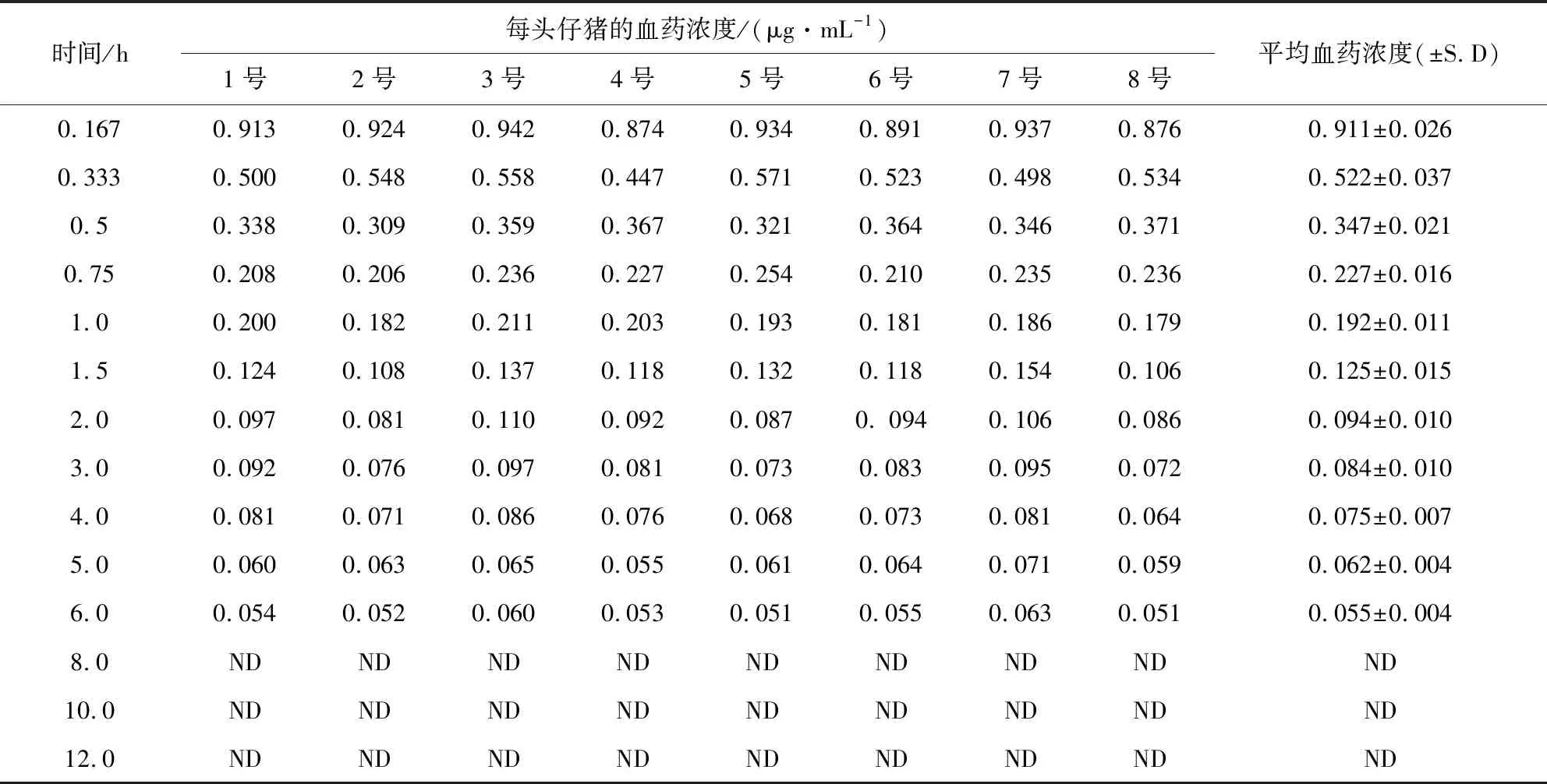
表3 静脉注射牛蒡苷元(2.0 mg/kg.bw)后在仔猪体内的血药浓度Tab 3 Blood concentration of arctigenin in piglets after intravenous injection (2.0 mg/kg.bw)
ND表示未检出
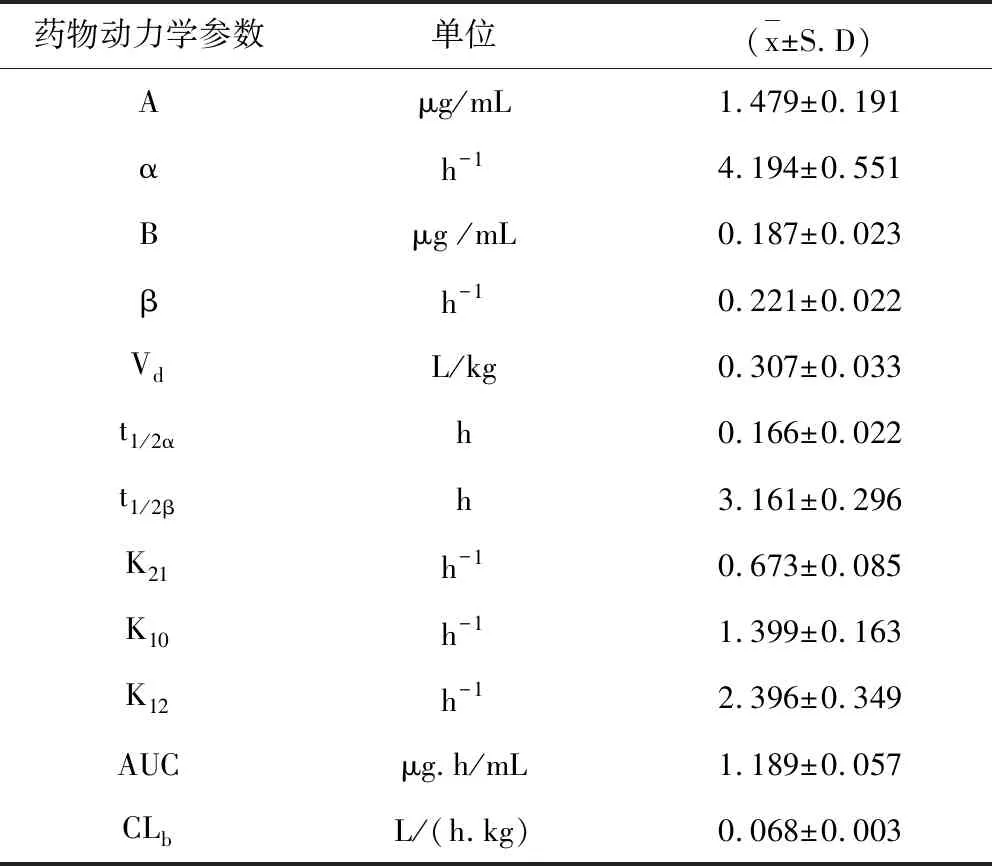
表4 静脉注射牛蒡苷元(2.0 mg/kg.bw) 后在仔猪体内的药物动力学参数Tab 4 Pharmacokinetic parameters of arctigenin (2.0 mg/kg.bw) in piglets after intravenous injection
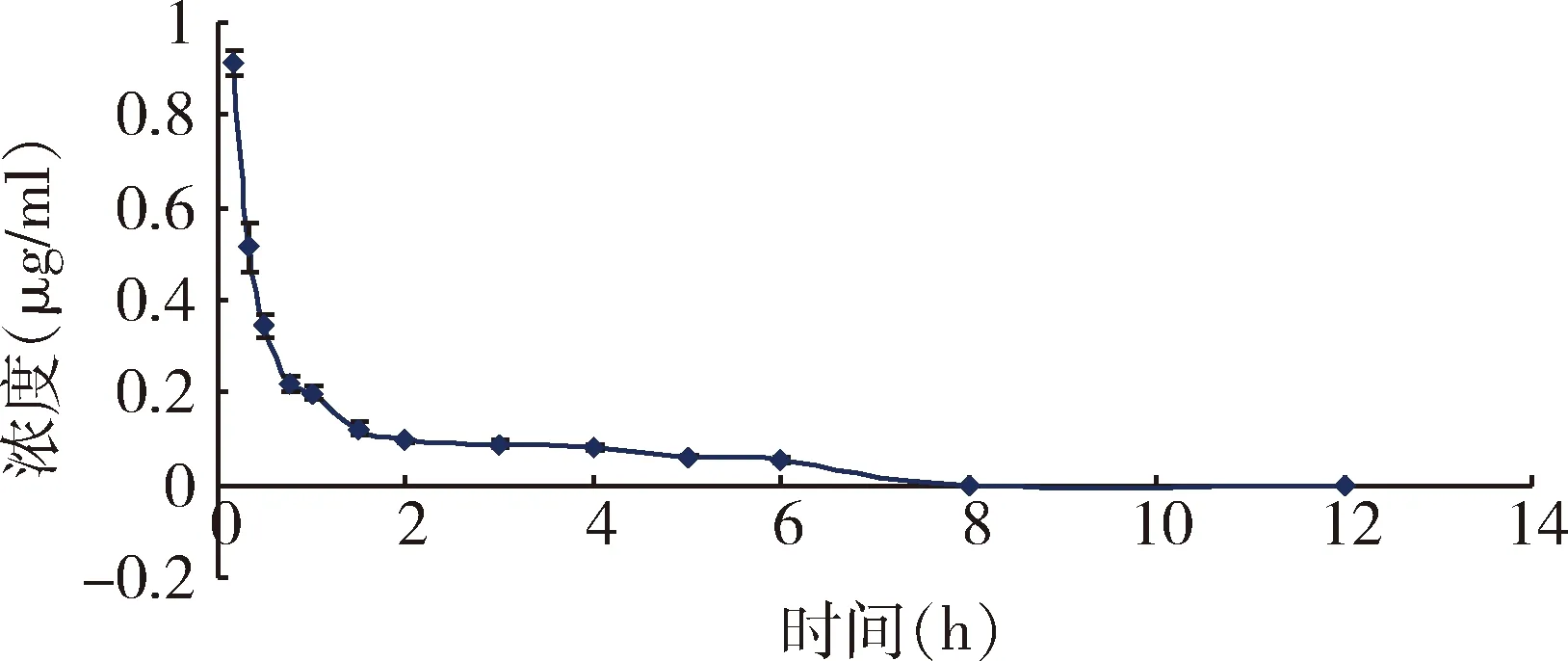
图5 静脉注射牛蒡苷元(2mg/kg)后在 仔猪体内的血药浓度-时间曲线Fig 5 Blood concentration-time curve of arctigenin in piglets after intravenous injection (2.0 mg/kg)
静脉注射牛蒡苷元后,牛蒡苷元仔猪体内的分布半衰期(t1/2α)为0.166±0.022 h、消除半衰期t1/2β为3.161±0.296 h,表观分布容积(Vd)为0.231±0.033 L/kg,药时曲线下面积(AUC)1.189±0.057μg·h·mL-1。
3 讨论与结论
牛蒡苷元的色谱条件目前报道不多。在检测波长方面,选择280 nm作为紫外检测波长。关于流动相的选择文献报道的主要有以下几种:乙腈:水(V∶V,32∶68)[8];甲醇 ∶乙腈∶0.025 mol/L磷酸(V∶V∶V,40∶20∶40)[13];甲醇 ∶0.5%磷酸水(V∶V,48∶52)[14];甲醇 ∶乙腈 ∶水(V∶V∶V,40∶20∶40)[10];甲醇 ∶水(V∶V,55∶45)[9]。在试验过程中,对以上流动相均进行了试验研究,发现V(甲醇)∶V(水)=55∶45作为流动相,牛蒡苷元的出峰时间较理想、峰型较好且与杂质峰分离良好,但有时存在基线不稳的情况;分析可能是甲醇和水在40%~60%的范围内由仪器自动混合时极易产生气泡,导致基线不稳,故对流动相稍作更改,在流动相中加入乙腈,并不断调整各流动相的比例,最终确定流动相为甲醇 ∶乙腈 ∶水=31∶20∶49(V∶V∶V)时出峰时间理想,峰形较好,且与杂质峰良好分离。
给仔猪静脉注射牛蒡苷元后,牛蒡苷元仔猪体内的血药浓度-时间数据符合无吸收二室模型,与吕佳报道[10]的家兔静注牛蒡苷元无吸收单室模型有一定的差异;在仔猪体内的分布半衰期t1/2α(0.166±0.022 h)较短,表观分布容积Vd(0.307±0.033 L/kg)相对较小,表明静注后牛蒡苷元在仔猪体内分布极为迅速,但分布组织相对较少,可能主要分布在主要分布在血液和细胞外液中[12];消除半衰期t1/2β(3.161±0.296 h)相对较短,较家兔静注牛蒡苷元0.87 h的消除半衰期长,可能与动物种属有一定关系,表明牛蒡苷元静脉注射后在仔猪体内消除代谢也相对较快,与其分布组织较少有一定关系。
研究采用HLPC建立了仔猪血浆中牛蒡苷元的定量分析方法,该方法具有灵敏度高、特异性强、检测时间短等特点,可应用于牛蒡苷元新兽药的临床前药物动力学研究。研究了牛蒡苷元在仔猪体内的药物动力学特征。结果表明:静脉注射牛蒡苷元后,其在仔猪体内的为无吸收二室模型,在仔猪组织中分布较少,半衰期短、能迅速从仔猪血液中清除,发挥药物作用时间较短,建议临床使用时应适当增加用药次数。

