鸡血浆中乙酰氨基阿维菌素HPLC检测法的 建立及口服给药后的药代动力学研究
许晓琳,潘婷婷,张树栋,王传文,潘保良*
(1. 中国农业大学动物医学院,北京 100193;2. 北京市药品检验所,北京 102206)
乙酰氨基阿维菌素(eprinomectin,EPR)是一种高效、广谱、低残留的兽用新一代驱虫药物[1-2],主要用于防治家畜(特别是泌乳家畜)的外寄生虫(蜱、虱、螨、蝇)和内寄生虫(各种线虫)的感染[3-5]。该药应用于奶牛和肉牛时无需休药期[6]。但该药应用于禽类寄生虫的防控尚未见报道。鸡皮刺螨是蛋鸡养殖中最常见、危害最严重的外寄生虫病,但传统的药物防治存在不彻底、耐药性等问题。本实验室前期研究EPR对鸡皮刺螨的防控作用发现,5 mg/kg的给药剂量可达到100%的杀螨效率[7],为了更好地了解EPR在鸡体内的药代动力学特征,本研究建立了鸡血浆中EPR浓度测定的荧光HPLC检测方法,并对其在鸡体内的药代动力学进行了研究,为EPR的制剂开发及在鸡皮刺螨防治中的临床应用提供科学依据。
1 试验材料
1.1 主要仪器与设备 Waters 2695高效液相色谱仪,配有Waters 2475 荧光检测器(Waters 公司);SunFireTMC18反相色谱柱(4.6×150 mm,5 μm;Waters 公司);Sep-Pak C18固相萃取柱(Waters 公司);DT5-2型离心机(北京时代北利离心机有限公司);OA-SYS型氮吹仪(Organomation Associates 公司);涡动仪(北京方正生物技术发展有限公司);Sartorius BP310s电子天平(Sartorius公司)。
1.2 试剂与药品 EPR标准品,纯度94.5%,批号:G157148,购自德国Dr.Ehrenstorfer公司;色谱纯的乙腈、甲醇(德国Merck-KGaA),N-甲基咪唑、三氟乙酸酐(百灵威),色谱纯的冰乙酸、三乙胺(阿拉丁);蒸馏水(屈臣氏集团)。
1.3 试验动物 6只白羽蛋鸡,体重1.3~1.7 kg,年龄为20~22周。所有鸡均没有使用过EPR等药物,鸡在鸡舍内自由饮水、采食,在试验前适应一周,并采血检测,确定血浆中没有EPR。试验前16 h及给药后6 h内禁食禁水。
2 试验方法
2.1 溶液制备
2.1.2 衍生化试剂的制备 A 液:N-甲基咪唑+乙腈(2+7,V/V);B液:三氟乙酸酐+乙腈(2+7,V/V),A液与B液均现用现配。
2.1.3 EPR口服溶液的制备 EPR溶解于乙醇中,以乙醇:吐温80:PBS(pH=7.4)=40:2:58的比例配置2 mg/mL的EPR溶液。
2.2 EPR的荧光HPLC检测方法的建立
2.2.1 血浆样品的前处理
2.2.1.1 EPR的提取与纯化 取空白鸡血浆450 μL,加入50 μL EPR标准系列工作液,加入3 mL乙腈涡动混匀2 min,超声10 min,4000 r/min离心20 min,将上清液转移至新离心管中,下层残渣用3 mL乙腈重复提取一次,合并上清液。上清液中加入9 mL蒸馏水稀释并混匀。将稀释的上清液通过活化的ODS-C18固相萃取柱(先用3 mL甲醇进行活化,然后用超纯水淋洗,再用3 mL 70%甲醇水溶液进行平衡),依次用3 mL蒸馏水和3 mL 70%甲醇水溶液进行淋洗,吹干后,使用4 mL甲醇(分3次,分别为2、1、1 mL)进行洗脱。收集洗脱液,使用氮吹仪将液体吹干。
2.2.1.2 荧光衍生化 向干燥的样品中依次加入200 μL A液、200 μL B液、45 μL冰醋酸和45 μL三乙胺,涡动混匀后将其置于65 ℃真空干燥箱内反应30 min,再依次置于4 ℃冰箱3 min、室温12 min。用流动相定容至1 mL,混匀后过0.22 μm有机滤膜,滤液供HPLC分析。
2.2.2 色谱条件 色谱柱: SunFireTMC18 反相色谱柱;荧光检测波长:激发波长365 nm,发射波长463 nm;流动相:甲醇:乙腈:水= 63:32:5(V/V/V);流速:1.0 mL/min;柱温:35 ℃;进样量:20 μL;检测时间:12 min。
2.2.3 标准曲线的绘制 取鸡空白血浆450 μL于离心管中,然后加入不同浓度的EPR标准系列工作液50 μL,使其浓度为0.1、0.5、1、5、10、20、50、100 ng/mL,参考方法2.2.1项与2.2.2项进行血浆样品的处理与HPLC检测分析。每个浓度设3个重复,绘制出浓度-峰面积标准曲线。
该煤炭企业风选项目初步方案是,从煤场第一部振动筛下出料口将8cm以下原煤引入风选设备中,经风选系统排矸后精煤再返回原煤场筛分第二部振动筛内,依次分级为中块(5-8cm)、小块(2-5cm)、粒煤(1-3cm)和末煤。风选系统与原煤筛分系统有机结合,原煤筛分系统可以单独运行,也可以与风选系统搭配使用。
2.2.4 方法学验证
2.2.4.1 准确度与精密度的测定 使用EPR标准系列工作液配置低、中、高三种血浆浓度添加水平,即0.5、10、100 ng/mL三种血浆添加浓度,同时配置0.5、10、100 ng/mL的标准溶液。添加标准工作液的鸡血浆样品经过前处理、衍生化后进行HPLC检测,测出峰面积;标准溶液直接经氮吹仪吹干、衍生化与HPLC检测,测出对应的药物峰面积。每个浓度设5个重复,测3个批次,计算批内和批间的变异系数(RSD)。
2.2.4.2 检测限与定量限 取鸡空白血浆5份,参考方法2.2.1项与2.2.2项对样品进行处理与HPLC检测,测得对应保留时间位置背景信号(噪音)的标准偏差,按信噪比(S/N)为3计算,求得各个样品检测方法的检测限(LOD)。以S/N=10,计算定量限(LOQ)。
2.3 药物代谢动力学试验
2.3.1 给药与采集血样 在试验前对试验动物称重,以5 mg/kg的给药剂量灌服EPR溶液,在给药后0.25、0.5、0.75、1、1.5、2、2.5、3、4、6、8、12、24、36 h进行翅下静脉采血,12000 r/min离心10 min分离血浆,-20 ℃冰箱保存备用。由于本试验中给药剂量较大,为了准确的检测鸡血浆中的EPR,对血浆进行了稀释处理。
2.3.2 鸡血浆中EPR的浓度测定 取恢复至室温的鸡血浆500 μL,对血浆中的EPR进行提取、纯化与衍生化,定容后过滤膜,进行HPLC分析。方法参照2.2.1项与2.2.2项。
2.3.3 数据处理 将测得的各个血样的HPLC检测值,使用Waters仪器提供的Empower3软件分析,计算出各个血浆样品中EPR的浓度,绘制出样品的时间-药物浓度散点图。
采用WinNinlin5.2.1(Pharsight Corporation, Mountain View, CA, USA)分析软件对样品的时间-药物浓度曲线进行模拟分析,以非房室模型分析方法对药代数据进行分析,并求出相应的药物代谢动力学参数。
3 结果与分析
3.1 标准曲线 血浆中EPR浓度-HPLC吸收峰面积标准曲线见图1。在浓度为0.1~100 ng/mL添加范围内,EPR峰面积与浓度呈线性相关。其线性回归方程为:Y=123938X+23011,相关系数r=0.9999。

图1 EPR标准曲线图(0.1~100 ng/mL)Fig 1 Standard curve for EPR (0.1~100 ng/mL)
3.2 准确度与精密度 在鸡血浆中,3个浓度、3个批次的添加回收率和变异系数(RSD)见表1。EPR在鸡血浆中的添加水平为0.5、10、100 ng/mL时,平均回收率在90.55%~101.30%之间,批内RSD在2.81%~8.02%之间,批间RSD在4.32%~5.83%之间,表明该方法准确度、精密度高,重复性好,可达到分析要求。
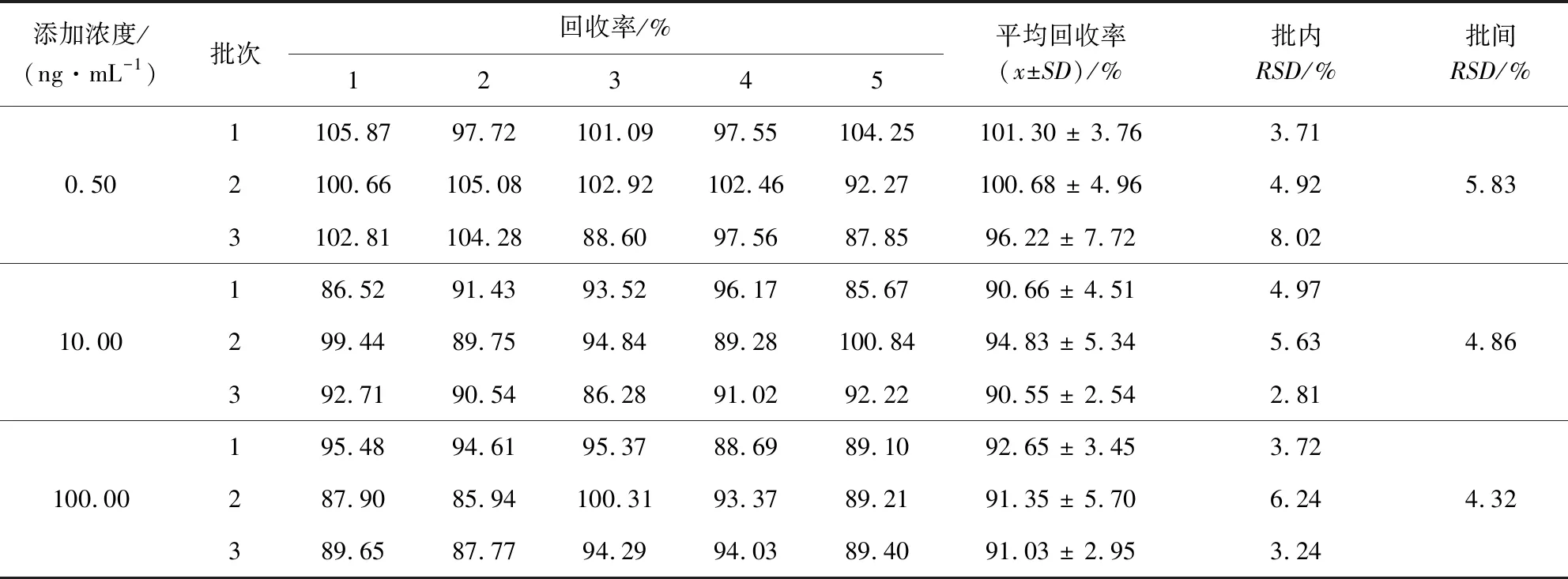
表1 回收率试验结果Tab 1 Results of recovery tests
3.3 检测限与定量限 通过添加试验确定本方法的EPR的LOD和LOQ分别为0.1 ng/mL和0.3 ng/mL。
3.4 荧光HPLC色谱分析 EPR标准工作液(10 ng/mL)色谱图如图2。鸡空白血浆以及向空白血浆中添加EPR标准工作液(10 ng/mL)的色谱图分别见图3、图4。EPR的保留时间为7.6 min左右,色谱峰分离良好、对称性好,EPR峰周围无明显干扰峰,达到了检测的要求。
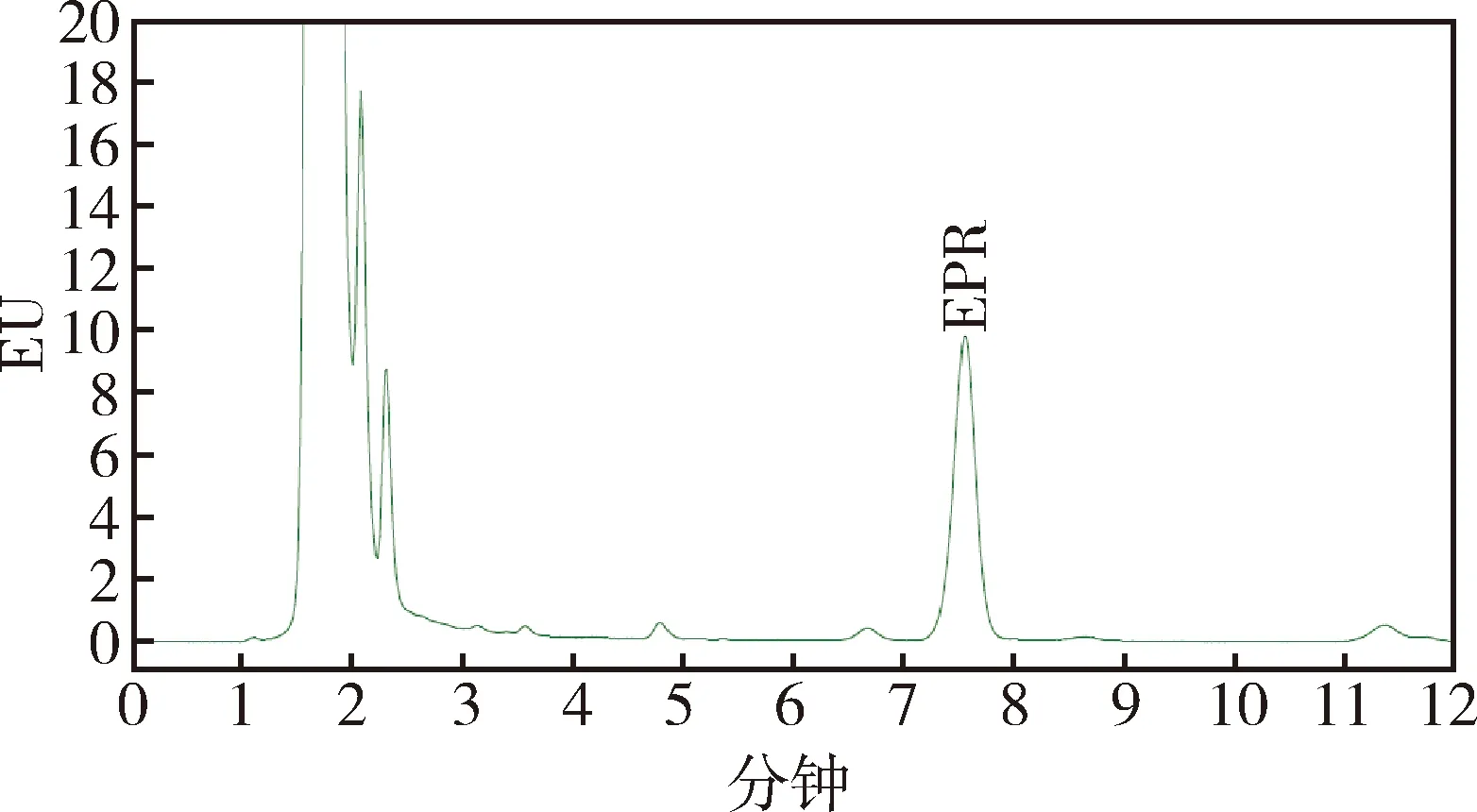
图2 EPR标准工作液色谱图(10 ng/mL)Fig 2 Chromatogram of EPR standard solution (10 ng/mL)

图3 鸡空白血浆色谱图Fig 3 Chromatogram of chicken plasma solution

图4 鸡血浆添加EPR标准工作液色谱图(10 ng/mL)Fig 4 Chromatogram of chicken plasma solution with EPR standard solution (10 ng/mL)
3.5 EPR溶液在鸡体内的药代结果 鸡口服5 mg/kg的EPR溶液后,血浆样品的时间-EPR药物平均浓度散点图见图5,鸡血浆样品药代动力学参数见表2。在给药后1.58 ± 0.38 h,EPR溶液在鸡体内的最大血药浓度(Cmax)为354.27 ± 65.99 ng/mL,消除半衰期(T1/2el)为5.52 ± 1.67 h,曲线下面积AUC0-t为2306.55 ± 531.82 ng/mL,AUC0-∞为2348.53 ± 547.16 ng/mL,平均滞留时间(MRT)为6.40 ± 1.03 h。

图5 血浆样品的时间-EPR药物平均浓度散点图(5 mg/kg)Fig 5 Concentration-time profile of EPR in plasma (5 mg/kg)

参数值(x±SD)Cmax/(ng·mL-1)354.27±65.99Tmax/h1.58±0.38AUC0-t/(ng·h·mL-1)2306.55 ± 531.82AUC0-∞2348.53±547.16MRT/h6.40±1.03T1/2el/h5.52±1.67
Cmax为最大药物浓度,Tmax为到达最大药物浓度的时间,T1/2el为消除半衰期,AUC0-t为时间从0到所选择的最后一个时间点时曲线下面积,AUC0-∞为时间从0到无穷期间的曲线下面积,MRT为药物的平均滞留时间
4 讨论与结论
自EPR开发上市以来,围绕药物开展了制剂研发、检测方法的建立与优化、药效试验与药代试验等研究。目前,EPR浇泼剂、注射剂与口服糊剂等广泛应用于肉牛、奶牛、羊、兔等动物,EPR在相应动物体内的药物代谢动力学研究已有报道,但EPR在家禽上的应用较少,以及EPR在家禽体内的药代动力学研究还未有报道。本研究为了探讨EPR在鸡体内药代动力学过程,成功建立了鸡血浆中EPR的荧光HPLC检测方法,并进行了鸡体内EPR药代动力学研究。
鸡血浆中EPR的荧光HPLC方法建立,在Dannher等[8]建立的衍生化方法、潘保良等[9]建立的牛奶中EPR的HPLC检测方法基础上进行了改进,用N-甲基咪唑和三氟乙酸酐作为衍生化试剂,加入冰醋酸后,又尝试加入三乙胺[10],使EPR的衍生化方法趋于稳定,衍生化产物在22 h内不发生明显的降解,解决了衍生化产物不稳定的问题。此外,EPR色谱峰分离良好,峰周围无明显干扰峰,满足检测要求。
在药代动力学研究中,根据药代动力学参数可知,EPR溶液经口服给鸡后,在1.58 h(Tmax)就达到了血药浓度峰值(354.27 ng/mL,Cmax),提示EPR在鸡体内吸收与分布迅速;EPR在鸡血浆中的消除半衰期为5.52 h(T1/2el),平均滞留时间为6.40 h(MRT),说明EPR在鸡体内消除较快。EPR在鸡体内吸收分布迅速、消除快的特点与阿维菌素类药物在哺乳动物体内的药代的吸收代谢特征存在明显区别。据报道,EPR浇泼剂(0.5 mg/kg)用于绵羊时,在给药后3.13 d可达到最大血药浓度6.20 ng/mL,消除半衰期为6.40 d[11]。EPR口服糊剂(0.2 mg/kg)用于泌乳期奶牛时,在给药后1.60 d达到最大血药浓度30.02 ng/mL,平均滞留时间为3 d,消除半衰期为1.24 d[12]。EPR注射液(0.2 mg/kg)在泌乳奶牛体内的药代动力学研究结果显示:在血浆中,EPR在给药后39 h达到最大药物浓度44.0 ng/mL,消除半衰期为164.0 h,平均滞留时间为211 h[13]。通过试验数据对比,可以发现,EPR在鸡体内的吸收分布与消除均明显快于EPR在哺乳动物[14-15]体内的代谢情况。与EPR同属于阿维菌素类药物的伊维菌素(IVM)在家禽和哺乳动物中的药代动力学特征也存在类似的区别。IVM在羊体内的药代结果显示[16],羊皮下注射或口服IVM后,分别在60.0和16.4 h达到最大血药浓度30.8和22.0 ng/mL,消除半衰期分别为88.4和10.1 h。而给鸡静脉注射、皮下注射或口服IVM后,在血浆中可达到的最大血药浓度分别为316.0 ng/mL、82.9 ng/mL(Tmax=6 h)和10.2 ng/mL(Tmax=3.36 h),消除半衰期分别为0.37、1.45和0.23 d[17],其吸收和药物代谢速度明显快于哺乳动物。IVM、EPR在哺乳动物和鸡体内的药代结果表明阿维菌素类药物在鸡体内具有吸收分布迅速、消除快的药代动力学特征。将药代结果与前期EPR对鸡皮刺螨的杀螨效率试验[7]相结合可推测,在临床应用中,EPR需要通过多次给药以达到彻底清除鸡螨虫的目的。此外,由于EPR在鸡血浆中代谢消除快,可以有效避免药物残留造成的安全问题,但EPR在鸡不同组织、蛋中的药物残留还未知,因此需要开展相关试验来确定EPR在鸡体、蛋中的残留消除规律。
本研究首次建立了鸡血浆中EPR的HPLC检测方法,并开展了EPR在鸡体内的药代动力学研究,为EPR防治鸡螨虫新制剂研制与临床应用提供了理论依据。

