BALB/c小鼠、SD大鼠及食蟹猴淋巴细胞亚群参考值的建立
姜 华,文海若,刘 丽,王亚楠,李路路,刘晓萌,李 伟,王 欣,周晓冰,王三龙,霍 艳
(中国食品药品检定研究院 国家药物安全评价监测中心,药物非临床安全评价研究北京市重点实验室,北京 100176)
生物制品在创新药物研发中占据重要地位,在全球最畅销的药物排行榜中占据半壁江山。生物制品的主要药理作用是通过刺激机体免疫系统产生免疫物质来激活人体免疫系统[1-2]。免疫系统功能异常可导致感染及肿瘤性病变,严重时可危及生命。药物免疫毒性是当前仅次于肝毒性的全球第二大新药召回原因,故生物制品的免疫毒性风险是其安全性评价的重要关注点[3]。淋巴细胞表面的跨膜糖蛋白以表面受体的形式,可特异性识别并参与机体抗原呈递过程,并参与免疫调节功能。如T淋巴细胞中CD4+和CD8+表型的数值变化常用于监测肿瘤、和获得性免疫缺陷综合症(acquired immune deficiency syndrome, AIDS)等与免疫功能有关的疾病的发生与发展[4-6]。使用流式细胞术分类计数淋巴细胞亚群已成为非临床安全性评价中常规的免疫毒性评价手段之一。常见的淋巴细胞亚群分类包括CD3+CD4+、CD3+CD8+与CD3-CD20+细胞等[7]。
小鼠、大鼠和食蟹猴均为常用的安全性评价动物模型。使用标准化的样本制备方法,在符合药物非临床研究质量管理规范(Good Laboratory Practice,GLP)试验条件下建立淋巴细胞亚群分类背景数据,有助于研究和监管者了解数值变化范围,对动物免疫毒性作合理评估[8]。当前国内食蟹猴外周血淋巴细胞亚群流式检测参考值相关文献已有数篇报道[8-11],但数据涉及动物数量有限(不超过100只)或仅分析单一性别,仅有一篇为由安评机构汇总的基于多年大量动物的背景数据[8]。此外,大鼠及小鼠淋巴细胞亚群流式检测参考值相关报道较少,因不同品系的大鼠和小鼠其背景值范围也有所差异,有必要在安评机构中建立基于大量动物样本数的淋巴细胞亚群的背景值范围。本研究收集国家药物安全评价监测中心2007年至2019年在GLP条件下开展的生物制品安全性评价研究中未给药组或溶媒组的BALB/c小鼠、SD大鼠和食蟹猴(广西或北京)的CD3+CD4+、CD3+CD8+和CD3-CD20+(仅食蟹猴)检测值,根据动物性别不同分别汇总以确定不同种属动物淋巴细胞亚群的参考值,为生物技术类药物的免疫毒性评价提供参考依据。
1 材料和方法
1.1 实验动物
SPF/VAF级BALB/c小鼠共303只(来自10项研究),SPF/VAF级SD大鼠共359只(来自11项研究),雌雄各半(购入时约5~9周龄),小鼠体重范围约25~40 g,大鼠体重约300~400 g,均购自北京维通利华实验动物技术有限公司[SCXK (京)2002-0003][SCXK (京)2012-0001][SCXK (京)2016-0011]。动物饲养于本中心[SYXK (京)2011-0037][SYXK (京)2016-0045]屏障系统的大鼠笼具(长×宽×高: 460 mm×315 mm×210 mm)和小鼠笼具(长×宽×高: 350 mm×140 mm×136 mm)内,饲养密度为2~3只/笼。给予鼠全价颗粒饲料喂养,自由摄食及饮水。大鼠和小鼠饲养于恒温(20℃~26℃)、恒湿(40%~70%)的条件下,明暗周期为12 h,每小时最低换气次数15次。
普通级食蟹猴共460只,雌雄各半(购入时约3~4岁,体重约3~5 kg,来自共12项研究),购自广西桂东灵长类开发实验有限公司[SCXK (桂)2011-0001][SCXK (桂)2016-0001]或北京协尔鑫生物资源研究所有限责任公司[SCXK (京)2015-0011]。饲养于本中心[SYXK (京)2011-0037][SYXK (京)2016-0045]普通级动物房不锈钢笼具内(长×宽×高:80 cm×70 cm×75 cm),单笼饲养。动物自由饮水,每只动物每天定量给料和水果各150 g,自由摄取。食蟹猴饲养于恒温(16℃~26℃)、恒湿(40%~70%)的条件下,明暗周期为12 h,每次小时最低换气次数8次。
所有研究方案均通过国家药物安全评价监测中心实验动物福利伦理委员会(institutional animal care and use committee, IACUC)的伦理审查(IACUC编号为:IACUC-2008-023、IACUC-2010-008、IACUC-2013-031、IACUC-2014-068、IACUC-2015-028、IACUC-2016-005、IACUC-2017-005、IACUC-2018-001、IACUC-2018-058,等等),并按实验动物使用的3R原则给予人道的关怀。
1.2 主要试剂与仪器
主要试剂包括流式仪校准微球(BD CalibriteTM3-color,批号:7347634、APC bead,批号:80129)、BALB/c小鼠用抗体FITC-CD8a(Clone 53-6.7,批号:3177592,8152865)、PerCP-CD4(Clone RM4-5,批号:8025572,8194889,8025572)、Hamster抗Mouse PE-CD3e(Clone 145-2C11,批号:6012949,7158744)和食蟹猴用抗体FITC-CD8(Clone RPA-T8,批号:5341673,5159821)、PE-CD4(Clone L200,批号:7299836,5313876,5057543)、PerCP-CD3(Clone SP34-2,批号:8124735,6092584,7069961)和APC-CD20(Clone 2H7,批号:3291627)均购自BD公司;SD大鼠用抗体CD3-FITC/CD4-RPE(Clone IF4:W3/25,批号:1113),CD8ALPHA:Alexa Fluor647(Clone OX-8,批号:0310)购自BIO-RAD;红细胞裂解液主要成分:氯化氨(批号:20161208)、碳酸氢钾(批号:20150924)和乙二胺四乙酸二钠(批号:20140328)购自国药集团,磷酸盐缓冲液(PBS批号:AD2016267,AD22391274)购自Hyclone;多聚甲醛(批号:20170825)购自国药集团,使用前经PBS稀释为1%的应用液。主要仪器包括BD FACSCalibur流式细胞仪,分析软件Cell QuestTMPro;H-500FRS高速离心机。
1.3 检测方法
1.3.1 血样采集
本研究收录动物数据均来自未给药动物或生物制品溶媒对照组动物数据,全部动物采血前过夜禁食。啮齿类动物腹腔注射戊巴比妥钠(45 mg/kg)麻醉后经腹主静脉采血,食蟹猴不麻醉由前臂静脉采血。全部动物采集全血0.3~0.5 mL,血样于肝素钠抗凝管中混匀,所有样本在采集后4 h之内完成制备与测定分析。
1.3.2 检测流程
将各相应荧光抗体组合和50 μL抗凝全血加入流式管中,混匀样本后于室温、避光条件下孵育30分钟。在流式管中分别加入1 mL的红细胞裂解液并混匀,小鼠和大鼠样本的裂解时间通常为1~3 min,食蟹猴样本约4~9 min。红细胞充分裂解后,以1000 r/min离心5 min,弃上清并加入1 mL PBS再次离心(离心条件同上)并弃上清。每管加入1%多聚甲醛重悬细胞后上机测定。小鼠和大鼠样本共收集3000~5000个淋巴细胞,食蟹猴共收集5000个淋巴细胞。分别计算表达CD3+CD4+、CD3+CD8+、CD4+/CD8+和CD3-CD20+(仅食蟹猴)的淋巴细胞百分率。
1.4 统计学方法
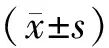
2 结果
雄性和雌性BALB/c小鼠外周血CD3+CD4+、CD3+CD8+和CD4+/CD8+淋巴细胞范围(表1),雄性的结果分别为45.45%~85.86%、12.73%~42.48%、1.07~6.74;雌性为53.27%~84.15%、8.95%~37.49%、1.42±8.59。雄性和雌性SD大鼠平均CD3+CD4+、CD3+CD8+和CD4+/CD8+范围(表2),雄性的结果分别为48.26%~84.53%、16.35%~62.75%、0.99~8.78;雌性为34.06%~86.24%、7.39%~62.75%、0.54±11.67。约3~4岁龄雄性和雌性食蟹猴CD3+CD4+、CD3+CD8+、CD4+/CD8+和CD3-CD20+范围(表3),雄性的结果分别为28.42%~72.83%、23.93%~65.32%、0.44±3.04、1.40%~47.91%;雌性为22.70%~75.90%、17.43%~65.13%、0.35±4.22、9.6%~51.99%。
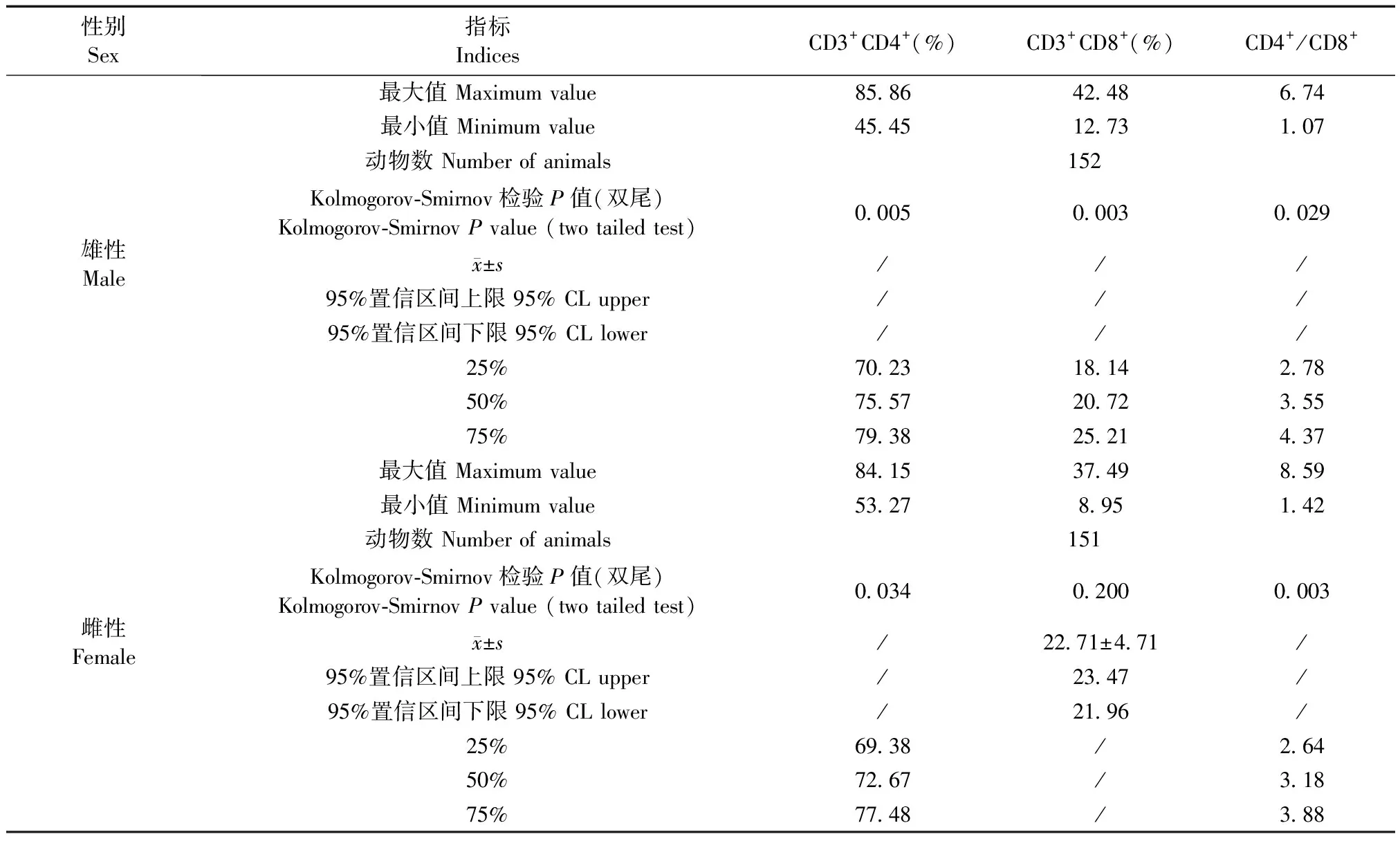
表1 BALB/c小鼠T淋巴细胞亚群参考范围

表2 SD大鼠T淋巴细胞亚群参考范围

表3 食蟹猴淋巴细胞亚群参考范围
上述背景数值分布范围较广,故对不同种属及性别动物的淋巴细胞亚群分布情况作进一步分析汇总。BALB/c小鼠的CD3+CD4+数值分布集中于60%~80%,CD3+CD8+分布多集中于15%~35%,CD4+/CD8+比值集中于1.5~4.5的区间范围(表4);SD大鼠的CD3+CD4+数值分布集中于60%~80%,CD3+CD8+分布集中于25%~45%,CD4+/CD8+比值多集中于1.5~4.5的区间范围(表5);食蟹猴的CD3+CD4+分布集中于40%~60%,CD3+CD8+分布多集中于30%~50%,CD4+/CD8+比值多集中于1.0~2.0,CD3-CD20+分布多集中于10%~30%(表6)。上述分布情况未见性别差异。
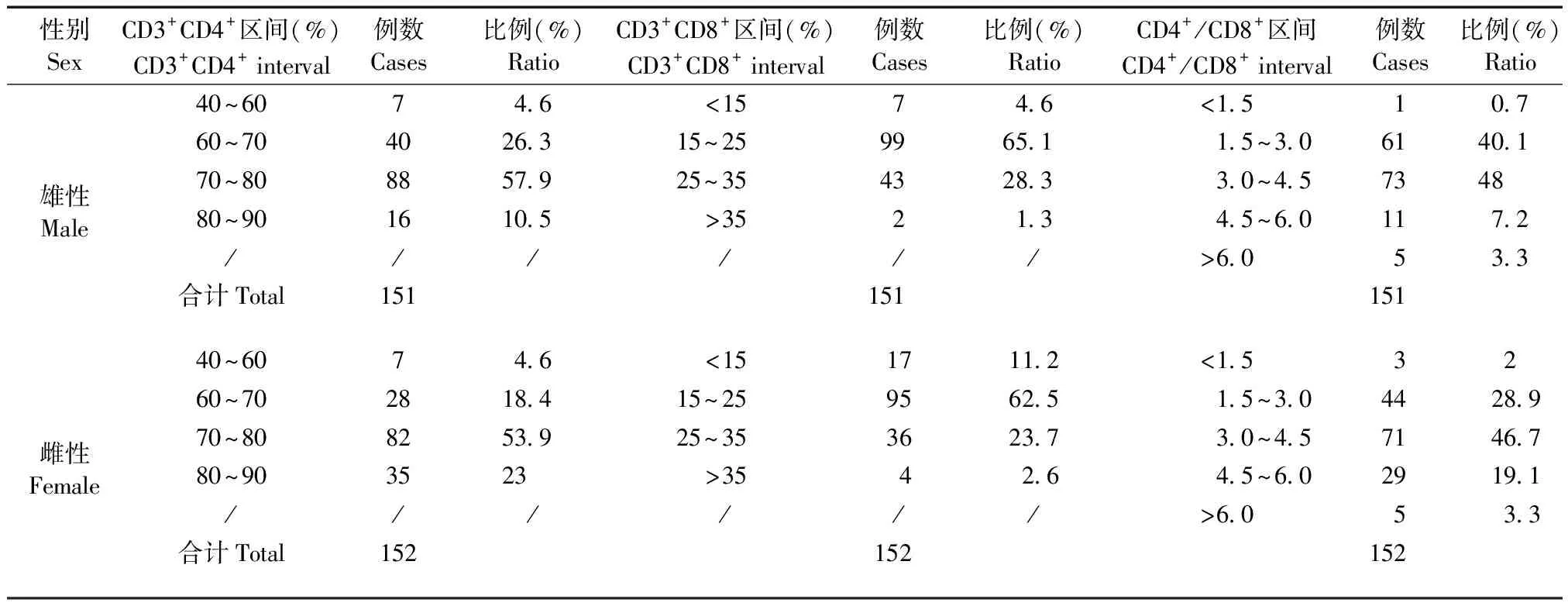
表4 BALB/c小鼠淋巴细胞亚群总体分布情况
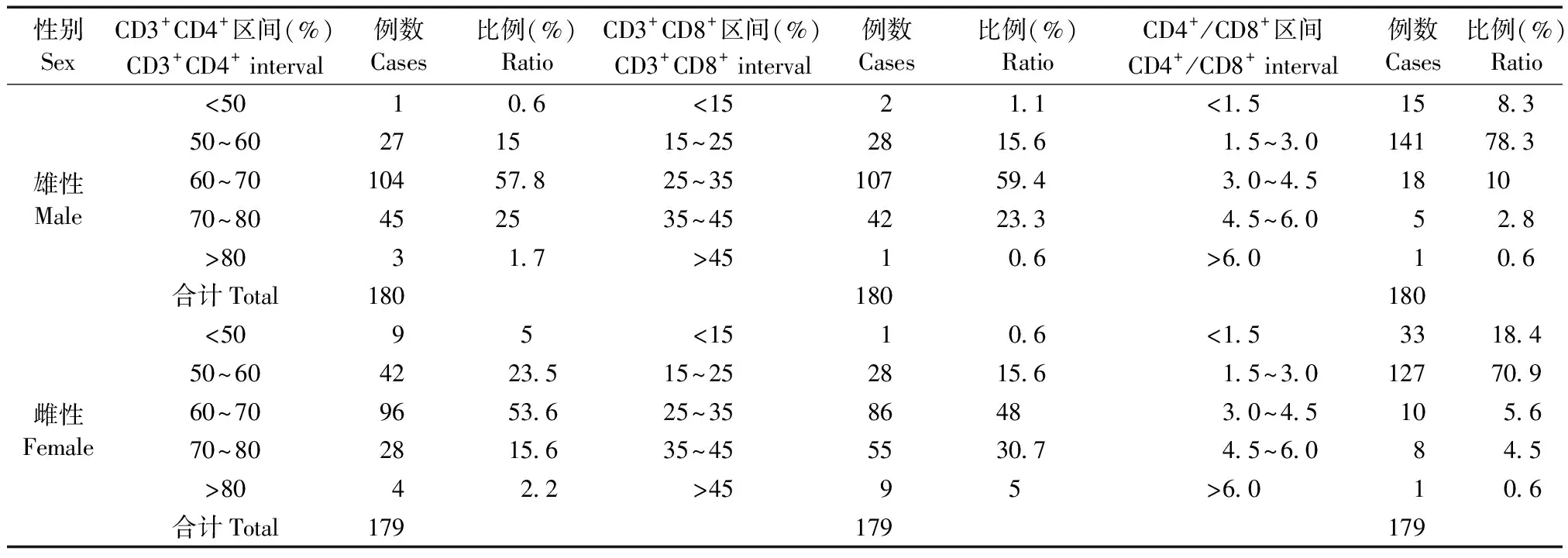
表5 SD大鼠T淋巴细胞亚群总体分布情况

表6 食蟹猴淋巴细胞亚群总体分布情况
3 讨论
免疫毒性评价已成为药物毒理学评价中不可或缺的单元。使用流式细胞计数法(flowcytometry, FM)检测外周血淋巴细胞表型已成为毒理学评价实验室常规的试验手段,该方法与免疫组化检测法相比灵敏度高、更客观、且可以更好地兼容高通量评价。外周血淋巴细胞表型是评估动物免疫功能的重要指标,而动物的产地、环境、样本制备和所用试剂不同等诸多因素均可对其数值产生影响[12-13]。在实验室内确立一套正常动物外周血淋巴细胞亚群正常参考范围,有利于查找研究数据存在的问题并对药物潜在免疫毒性作出有效判断,满足不断提高的实验结果准确度的要求,从而推动生物制品产品研发并更好地服务于毒理数据监管。当试验中阴性组数值偏离背景数据时,认为该组数据不可靠,应查找原因并重复采血检测。本研究汇总12年来我中心未给药或仅给予溶媒的啮齿类动物和灵长类动物的淋巴细胞亚群分类结果,所有数据均来自10以上次独立研究,背景值范围在文献报道范围之内[8-11]。
CD3+CD4+为辅助/诱导细胞亚群,主要通过分泌的淋巴因子来增强和扩大免疫应答;而CD3+CD8+属于抑制/细胞毒细胞亚群,可特异性杀伤靶细胞, 具有抗病毒、抗肿瘤及重要的调节作用[14]。影响CD4+/CD8+的因素除种属外,也与年龄和性别等因素有关。如,衰老与免疫功能减退息息相关。本研究中发现BALB/c小鼠、SD大鼠和食蟹猴的CD4+/CD8+范围分别为1.07~8.59、0.54~11.67和 0.35~4.22,范围区间大,与个别动物个体差异导致头尾两端的数据差异大有关。故进一步对所有数据分区间进行汇总,发现相同种属大多数动物的数值(约70%~85%左右)位于相同区间内,且数据分布无明显性别差异。黄秋香等对不同性别和不同周龄的食蟹猴的淋巴细胞亚群分类结果比较分析,发现3~5岁的食蟹猴存在雌性动物CD3+CD4+较高的现象,而1.5~2岁的食蟹猴数据中未见上述差异[8]。此外,李岩等汇总的4~7岁食蟹猴淋巴细胞亚群分类结果中亦未见性别差异[11]。食蟹猴通常约4岁左右达性成熟,本中心用于药物临床前安全性评价的食蟹猴年龄通常为3~4岁,处于接近性成熟或性成熟伊始阶段。辅助性T淋巴细胞(CD3+CD4+)变化可与动物的性成熟和胸腺萎缩程度有关,动物的年龄以及雌性动物性成熟时间早于雄性动物等因素可能是造成年龄和性别差异的主要原因。因上述文献使用动物产地各异,不排除存在食蟹猴产地原因。
除CD3+CD4+、CD3+CD8+、CD4+/CD8+和CD3-CD20+外,其它淋巴细胞表型对特殊靶向的生物制品的免疫毒性也有一定提示,然而涉及研究较少,未获得大量数据用于制定背景数据。如自然杀伤细胞(natural killer cell,NK)认为是T细胞和B细胞外的第三大最重要的免疫细胞,可通过CD16+或CD56+识别。作为天然免疫的核心细胞,外周血中NK的多寡也可反应受试物的免疫毒性[15]。而表达CD40+的B细胞可激活树突状细胞(dendritic cell,DC)并在CD8+的调控中至关重要[16]。当前已有针对CD40+开发的一系列抗体抗肿瘤药物,如SEA-CD40、鲁卡木单抗、阿韦舒托等陆续进入临床,上述药物的毒性评估中应关注CD40+的表达水平。此外,近年来靶向CD19、CD20和CD22的嵌合抗原受体(Chimeric antigen receptor, CAR)修饰的T细胞治疗在复发/难治型急性淋巴细胞白血病的治疗中彰显优势[17,18],类似细胞治疗产品陆续进入安评领域,而表型为CD19+、CD20+和CD22+的淋巴细胞表达水平也成为其毒性监测的关注点。今后应注意收集相关数值,完善背景数据积累。
本研究规范而系统性地收集了12年来大量小鼠、大鼠和食蟹猴的外周血淋巴细胞亚群背景数据,尤其是首次报道了基于大量样本的小鼠和大鼠淋巴细胞亚群背景数据,作为生物制品临床前动物试验数据解读的重要支持,对进一步讨论药物或疾病对动物免疫功能状态的影响提供参考。当前有关啮齿类动物的淋巴细胞亚群背景值信息罕有报道,本文对以啮齿类动物为模型的生物制品评价及研究具有借鉴意义。

