小鼠抗狂犬病毒IgG抗体ELISA检测方法的建立
蔡方舟,陈 倩,佟 巍,李 丹,王 卫
(中国医学科学院医学实验动物研究所,北京协和医学院比较医学中心,新发再发传染病动物模型研究北京市重点实验室,国家卫生健康委员会人类疾病比较医学重点实验室,北京 100021)
狂犬病是一种由狂犬病毒(rabies virus, RV)感染引起的急性传染病,是迄今为止唯一病死率高达100%的烈性传染病[1-2]。我国是世界第二大狂犬病高发国,仅次于印度;1949年至2015年,我国大陆报告狂犬病130494例,平均每年1977例[3]。近年来,在全社会的重视和努力下,我国狂犬病病例持续下降,但发病数和死亡数在法定传染病报告里依然排列前茅,不可忽视[4]。狂犬病可防不可治,合格的疫苗可用于狂犬病毒暴露前或暴露后预防;一旦发病,则无有效的治疗方法或策略。因此,完善狂犬病动物模型,检定狂犬病疫苗效价,探索狂犬病发病机制,对于狂犬病的防治均具有非常重要的现实意义。实验小鼠具有遗传背景均一、实验操作简便、实验试剂完善等优点,常用于狂犬病的发病机制研究及预防疫苗的评价[3]。
为了解狂犬病毒及疫苗对实验小鼠的免疫效果,常需要检测小鼠血清中抗狂犬病毒抗体水平。常用的检测方法包括世界动物卫生组织(OIE)推荐的荧光抗体病毒中和试验(FAVN),以及世界卫生组织(WHO)推荐的快速荧光灶抑制试验(RFFIT),可定量检测动物或人体内狂犬病中和抗体水平;但缺少规范的结合抗体检测方法。基于此,为完善狂犬病小鼠模型技术体系,本研究建立了一种基于间接ELISA法检测小鼠血清中抗狂犬病毒IgG抗体的方法,可用于狂犬病小鼠模型的分析以及疫苗效价的评估。
1 材料和方法
1.1 实验材料
1.1.1 实验动物
SPF级KM小鼠(雌性,体重12~14 g,3~4周龄),由北京华阜康生物技术股份有限责任公司提供[SCXK (京)2014-0004],用于狂犬病毒阳性血清和阴性血清的制备。动物饲养与实验均在中国医学科学院医学实验动物研究所生物安全二级动物实验室(ABSL-2),遵照3R原则进行。动物实验方案得到中国医学科学院医学实验动物研究所实验动物使用与管理委员会的批准(批准号:WW18003)。
1.1.2 实验样品
狂犬病毒阳性血清和阴性血清由本课题组自行制备,具体方法详见1.3.1。用于特异性实验的小鼠肝炎病毒、小鼠呼肠孤病毒III型、小鼠细小病毒、小鼠多瘤病毒、小鼠腺病毒、小鼠仙台病毒、小鼠脑脊髓炎病毒、淋巴细胞脉络丛脑膜炎病毒的阳性血清来自中国医学科学院医学实验动物研究所检测中心,免疫荧光法(IFA)确认阳性,抗体效价均不低于1∶320。
1.2 主要试剂与仪器
狂犬病疫苗国家标准品购自中国食品药品检定研究院,批号为250009-201108,效价为6.61 U/mL。狂犬病毒抗原预包被微孔板(96微孔板)、TMB显色液、终止液(稀硫酸)、PBST洗液等购自北京世纪元亨动物防疫技术有限公司(批号:20180906)。HRP标记的山羊抗小鼠IgG抗体(货号:ZB-2305WW)购于北京中杉金桥生物技术有限公司,抗体浓度为400 μg/mL。PBS(货号:SH30256.01)购自HyClone公司。酶标仪(型号:FLUOStar Omega)由德国BMG Labtech公司生产。
1.3 实验方法
1.3.1 小鼠阳性血清及阴性血清的制备
狂犬疫苗国家标准品用PBS稀释成1∶125,每只小鼠腹腔注射0.5 mL,0 d、7 d免疫,共免疫2次。分离免疫后14 d小鼠血清,进行抗狂犬病毒中和抗体效价快速荧光灶抑制试验(RFFIT)测定。根据WHO指导原则,RFFIT结果大于0.5 IU/mL的样品确定为阳性血清。阳性血清混合后,使用BSA方法测定其浓度为64.5 mg/mL。阴性血清来自未免疫小鼠,RFFIT实验确认对狂犬病毒没有中和效果。
1.3.2 ELISA方法的基本流程
狂犬病毒抗原包被由北京世纪元亨公司具体操作,其简单流程如下:96孔板使用纯化的狂犬病毒进行包被,包被时将包被液(0.05 mol/L pH 9.6的碳酸盐缓冲液,0.05 mol/L碱)稀释后加入微孔板中,每孔加100 μL,4℃孵育24 h,甩干;加入封闭液(0.12% Tris缓冲液,含蛋白),每孔家200 μL,4℃孵育24 h,甩干。对包被板做干燥、密封等处理,保存于4℃冰箱。获得狂犬病毒抗原包被板之后,向其中加入PBS稀释的血清标本,37℃培养箱中孵育30 min;PBST洗板5次,加入PBS稀释的HRP标记的山羊抗小鼠IgG抗体,37℃培养箱中孵育30 min;PBST洗板5次,加入显色底物A(0.05 mol/L pH 5.0的Na2HPO4-柠檬酸缓冲液,含H2O2)及显色底物B(0.01 mol/L pH 5.0柠檬酸缓冲液,含EDTA-Na2、四甲基联苯胺TMB),37℃显色15 min;加入终止液(0.5 mol/L H2SO4),用酶标仪测定波长450 nm处的OD值。
1.3.3 实验条件的优化
为确定样品的最佳稀释度及二抗的最佳浓度,根据文献[5],使用正交实验法优化ELISA实验条件。样品使用PBS进行系列稀释,根据实验经验,稀释成4个稀释度,分别为1:50~1∶400;HRP标记的山羊抗小鼠IgG抗体也使用PBS进行系列稀释,根据抗体说明书,稀释为5个浓度,稀释度为1∶2500~1:40 000,浓度分别为160 ng/mL、80 ng/mL、40 ng/mL、20 ng/mL、10 ng/mL,详见表1。

1.3.4 方法特异性测试
使用该ELISA方法检测实验小鼠常见病毒的阳性血清,包括小鼠肝炎病毒、小鼠呼肠孤病毒III型、小鼠细小病毒、小鼠多瘤病毒、小鼠腺病毒、小鼠仙台病毒、小鼠脑脊髓炎病毒、淋巴细胞脉络丛脑膜炎病毒的阳性血清,以及小鼠阴性血清;判断其结果是否为阴性,从而确定该方法的特异性。
1.3.5 方法敏感性测试
使用PBS系列稀释阳性血清,稀释度分别为1:10、1:50、1∶100、1∶500、1∶1000、1∶5000、1:10 000、1:50 000、1∶100 000、1∶500 000、1∶1 000 000,浓度分别为6.45 mg/mL、1.29 mg/mL、645 μg/mL、129 μg/mL、64.5 μg/mL、12.9 μg/mL、6.45 μg/mL、1.29 μg/mL、645 ng/mL、129 ng/mL、64.5 ng/mL。用建立的ELISA方法进行检测,确定其能检测出阳性结果的最低样品浓度,从而确定该方法的敏感性。
1.3.6 方法重复性测试
选择本课题组制备的阳性血清样本各3份,经3次重复检测,每次同一样本设3个复孔,确定检测符合率,并计算变异系数(CV=(SD÷MN)×100%)[7],从而确定该方法的重复性。
1.3.7 符合率检验
将本文建立的间接ELISA方法与美国Alpha Diagnostic International公司的间接法试剂盒Mouse Anti-Rabies IgG ELISA(货号:600-030-MRG)比较,分析两种方法检测结果的一致性及符合率。
2 结果
2.1 间接ELISA法工作条件的确定
为建立该ELISA方法,使用正交实验方法(表1),确定检测样品的最佳稀释度和二抗最佳工作浓度。根据实验结果,随着样品稀释度的提高,OD值逐渐降低;随着二抗浓度的降低,OD值逐渐降低,符合实验预期。按照阳性样品OD450值>1.0,阴性结果OD450值<0.1,P/N值最大的实验组合为最佳组合的标准[8],我们发现该ELISA的样品最佳稀释度是1∶100,二抗最佳浓度为40 ng/mL,结果见表2;后续均使用该工作浓度进行实验。
2.2 临界值(cut-off值)的确定
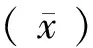
2.3 方法特异性
为了解该方法是否特异,用所建立的间接ELISA方法检测小鼠肝炎、小鼠呼肠孤病毒III型、小鼠细小病毒、小鼠多瘤病毒、小鼠腺病毒、小鼠仙台病毒、小鼠脑脊髓炎病毒、淋巴细胞脉络丛脑膜炎病毒等小鼠常见病毒的阳性血清,结果均为阴性,见表3,说明该ELISA方法与上述病毒抗体无交叉反应,具有较好的特异性。

表1 正交实验实验设计表
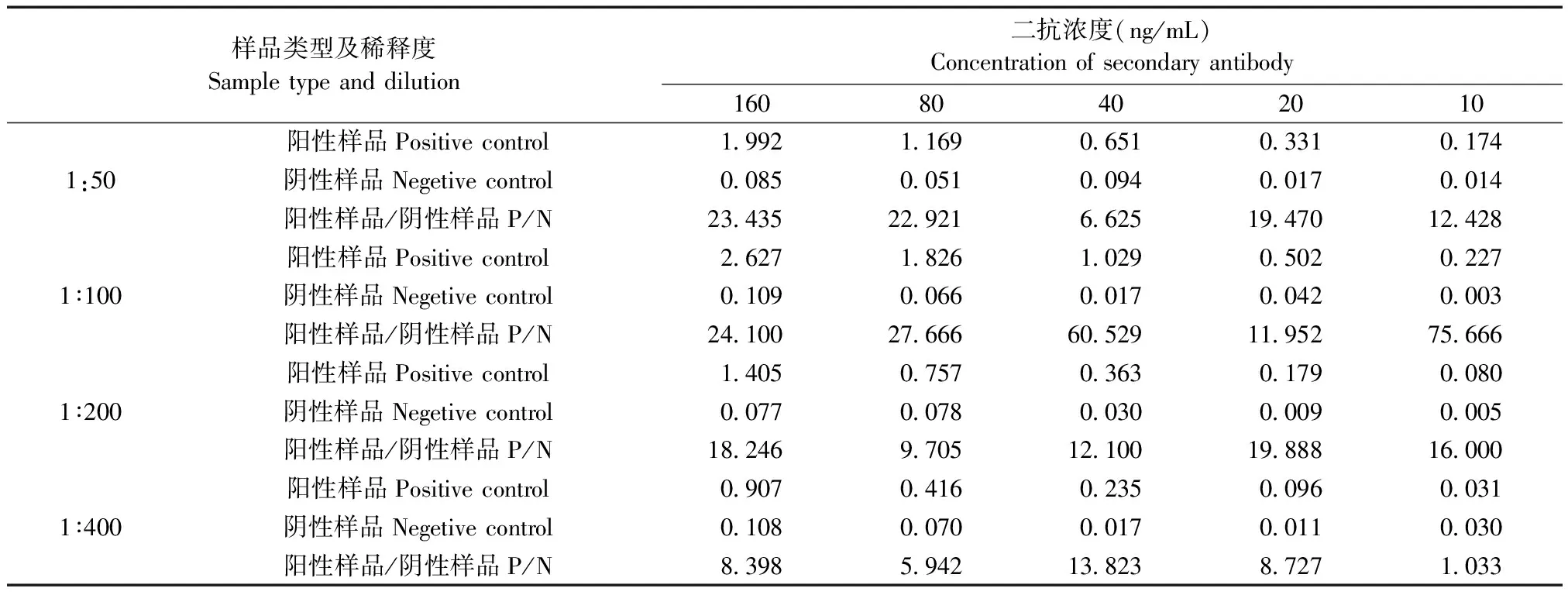
表2 不同稀释倍数血清与不同浓度二抗反应的OD450值
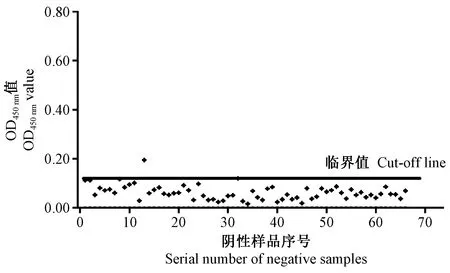
图1 阴性血清间接ELISA检测结果
2.4 方法敏感性
为了解该方法的检测灵敏度,本研究还进行了敏感性实验。将本科室制备的浓度为64.5 mg/mL的阳性样品进行稀释(1:10、1:50、1∶100、1∶500、1∶1000、1∶5000、1:10 000、1:50 000、1∶100 000、1∶500 000、1∶1 000 000),浓度分别为6.45 mg/mL、1.29 mg/mL、645 μg/mL、129 μg/mL、64.5 μg/mL、12.9 μg/mL、6.45 μg/mL、1.29 μg/mL、645 ng/mL、129 ng/mL、64.5 ng/mL,用建立的ELISA方法进行检测。经3次试验,发现样品稀释度在1∶500时仍能检测出阳性(见图2),说明该方法的最低检测灵敏度为129 μg/mL。
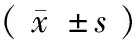
表3 方法特异性实验检测结果

图2 方法敏感性实验检测结果
表4重复性实验结果
Table4Results of reproducibility test

样品Samples1st2nd3rd x±sCV% x±sCV% x±sCV%10.572±0.1263.60.456±0.0449.70.430±0.0597.621.216±0.1088.91.115±0.0827.31.034±0.0615.930.903±0.1701.50.769±0.0816.10.657±0.0253.8
2.5 可重复性
为了解本研究建立方法的可重复性,选择本科室制备的阳性血清样本各3份,经3次检测,每次同一样本设3个复孔,确定检测符合率,并计算变异系数(CV%)。结果发现,3份阳性血清样本经重复检测,诊断符合率为100%,变异系数为1.5%~9.7%,小于10%,见表4;说明该方法具有较好的重复性。
2.6 符合率检验
将本文建立的间接ELISA方法与商品化的试剂盒进行比较,分别检测18个样品,本文建立的方法和商品化试剂盒均检出10例阳性,阳性率为55.56%,与样品实际情况相符,两者总符合率为100%。
3 讨论
为研究狂犬病毒的感染及致病机制,评价狂犬疫苗及药物的效果,动物模型是非常重要的研究工具。狂犬病毒几乎可以感染所有的温血脊椎动物,包括许多野生动物和常用的实验动物,如犬、仓鼠、小鼠、豚鼠、大鼠和家兔等(其敏感性递减)。实验研究和病毒分离时较常应用幼龄小鼠和仓鼠,因其敏感性高,潜伏期短且恒定(5~7 d)。家兔在感染后,规律地显现麻痹症状。给1日龄雏鸡脑内接种狂犬病毒,可以使其发生致死性麻痹(初代街毒的潜伏期可能长达1个月左右),连续传代后的潜伏期缩短至6 d。地鼠也常被用于狂犬病暴露后疫苗免疫动物模型[9]。鉴于实验小鼠的诸多优点,小鼠模型被广泛应用于狂犬病感染及发病机制研究,以及狂犬病疫苗体内评价等工作中[10]。
了解狂犬病毒或疫苗对小鼠的免疫效果,进行狂犬病小鼠模型分析,抗体水平检测是非常关键的一环。目前,检测狂犬病抗体的有很多种,如荧光抗体中和实验(FAVN)、小鼠中和实验(MNT)、快速荧光灶抑制试验(RFFIT)等[11-13],但是这些实验都存在着相应的缺点,如仪器需求较高、成本较高、试验周期较长等;还需要使用狂犬病毒活毒,存在实验室生物安全风险。为完善狂犬病小鼠模型技术体系,了解结合抗体在小鼠体内的变化规律,急需建立一种简便易行的抗体检测方法。国际上只有少数公司能生产类似试剂盒,但也存在货期长、成本高等问题。
酶联免疫吸附试验(ELISA)只需要较短的时间(2~3 h)以及较低的成本,在定性分析上ELISA具有较大优势。而且,ELISA与其他抗体检测技术具有非常高的符合率。如ELISA和FAVN检测狂犬病疫苗免疫犬血清抗体的阳性符合率为100%[14]。RFFIT、FAVN及RVNA Kit等三种方法可通用于人血清中抗狂犬病毒中和抗体的检测,而ELISA检测结果与中和抗体效价有一定差距,但在经过优化、校验后ELISA也可以在有效范围内用于狂犬病抗体的检测[15-16]。为此,作者尝试建立一种基于间接ELISA法检测小鼠血清中抗狂犬病毒IgG抗体的方法,可用于狂犬病小鼠模型的分析以及疫苗效价的评估。
本研究建立的小鼠抗狂犬病毒IgG抗体ELISA检测方法具有良好的可重复性,且特异性良好,与小鼠常见病毒无交叉反应,能在抗体浓度大于129 μg/mL时检测出阳性结果。本实验以商品化的试剂盒作为对照进行比较,发现二者符合率很高,符合率达到100%,证明自研试剂盒性能良好,可应用于狂犬病小鼠模型的抗体动力学追踪分析。综上所述,本文所建立的间接ELISA方法适于狂犬病小鼠模型的分析以及疫苗临床前的检测。

