血清4型禽腺病毒浙江株的分离鉴定及其全基因组序列分析
李夏,夏文君,毛鍶超,卢舒婷,莫开昆,廖敏,周继勇,郑肖娟
(浙江大学动物科学学院,农业农村部动物病毒学重点实验室,杭州310058)
禽腺病毒(fowl adenovirus, FAdV)是腺病毒科腺病毒属的一员。目前,FAdV可分为5类(A~E)共12种血清型(1~7、8a、8b、9~11)[1-2]。血清4型禽腺病毒(FAdV4)感染引起包涵体肝炎-心包积液综合征(hydropericardium hepatitis syndrome, HHS)。该病于1987年在巴基斯坦的安卡拉地区被首次报道,因此,又被称为安卡拉病[3]。2010年以前,FAdV4在我国没有形成较大的流行趋势,但自2015年夏季开始在我国东南沿海地区大肆爆发[4],加拿大、日本、印度、波兰等一些国家也陆续爆发该病[5-6]。其典型致病特征是心脏肿胀、出血,心包腔内有大量淡黄色透明液体,肝肿大、出血,且呈浅褐色[7-8];该病潜伏期短,发病快,死亡率高,给家禽养殖业带来巨大的经济损失,已成为威胁我国养禽业的重大疫病之一。
目前,国内外对血清4 型禽腺病毒的研究主要集中在分离鉴定[9-10]、基因序列分析、疫苗研制[11-12]和致病性[13-14]分析等方面。杨晓伟等分离出一株FAdV4山东株,并制备出对FAdV4感染具有良好防治效果的卵黄抗体[15]。梁广成对FAdV4 分离株的全基因组及致病性进行了研究,并初步建立了抗体间接免疫荧光方法[16]。刘延珂等研究发现,近年来在中国流行的高致病性FAdV4 毒株能够在鸡肝癌细胞系LMH 中很好增殖,并且不同时间点的病毒滴度与病毒基因组拷贝数呈正相关[17]。WANG 等制备出具有良好中和活性的Fiber-2 蛋白的单克隆抗体[18]。另有报道称,基于Fiber-2蛋白的亚单位疫苗可提供比灭活油乳剂疫苗更快更强的免疫保护能力[19]。GUAN 等对FAdV4 四川分离株的全基因组及hexon 基因进行了遗传分析,揭示了其ORF29开放阅读框的缺失,为近年来FAdV4毒力的增强提供了一定的理论猜想[20]。本实验从2015 年浙江省某鸡场爆发的出现HHS 典型症状的肝组织中成功分离到FAdV4 浙江株,并对其全基因组、hexon 和fiber-2 基因进行遗传进化分析,为进一步研究FAdV4的流行特点及毒力变异机制奠定基础。
1 材料与方法
1.1 材料与试剂
UNIQ-10 柱式病毒基因组抽提试剂盒购自生工生物工程(上海)股份有限公司,TRI201 LS 购自上海普飞生物技术有限公司,KOD-Plus-Neo 高保真DNA 聚合酶购自上海硕盟生物科技有限公司,Taq酶、100 bp DNA梯状标志物和1 kb DNA分子标志物购自宝生物工程(大连)有限公司,反转录试剂盒购自Thermo公司,2×Taq Plus 反应混合物购自南京诺唯赞生物科技有限公司,DNA清洁回收试剂盒和DNA 凝胶回收试剂盒购自杭州新景生物试剂开发有限公司,pMD18-T载体购自宝生物工程(大连)有限公司,SPF 鸡胚购自浙江宁波纯派农业科技有限公司,达尔伯克改良伊格尔培养基(DMEM)购自美国Invitrogen公司,胎牛血清购自以色列BI公司,β-actin 单抗购自美国Thermo 公司,辣根过氧化物酶(HRP)标记的羊抗鼠IgG、异硫氰酸荧光素(FITC)标记的羊抗鼠IgG 均购自美国KPL 公司,NDV-Lasota 疫苗毒株购自青岛易邦生物工程有限公司,禽腺病毒Hexon和Fiber-2鼠多抗血清由本实验室制备、保存。
1.2 病料采集与处理
将2015 年浙江某鸡场疑似HHS 的病死鸡肝剪碎后充分研磨,用灭菌生理盐水按体积比1∶3稀释,加入终浓度为1 000 U/mL 的青链霉素,反复冻融3次,于4 ℃、1.2×104r/min条件下离心10 min,取上清液,并进行过滤除菌,分装后置于-80 ℃冰箱冻存。
1.3 病毒悬液的核酸提取和检测
按照UNIQ-10 柱式病毒基因组抽提试剂盒说明书进行病毒DNA的抽提,利用Trizol法提取病毒悬液中的RNA,使用反转录试剂盒将RNA 反转录为cDNA。反转录程序为:25 ℃变性5 min,42 ℃延伸60 min,72 ℃失活10 min。根据GenBank(https://www.ncbi.nlm.nih.gov/)发表的FAdV4的hexon基因保守区序列设计1 对FAdV4 的检测引物,同时根据其他常见禽病病原相关基因的保守序列(AIV/M、IBDV/VP2、NDV/NP、IBV/S1、MDV/132 bp 重复区域、EDSV/100 kDa)设计用于多种禽病病原排除检测的引物对(表1)。以提取的DNA 或反转录合成的cDNA 为模板,利用表1 所示的检测引物,以2×Taq Plus 反应混合物扩增目的基因。聚合酶链式反应(polymerase chain reaction, PCR)体系为:2×Taq Plus反应混合物12.5 μL,上、下游引物各1 μL,模板1 μL,ddH2O 9.5 μL。PCR/反转录-PCR反应程序为:95 ℃预变性5 min;95 ℃变性30 s,58 ℃退火30 s,72 ℃延伸1 min,共30个循环;72 ℃再延伸10 min。取PCR扩增产物用1.2%琼脂糖凝胶电泳检测。

表1 鸡常见病原的鉴别检测引物Table 1 Detection primers for common pathogens in chickens
1.4 病毒在鸡胚及鸡胚肾细胞中的传代培养
将经研磨处理的肝上清液通过尿囊腔注射法接种于10 日龄SPF 鸡胚中,0.2 mL/枚,然后置于37 ℃环境下孵育,每日观察,收集接种后5 d内鸡胚尿囊液和胚体,剖检并观察胚体的病理变化,对收集的鸡胚尿囊液进行病毒核酸的检测鉴定。取17~20 日龄SPF 鸡胚肾组织,参照缪从容等[21]的方法制备新鲜的原代鸡胚肾(chicken embryo kidney,CEK)细胞,并根据CEK细胞的贴壁生长、细胞形态多呈上皮样等特性,在接毒前多次换液以去除不贴壁的细胞,获得纯度较高的CEK细胞。将鸡胚上传至第3 代的尿囊液接种CEK 细胞后进一步进行细胞连续传代,传至11 代后,收集细胞毒进行病毒检测和鉴定。
1.5 血凝实验
在常温下,将收集到的尿囊液及细胞适应病毒的悬液用生理盐水进行2的倍比稀释,然后加入1%的鸡、小鼠、大鼠、绵羊等多种动物的红细胞悬液进行血凝(hemagglutination,HA)实验,以NDV-Lasota疫苗株作为阳性对照,观察尿囊液和细胞毒能否对各种动物红细胞产生凝集现象。
1.6 病毒半数组织培养感染剂量测定
在半数组织培养感染剂量(50% tissue culture infective dose,TCID50)测定前一天制备CEK 细胞,并铺于96 孔细胞培养板中,100 µL/孔;在进行TCID50测定当天换液。将病毒用DMEM 培养基进行10倍梯度稀释(从10-1稀释到10-11),将稀释后的病毒接种CEK 细胞,每孔50µL,每个稀释度重复8孔。在接毒后48 h,用细胞固定液将细胞固定,以Fiber-2 蛋白的多抗血清作为一抗,以FITC 标记的羊抗鼠IgG 作为二抗,对感染细胞进行间接免疫荧光实验,通过倒置荧光显微镜观察Fiber-2 阳性细胞,按Reed-Muench法[22]计算病毒的TCID50。
1.7 鸡胚致病性实验及接毒鸡胚肝组织中Fiber-2蛋白的检测
将60枚10日龄SPF鸡胚平均分成6组,第1-5组分别以尿囊腔注射法接种FAdV4-ZJ2015的第3、7、8、9、11代细胞毒,接种剂量为0.2 mL/枚,第6组不接种病毒,为空白对照组。将鸡胚置于37 ℃恒温培养箱中孵育,弃去24 h内非正常死亡鸡胚。逐日观察接毒、未接毒鸡胚有无死胚、弱胚现象,计算各组鸡胚孵化率与死亡率,剖检死亡鸡胚和对照鸡胚,观察其肝、心等组织病变情况。每组取1 g鸡胚肝组织,剪碎、研磨,取等量组织研磨液,以实验室前期制备的Fiber-2多抗血清(体积比1∶1 000)作为一抗,HRP标记的羊抗鼠IgG(体积比1∶3 000)作为二抗,利用蛋白质印迹法(Western blotting)特异性检测肝组织中病毒蛋白Fiber-2的表达,以β-actin作为内参对照。
1.8 病毒全基因组测序及序列分析
参照FAdV4-JSJ13(KM096544.1)毒株的全基因组测序引物[23],并避开FAdV4 流行毒株可能存在的大段缺失位置,本文设计了分段PCR法扩增FAdV4全基因组的11 对引物(表2),并确保相邻的2 对引物扩增产物之间有部分重叠区域。引物由擎科生物(杭州)股份有限公司合成。以抽提的病毒基因组DNA 为模板,利用表2 所列11 对扩增引物,采用KOD-Plus-Neo 热启动高保真DNA 聚合酶,参照产品说明书上的PCR 扩增体系分别扩增跨越FAdV4全基因组的11个目的基因片段,经Taq酶加A尾后,将其连接到pMD18-T载体上,经鉴定为阳性的重组菌液送至铂尚生物技术(上海)有限公司测序。将测得的11 个片段序列用NCBI 在线软件BLAST(https://blast.ncbi.nlm.nih.gov/Blast.cgi)比对其同源性,再用DNAman软件的Multiple Sequence Assembly功能对片段进行拼接,并对结果进行人工校正。利用MegAlign 软件的View/Sequence distance 功能对ZJ2015 与FAdV4 其他毒株的全基因组同源性进行比对分析,利用Mega 6.06 软件中的Clustal W 程序分别完成ZJ2015 全基因组及hexon、fiber-2 基因序列的完全比对,并采用邻接法构建遗传进化树,用最大似然复合(maximum composite likelihood)模型进行比对,自举值(bootstrap value)设置为1 000。
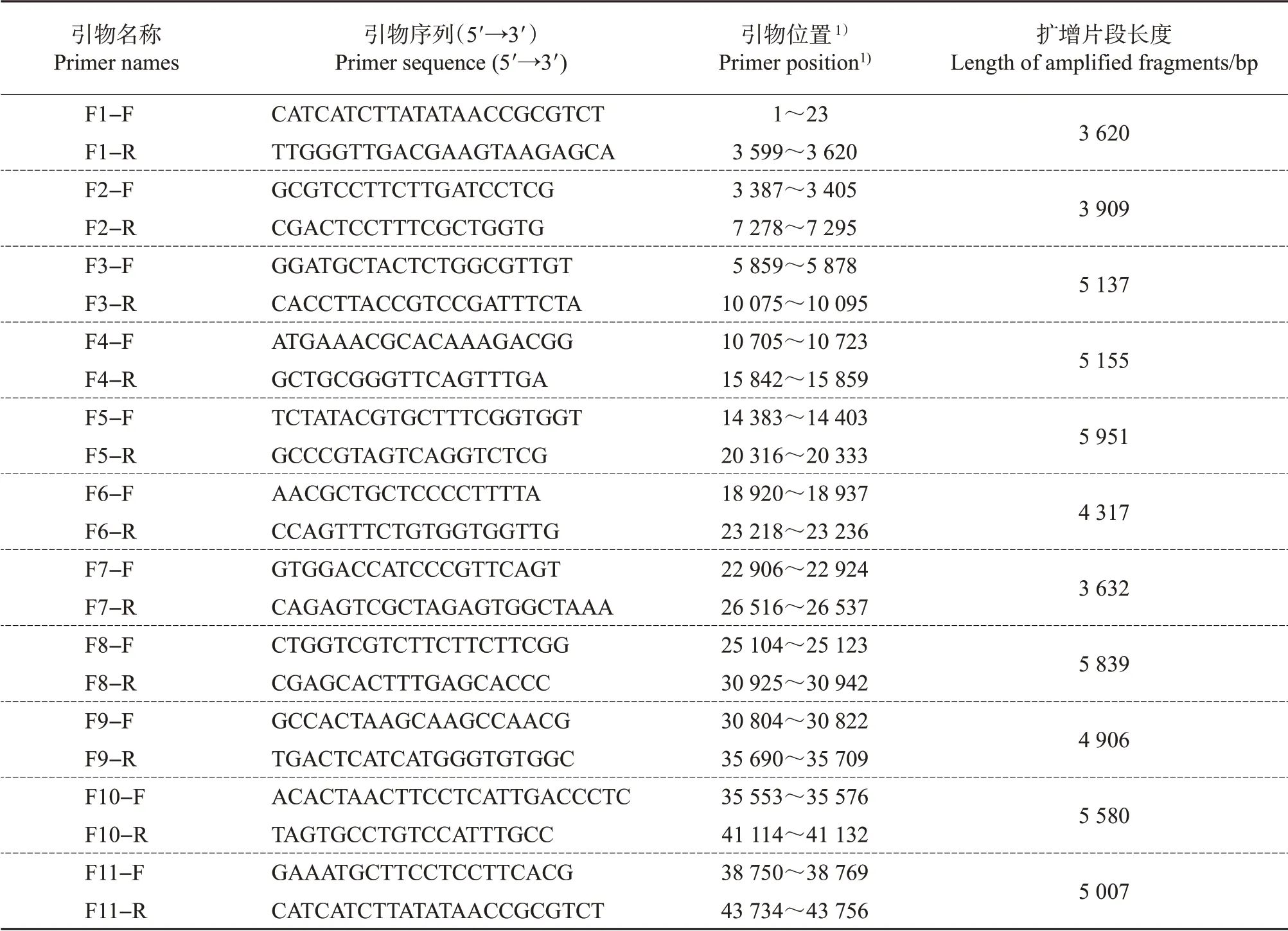
表2 跨越FAdV4-ZJ2015株全基因组的11个片段的扩增引物Table 2 Primers to amplify 11 fragments covering the whole genome of FAdV4-ZJ2015 strain
2 结果与分析
2.1 HHS 发病鸡的病原鉴定
将2015 年浙江省某鸡场出现典型HHS 的发病鸡肝组织研磨处理后,取上清悬液接种于鸡胚并进行连续传代。以表1列出的检测引物,采用PCR/反转录-PCR方法对肝组织处理上清液和第1—3代鸡胚尿囊液进行常见禽病病毒鉴定。1%琼脂糖凝胶电泳分析结果显示,FAdV 引物扩增获得一条大小约900 bp 的条带,与预期的FAdV 目的条带大小相符(图1A~B),但没有检测到传染性支气管炎病毒(infectious bronchitis virus,IBV)、禽流感病毒(avian influenza virus,AIV)、新城疫病毒(Newcastle disease virus, NDV)、减蛋综合征病毒(egg drop syndrome virus, EDSV)、马立克病毒(Marek’s disease virus,MDV)及传染性法氏囊病病毒(infectious bursal disease virus, IBDV)等常见禽病病原的扩增条带(图1C~D)。将扩增到的FAdV 片段测序分析显示,该序列与FAdV4 的hexon 基因同源性高达100%,初步证明该浙江鸡场感染的病原是FAdV4型,命名为ZJ2015。
2.2 FAdV4 的分离和细胞适应性分析

图1 肝组织及鸡胚尿囊液中病毒核酸的鉴别检测Fig.1 Identification of viral nucleic acids in liver tissues and allantoic fluid of chicken embryos
将PCR检测为腺病毒阳性的鸡胚尿囊液第3代毒接种CEK细胞,细胞未出现明显的病变效应。为了进一步分析病毒是否在CEK细胞中复制增殖,利用本实验室制备的Fiber-2 和Hexon 蛋白的阳性血清对FAdV4-ZJ2015感染细胞进行间接免疫荧光检测。结果显示,Fiber-2 和Hexon 蛋白阳性血清在FAdV4-ZJ2015感染的CEK细胞中均检测到阳性细胞(图2),说明FAdV4-ZJ2015 已适应在CEK 细胞上复制。将ZJ2015在CEK细胞上连续传代至11代(P11),进一步经PCR/反转录-PCR对病毒核酸进行鉴定。结果显示,FAdV4 核酸稳定存在,没有检测到IBV、AIV、NDV、EDSV、MDV 及IBDV 的病毒核酸。
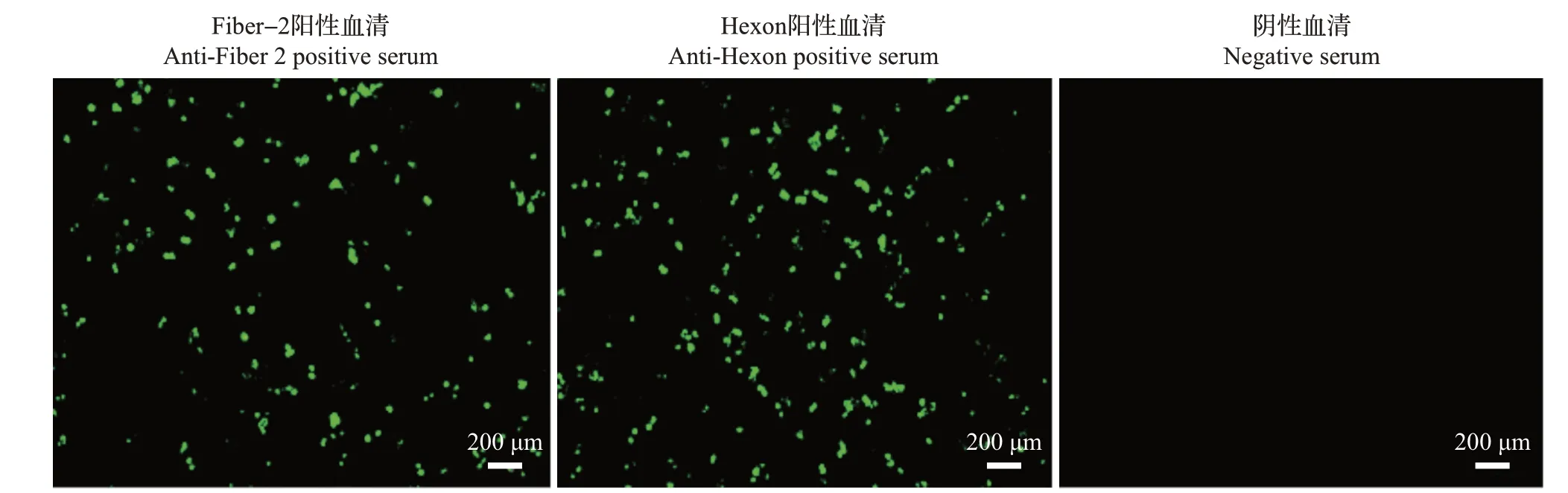
图2 FAdV4-ZJ2015感染CEK细胞的间接免疫荧光检测Fig.2 Indirect immunofluorescence assay of CEK cells infected with FAdV4-ZJ2015 strain
2.3 血凝实验结果
将鸡胚传至3 代的尿囊液和在CEK 细胞上传至11代的细胞上清液分别与鸡、小鼠、大鼠、绵羊的红细胞进行血凝实验,以NDV-Lasota 疫苗毒株作为血凝实验的阳性对照。结果显示,分离的FAdV4-ZJ2015 毒株不具有凝集鸡、小鼠、大鼠、绵羊红细胞的能力。
2.4 病毒滴度TCID50测定结果
将ZJ2015 株第11 代细胞适应毒倍比(10-1、10-2、10-3……)稀释后,接种到原代CEK细胞上,在感染后48 h固定细胞,利用Fiber-2鼠多抗血清进行间接免疫荧光法检测,通过荧光显微镜观察阳性细胞,根据Reed-Muench 公式计算ZJ2015 毒株第11代细胞适应毒的TCID50为2.0×106mL-1。
2.5 FAdV4-ZJ2015 的鸡胚致病性
为了进一步分析FAdV4-ZJ2015毒株的鸡胚致病性,将第3、7、8、9、11 代的ZJ2015 分离毒接种于10 日龄SPF 鸡胚(0.2 mL/枚)中,每天观察死胚、弱胚现象。结果表明:接种7 d内,无死胚现象;第8天血管明显减弱,开始出现鸡胚死亡;统计至第21天,阴性鸡胚孵化率为90%,死亡率10%,接毒鸡胚孵化率为0,死亡率为100%。对死亡鸡胚剖检发现,接毒组鸡胚较阴性组鸡胚个头明显偏小(图3A-a、3A-b),且接毒组鸡胚心脏肿大、出血,但心包积液现象不明显,肝肿胀、出血(图3A-c、图3A-d)。将ZJ2015的不同代次(P3、P7、P8、P9和P11)分离毒接种鸡胚后的肝组织研磨,用Fiber-2多抗检测肝中病毒蛋白Fiber-2的表达。结果显示,不同代次分离毒均能成功感染鸡胚的肝组织,而未接毒鸡胚的肝研磨液无Fiber-2蛋白的表达(图3B)。
2.6 FAdV4 全基因组的分段扩增和序列测定
抽提FAdV4-ZJ2015接种鸡胚尿囊液中的病毒基因组DNA,以设计合成的11 对引物(表2),采用分段扩增法成功扩增到跨越ZJ2015 毒株FAdV4 的全基因组的11个片段(图4),扩增的目的基因大小范围为3.6~5.9 kb。将测得的11个片段连接pMD18-T载体后测序,获得的序列信息经比对后进行序列拼接,并对结果进行多次校正,最终得到全长43 717 bp的禽腺病毒4型分离株(ZJ2015)的全基因组序列(GenBank登录号:MF521611.1)。
2.7 FAdV4 全基因组遗传进化分析

图3 FAdV4-ZJ2015株的鸡胚致病性实验和肝组织中Fiber-2蛋白的表达Fig.3 Pathogenicity of FAdV4-ZJ2015 strain on chicken embryo and expression of Fiber-2 protein in the liver tissues

图4 分段PCR 扩增法对FAdV4-ZJ2015 全基因组的扩增结果Fig.4 Amplification result of the whole genome of FAdV4-ZJ2015 by segmented PCR amplification
利用Mega 6.06 将ZJ2015 全基因组(全长43 717 bp,GC 含量54.87%)与不同血清型FAdV 毒株进行遗传进化分析。结果显示:ZJ2015毒株处于C型FAdV分支上;在这个分支内,ZJ2015与近年来我国分离到的FAdV4型毒株亲缘关系更近,而与加拿大ON1(GU188428.1)、日本KR5(HE608152.1)、墨西哥MX-SHP95(KP295475.1)毒株亲缘关系较远(图5)。用MegAlign 比对ZJ2015 与FAdV4 国外经典毒株及国内流行毒株的同源性显示,ZJ2015株与2015 年以来国内流行的高致病力毒株的同源性在99.87%以上,与国外经典毒株略有差异,同源性在98.2%~99.0%之间(表3)。核酸序列分析显示,与国外毒株相比,ZJ2015及近年流行的FAdV4毒株的GA和TC重复区出现不同程度的缺失,且在基因组3.5×104~4.0×104bp 位置处有一段长1 966 bp 的基因片段缺失突变,这导致基因组中ORF19、ORF27、ORF48这3个编码蛋白的缺失。
2.8 基于Hexon 和Fiber-2 蛋白的遗传进化分析
hexon基因高度保守,能很好地显示禽腺病毒的分型特征。ZJ2015毒株的hexon基因全长2 814 bp,编码937个氨基酸。基于氨基酸水平的遗传进化分析显示:ZJ2015毒株与国内流行毒株同属FAdV4型;与墨西哥、日本、加拿大毒株有一定差异,属于2个不同的分支(图6A)。ZJ2015毒株的hexon编码937个氨基酸,与国内多数毒株相同;而韩国株Kr-Yeoju(ADV35558.1)的hexon 编码936 个氨基酸,表现在第196 位氨基酸缺失。中国毒株与印度B1-7(ANG08820.1)、日本KR5(CCE39367.1)和加拿大ON1(ADQ39061.1)毒株相比,第189 位氨基酸由Ⅰ突变成R,第196位氨基酸由E突变成Q,而这一现象在我国近年来流行的FAdV4毒株中均可发现。

图5 基于ZJ2015全基因组核苷酸水平的系统进化分析Fig.5 Phylogenetic analysis based on the whole genome of ZJ2015 strain

表3 基于ZJ2015全基因组核苷酸水平的同源性比对Table 3 Homology alignment based on the whole genome of ZJ2015 strain

图6 基于Hexon(A)和Fiber-2(B)蛋白的氨基酸水平系统进化分析Fig.6 Phylogenetic analysis based on amino acid levels of Hexon(A)and Fiber-2(B)proteins
fiber-2基因位于病毒粒子的五邻体上,存在型和亚属特异性抗原表位,能够刺激机体产生较强的免疫应答。ZJ2015 毒株的fiber-2 基因全长1 440 bp,编码479 个氨基酸。氨基酸水平的遗传进化分析(图6B)显示:包括ZJ2015 株在内的国内流行毒株与巴基斯坦、科威特和印度毒株亲缘关系较近;另外,韩国、澳大利亚和墨西哥毒株亲缘关系较近,秘鲁、厄瓜多尔和智利毒株亲缘关系较近,分属于同一大簇,早期日本、加拿大和德国毒株则处在另一簇,与近年出现的毒株亲缘关系较远。基于fiber-2基因氨基酸水平突变位点分析发现,ZJ2015毒株的11~16 位为ENGKPE,与国内毒株相同,但与ON1(GU188428)、KR5(FR872912)和MXSHP95(KP295475)毒株相比则出现了不同程度的插入和突变;同时,比对发现ZJ2015毒株在219位由G突变为D,在232位由E突变为Q,在319位由V突变为I,这些突变在国内流行毒株中均有发生,且这些突变毒株均为高致病性毒株。此外,ZJ2015毒株也发生了一些在其他位置上的突变(附表1,http://www.zjujournals.com/agr/CN/10.3785/j.issn.1008-9209.2019.03.041)。
3 讨论
自2015 年以来,在中国多个地区爆发以HHS为典型特征的FAdV4感染。随后,有多个研究机构采用鸡胚接种、原代鸡胚肝细胞(CEL)、原代CEK细胞或鸡肝癌细胞系LMH 培养等途径,从山东[16]、河南[13]、北京[24]、广西[25]、江苏[23]、陕西[26]、四川[14]、辽宁[27]等地成功分离到FAdV4的流行毒株,但尚未有浙江省FAdV4 毒株分离鉴定的研究报道。本研究对2015 年浙江省某鸡场剖检可见明显的胶冻样心包积液、肝坏死等病理变化的病死鸡肝进行病毒检测,因其在鸡胚传至第1、2、3 代时虽然均能检测到目的基因的表达,但传至第4 代时就检测不到目的基因的表达,后优化方法改用鸡胚传至第3 代的尿囊液接种原代CEK 细胞至11 代,发现接种CEK 细胞后的每一代均能检测到目的基因的表达,因此我们采用鸡胚接种结合原代CEK 细胞连续传代的方法,成功分离到一株FAdV4 浙江株ZJ2015,该毒株的基因组序列与近年流行的毒力增强的FAdV4 毒株序列很相近。该毒株可以在CEK 细胞上稳定培养,TCID50达到2.0×106mL-1以上,虽然没有呈现典型的细胞病变效应,但可以通过本实验室制备的Fiber-2 和Hexon 多抗血清进行间接免疫荧光和蛋白质印迹反应来检测病毒蛋白的表达情况。这一毒株的分离,为后续开展FAdV4 的诊断和防控技术、疫苗开发及毒力变异机制研究奠定了基础。
FAdV基因组全长大于43 kb,自2015年全国各地爆发FAdV4 以来,虽然有较多的毒株分离出来,但只有部分毒株如HLJFAD15(KU991797.1)、JSJ13(KM096544.1)、HB1510(KU587519.1)等(附表2 http://www.zjujournals.com/agr/CN/10.3785/j.issn.1008-9209.2019.03.041)获得了全基因组序列信息。这些全基因组序列大多采用小片段扩增结合正反向测序的方法[16,23]。本研究扩增ZJ2015毒株全基因组片段时,采用高保真酶结合长距离PCR 扩增法,分11段扩增获得跨越全基因组的片段,每个片段都有3.6~6.0 kb。虽然连接到pMD18-T 载体的效率相对低一些,但与39 段扩增法[23]相比,显著减少了pMD18-T 载体连接的后续鉴定和序列拼接的工作量,为之后反向遗传系统构建奠定了基础。
与国外FAdV4 毒株如加拿大分离株ON1(GU188428.1)、日本分离株KR5(HE608152.1)和墨西哥分离株MX-SHP95(KP295475.1)相比,ZJ2015毒株和国内流行的FAdV4毒株中均有一段长为1 966 bp的缺失,LI等推测该段缺失可能与近年国内流行毒株的毒力增强有关[28],而进一步研究发现,近年国内流行毒株的毒力增强与这段缺失没有关系[29],而是与Hexon和Fiber-2蛋白有关[30]。Hexon蛋白是腺病毒最主要的结构蛋白,与国外ON1(ADQ39061.1)、KR5(CCE39367.1)和MX-SHP95(AKN35186.1)毒株相比,中国株的JSJ13(AIS19793.1)和HB1503(KX421402.1)的hexon 基因编码701 个氨基酸,ZJ2015 编码937 个氨基酸,且第189、196 位氨基酸发生突变,这些突变均发生在高致病性毒株中,也可能与近年来国内流行毒株的毒力增强有关[30]。Fiber蛋白位于病毒粒子表面,对病毒感染宿主具有重要作用。FAdV-A和FAdV-C的fiber基因能够编码Fiber-1和Fiber-2这2个蛋白,其他型的FAdV只编码一个Fiber蛋白。Fiber-2蛋白因其位于五邻体头节区,易发生突变(附表1),目前这些突变位点自2015 年以来在FAdV4 流行毒株毒力变异中的分子机制有待进一步研究。因此,有必要建立有效的反向遗传系统,并制备特异的Hexon和Fiber-2单克隆抗体,为后续的毒力变异的分子机制研究奠定基础。

