人叉头转录因子O亚型6真核表达载体的构建及其对胶质瘤细胞存活的影响
龚小霞,李超,曹曦月,杨诚诚,黄超
(四川农业大学动物医学院,实验动物疾病模型研究室,成都611130)
FOXO基因家族是一类进化过程中高度保守的叉 头 转 录 因 子,由FOXO1、FOXO3、FOXO4 和FOXO6组成,它们在不同的组织中均有表达[1],广泛参与细胞的各种代谢功能,包括细胞增殖、凋亡、分化及氧化应激监管等,是细胞氧化应激反应的重要调节因子。它们的激活刺激了位于不同亚细胞区的抗氧化蛋白基因的转录,如:超氧化物歧化酶-2(superoxide dismutase-2,SOD-2)、过氧化物还原酶3(peroxiredoxins 3, POD-3)和过氧化物还原酶5(peroxiredoxins 5, POD-5)、过氧化氢酶(catalase,CAT)及血浆中细胞外抗氧化蛋白(如硒蛋白P和铜蓝蛋白)等,从而促进了细胞的氧化防御[2]。其中,人叉头转录因子O 亚型6(forkhead box class O6,FOXO6)作为最晚被克隆发现的FOXO家族的成员,在先前的研究中被认为仅在哺乳动物大脑中表达,但之后KIM等[3]发现其也在动物的肝、肠、肺、肾、肌肉和脂肪等组织中表达。FOXO6 位于小鼠4 号染色体D1区,位于人类染色体1p34.1区[4],其cDNA全长约1.6 kb,共编码559个氨基酸。该基因具有2个保守的AKT/PKB 磷酸化位点(thr26 和Ser184),被AKT/PKB 磷酸化后,因缺乏核输出序列(nuclear export sequences, NES),无法与CRM-1 联系在一起[5],故以一种不同于FOXO 家族其他成员的方式介导胰岛素对靶基因的调控。目前对该因子的研究多集中于肝中葡萄糖稳态的调节,亦有少量研究表明,其在胃癌[6]、肺癌[7]、肝细胞癌[8]等肿瘤的发生发展中发挥着重要作用。但是已有研究对于其在胶质瘤中的作用报道较少,其是否能对胶质瘤的发展进程产生影响尚不明确。
胶质瘤是中枢神经系统中最常见的原发性肿瘤,约占所有中枢神经系统肿瘤的30%,占所有恶性脑肿瘤的80%[9]。尽管神经胶质瘤的发生率很高,但是其发生发展的分子机制尚不清楚,因而给治疗带来了一定的困难。基于此,本实验旨在构建pRK5-myc-FOXO6 重组质粒,探究其对胶质瘤细胞存活的影响,以期为进一步研究FOXO6 在胶质瘤发生发展中的作用及其相关的生物学功能奠定基础。
1 材料与方法
1.1 实验材料
人神经胶质瘤细胞U251,由四川农业大学动物医学院实验动物疾病模型研究室提供。
1.2 实验试剂
FOXO6 上下游特异性引物,由生工生物工程(上海)有限公司合成;限制性核酸内切酶NotⅠ和SalⅠ、PrimeSTAR Max 预混合物(2×)、10×QuickCut Green 缓 冲 液、RNAiso Plus、TB Green Premix Ex TaqTMⅡ(TliRnaseH Plus)、反转录试剂盒(PrimeScriptTMRT reagent Kit with gDNA Eraser),均购自宝生物工程(大连)有限公司;琼脂糖凝胶回收试剂盒(E.Z.N.A.Gel Extraction Kit)购自北京天根生化科技有限公司;T4 DNA 连接酶、10×T4 DNA 连接酶缓冲液、DMEM basic、DAPI 封闭剂(ProLong Diamond Antifade Mountant with DAPI)购自赛默飞世尔科技(中国)有限公司;100×青霉素-链霉素溶液及胰酶消化液购自合肥Biosharp 公司;质粒抽提试剂盒(Plasmid Mini KitⅠ)购自美国OMEGA公司;TransEasyTM转染试剂购自成都福际生物技术有限公司;一抗Anti-β-Actin(ACTB)和二抗羊抗鼠IgG(H+L)、HRP 偶联物购自武汉博士德生物工程有限公司;一抗Anti-c-Myc Mouse 购自德国Merck Millipore 公司;ECL 显色发光试剂盒购自北京康为世纪生物科技有限公司。
1.3 FOXO6 片段的扩增
1.3.1 引物设计
根 据NCBI(https://www.ncbi.nlm.nih.gov/)的GenBank DNA序列数据库发布的FOXO6转录因子编码序列,借助聚合酶链式反应(polymerase chain reaction, PCR)引物设计软件Primer Premier 6.0 进行综合评价,设计1对特异性引物,在上游引物中加入SalⅠ酶切位点,在下游引物中加入NotⅠ酶切位点,并在酶切位点前方加入相应的保护碱基,交由生工生物工程(上海)有限公司合成。引物序列如下:上游引物5´-AAGAGTCGACCATGGCTGCGAA GCTGCGAGC-3´;下游引物5´-AAGGAAAAAAG CGGCCGCTCAGCCCGGCACCCAGCTCT-3´。
1.3.2 FOXO6 片段的扩增
使用RNA抽提试剂盒和反转录试剂盒,从肿瘤细胞U251 中提取RNA 并反转录为cDNA,然后以cDNA 为模板,利用PCR 仪进行扩增。PCR 反应条件为:98 ℃预变性5 min;98 ℃变性30 s,58 ℃退火30 s,72 ℃延伸90 s,扩增35 个循环;72 ℃再延伸10 min,4 ℃保存。PCR产物经1%琼脂糖凝胶电泳进行分离,与DNA 分子标志物DL5000 进行比较,筛选出长度为1 600 bp、有特异性且浓度较高的产物,然后用胶回收试剂盒回收PCR产物。
1.4 pRK5-myc-FOXO6 重组质粒的构建与测序
用限制性内切酶NotⅠ和SalⅠ酶切载体pRK5-myc 和目的基因的PCR 产物,经1%琼脂糖凝胶电泳后,用胶回收试剂盒回收。然后在T4 DNA 连接酶的作用下,将酶切后的载体pRK5-myc 和目的基因回收片段置于10 μL体系中,于16 ℃条件下连接过夜。将连接产物转化至大肠埃希菌DH5α 中,筛选阳性克隆菌落,并提取质粒,用限制性内切酶NotⅠ和SalⅠ双酶切鉴定。将构建成功的质粒送至生工生物工程(上海)有限公司测序。
1.5 U251 细胞的转染
将U251 细胞接种于含10 μL/mL 青链霉素及10% 胎牛血清的Dulbeco 改良MEM 培养基(Dulbeco’s modified eagle medium, DMEM)的6 孔板中,培养24 h左右,当细胞密度达到60%~70%后开始转染,转染前1 h 换液;将4 μL TransEasy 转染试剂和4 μg 重组质粒分别与100 μL 减血清培养基(opti-MEM)混匀,静置5 min;然后将上述2种溶液混合,吹打数次使之充分混匀,静置20 min;将TransEasy-重组质粒复合物加入已接种U251 细胞的6孔板中,每孔200 μL,并以同样的方法转染空载体pRK5-myc作为对照;转染完毕后于37 ℃、5%CO2条件下培养,4~6 h 换液。培养36 h 后,进行后续实验。
1.6 蛋白表达的蛋白质印迹法(Western blotting)检测
在用质粒转染U251 细胞36 h 后,收集各组细胞总蛋白,经十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(sodium dodecyl sulphate-polyacrylamide gel electrophoresis,SDS-PAGE)分离后,转移至聚偏二氟乙烯膜(polyvinylidene fluoride, PVDF)上;用5%脱脂奶粉封闭1 h,经三羟甲基氨基甲烷盐酸吐温(TBST)缓冲液洗涤后,加入一抗[Anti-β-Actin(ACTB)按1∶500 体积比稀释,Anti-c-Myc Mouse按1∶1 000 体积比稀释],然后置于冰上轻摇、孵育过夜;用TBST洗涤膜3次后,再分别加入二抗[羊抗鼠IgG(H+L)、HRP偶联物按1∶2 000体积比稀释],室温轻摇、孵育1.5 h;最后用TBST 洗涤3 次,采用底物化学发光ECL法显色1 min,使用MP全能成像仪显影。
1.7 U251 细胞凋亡情况的检测
1.7.1 细胞爬片
将预先处理好的盖玻片置于6 孔板中,并在每孔滴加适量的多聚赖氨酸,于室温下放置24 h 后,吸取出多余的多聚赖氨酸,并将盖玻片用磷酸缓冲液(phosphate buffer solution,PBS)洗涤2次,然后铺细胞。当细胞密度达到60%~70%后,进行空载体pRK5-myc 和重组质粒pRK5-myc-FOXO6 的转染,然后置于37 ℃、5%CO2条件下培养36 h,每4~6 h换液一次。
1.7.2 4’,6-二脒基-2-苯基吲哚染色
U251 细胞转染36 h 后,将6 孔板中的培养液吸出,并用PBS 洗涤2~3 次,每次1 min,然后使用4’,6-二脒基-2-苯基吲哚(4’,6-diamidino-2-phenylindole, DAPI)染色封闭剂进行封片,完毕后将其置于黑暗环境下室温放置24 h,次日使用荧光显微镜观察染色结果。
1.8 过氧化物酶体增殖物激活受体γ 共激活因子1α(peroxisome proliferator-activated receptor γ coactivator-1α,PGC-1α)表达的检测
将转染的细胞采用Trizol 法提取RNA 后,使用反转录试剂盒进行反转录,得到cDNA,然后对cDNA进行实时荧光定量PCR(quantitative real-time PCR,qPCR)扩增。qPCR(20 μL)程序设置:95 ℃预变性2 min;95 ℃变性10 s,58 ℃退火30 s,共进行39 个循环。各实验因子检测均以h-β-actin为内参,设立阴性对照,每个因子重复3 次,计算各样品的△CT值,再用2-ΔΔCT法统计并计算各组样品之间所有因子表达量的变化。
1.9 结果统计与分析
细胞凋亡结果用平均值±标准差表示,并用SPSS 17.0 软件进行单因子方差分析(one-way ANOVA),P<0.05 为差异有统计学意义,P<0.01为差异有高度统计学意义。
2 结果与分析
2.1 FOXO6 片段扩增产物的鉴定
使用FOXO6 上下游引物,从U251 细胞中提取RNA并进行反转录,得到cDNA,以得到的cDNA为模板进行PCR 扩增。经琼脂糖凝胶电泳后获得长度约1 600 bp 的DNA 片段(图1),与预期目标扩增长度一致。

图1 PCR产物的琼脂糖凝胶电泳图Fig.1 Agarose gel electrophoresis of PCR products
2.2 重组表达质粒的鉴定
随机挑取6个单菌落(图2,泳道A~F),提取质粒后用NotⅠ和SalⅠ进行双酶切,电泳结果(图2,泳道C~F)显示2条线性条带,一条为大小约5 000 bp的pRK5-myc 质粒,另一条为大小约1 600 bp 的FOXO6 条带,与理论计算的FOXO6 片段碱基对数1 680 bp相符,表明目的基因已经连接到质粒上;将DNA 测序结果与GenBank 进行比对表明,插入的DNA片段的序列与人源FOXO6基因的编码序列完全一致(图3)。
2.3 pRK5-myc-FOXO6 在U251 细胞中表达的蛋白质印迹法检测
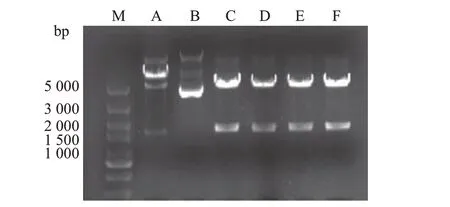
图2 重组质粒pRK5-myc-FOXO6双酶切鉴定电泳图Fig.2 Electrophoretogram of recombinant plasmid pRK5-myc-FOXO6 using double enzyme digestion
将转染了pRK5-myc-FOXO6 重组质粒的U251 细胞培养36 h 后,收集各组细胞总蛋白,通过蛋白质印迹法检测FOXO6 蛋白表达情况。使用Anti-c-Myc 抗体在分子质量大小约70 kDa 处检测到明显的特异性条带,说明pRK5-myc-FOXO6 重组质粒在U251 细胞中成功表达;而空载体在相应位置处无条带,说明其未表达(图4)。
2.4 U251 细胞凋亡情况的检测
DAPI 染色结果(图5)显示,转染pRK5-myc 空载体组中出现了少量以染色质固缩、染色加深和细胞核裂解为表型的细胞凋亡现象,而转染pRK5-myc-FOXO6重组质粒组出现了更加明显的凋亡现象,且细胞凋亡率(图6)更大,表明FOXO6 能够促进U251细胞的凋亡。
2.5 PGC-1α 表达情况的qPCR 检测
通过qPCR 检测发现,在转染了pRK5-myc-FOXO6 重组质粒的U251 细胞中,PGC-1α 的表达量明显下降(图7),这提示FOXO6导致的胶质瘤细胞凋亡,可能是其抑制了PGC-1α 表达进而影响了细胞的能量代谢及抗氧化过程,并最终导致了细胞的凋亡。
3 讨论
图3 重组质粒pRK5-myc-FOXO6的测序结果Fig.3 Sequencing results of recombinant plasmid pRK5-myc-FOXO6
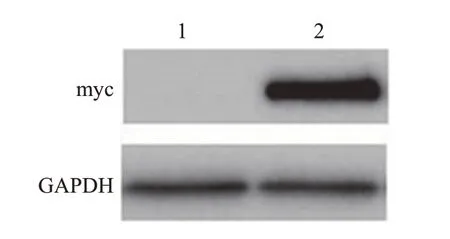
图4 pRK5-myc-FOXO6蛋白表达的蛋白质印迹法检测Fig.4 Detection of pRK5-myc-FOXO6 protein expression by Western blotting
在能量代谢过程中,活性氧(reactive oxygen species, ROS)主要在线粒体中连续产生[10],而当大量的ROS 在体内累积时,就会产生氧化应激,导致包括蛋白质、脂质和DNA 等在内的细胞成分的损伤,破坏细胞信号的正常传导机制,并可能引起细胞死亡[11]。PGC-1α 是细胞中一个重要的共转录调控因子。它与一系列转录调控因子相结合,参与下游众多信号分子的转录调控,进而调控很多重要的细胞进程。一方面,它可与转录调控因子NRF1 相结合,参与调控线粒体能量代谢过程[12-13];另一方面,它可以与过氧化物酶体增殖物激活受体γ共激活因子1β(peroxisome proliferator-activated receptor γ coactivator-1β, PGC-1β)等转录调控因子相结合,直接参与到细胞中超氧化物歧化酶(superoxide dismutase,SOD)、谷胱甘肽过氧化物酶(glutathione peroxidase,GSH-Px)、CAT 等抗氧化酶的转录调控中,控制细胞的氧化防御能力[14]。因此,当PGC-1α表达受到抑制的时候,细胞的能量代谢和氧化防御能力均会受到影响。此外,它能够促进线粒体的生物合成[15],由于大多数细胞中线粒体是ROS的主要产生场所,因此其与ROS的生成关系密切。多项研究表明癌细胞比正常细胞保持着更高的ROS水平,细胞内的ROS 可作为细胞信号级联反应的第二信使[16],这对肿瘤维持高增殖率、加速代谢和发生发展至关重要。但是,ROS 是一把双刃剑,它也会对细胞产生毒性作用,促进细胞的衰老和凋亡。因此,ROS 在癌细胞中的抗氧化机制比在正常细胞中更强。而在氧化应激状态下,PGC-1α 能够诱导抗氧化酶的表达,保护细胞免受氧化损伤[17]。STPIERRE 等[14]研究发现,PGC-1α 可以通过诱导谷胱甘肽过氧化物酶1(glutathione peroxidase-1,GPx-1)和SOD-2 的表达参与氧化防御过程,PGC-1α 水平的增加可显著保护神经细胞免受氧化应激介导而引起的死亡。
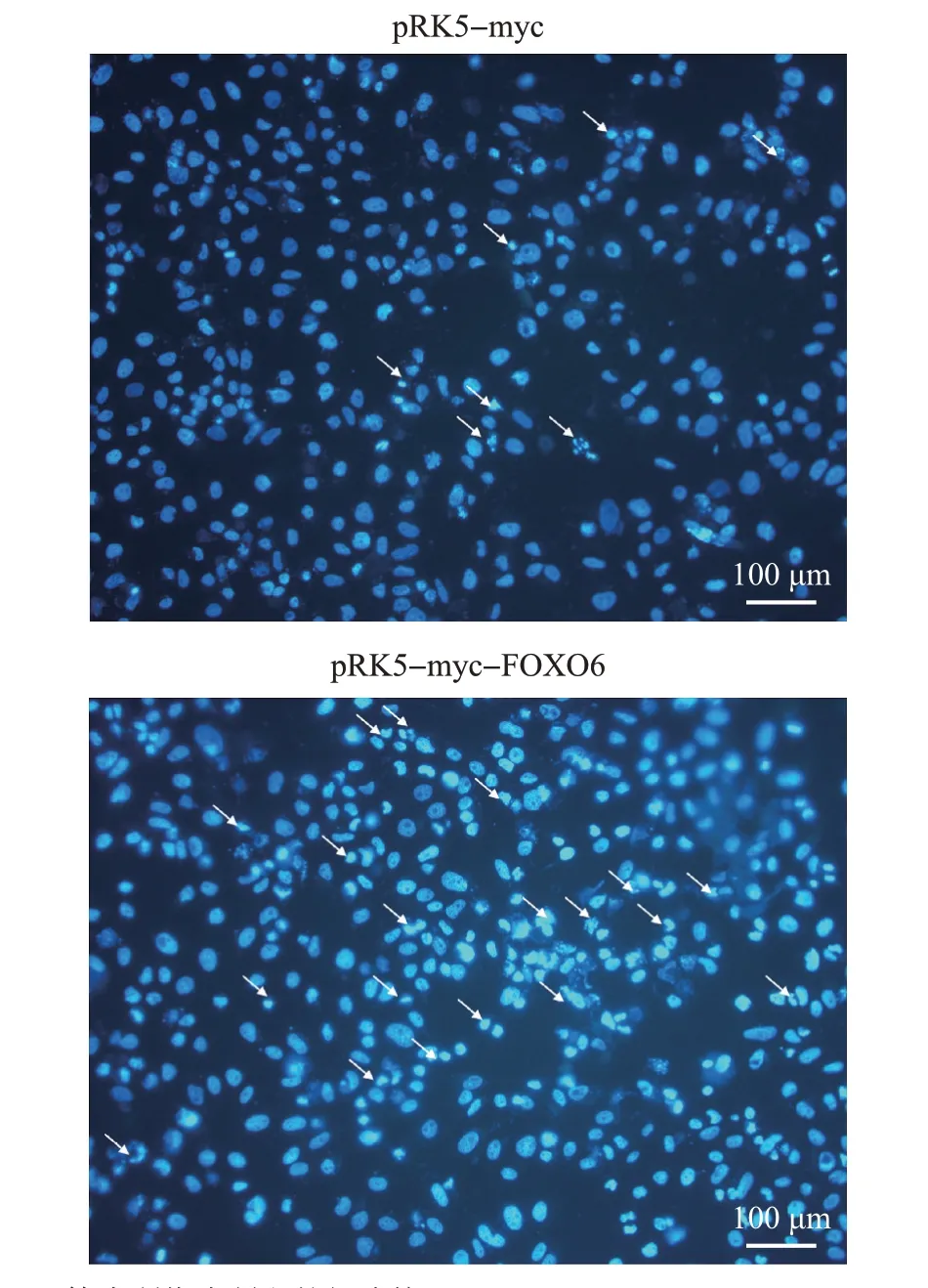
图5 U251细胞凋亡情况的DAPI染色检测Fig.5 Apoptotic detection of U251 cells by DAPI staining
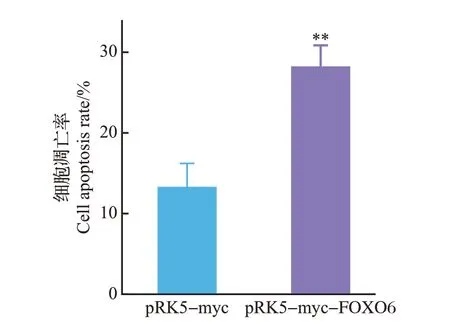
图6 空载体组和转染pRK5-myc-FOXO6 重组质粒组的细胞凋亡率Fig.6 Cell apoptosis rate in empty group and transfected pRK5-myc-FOXO6 recombinant plasmid group
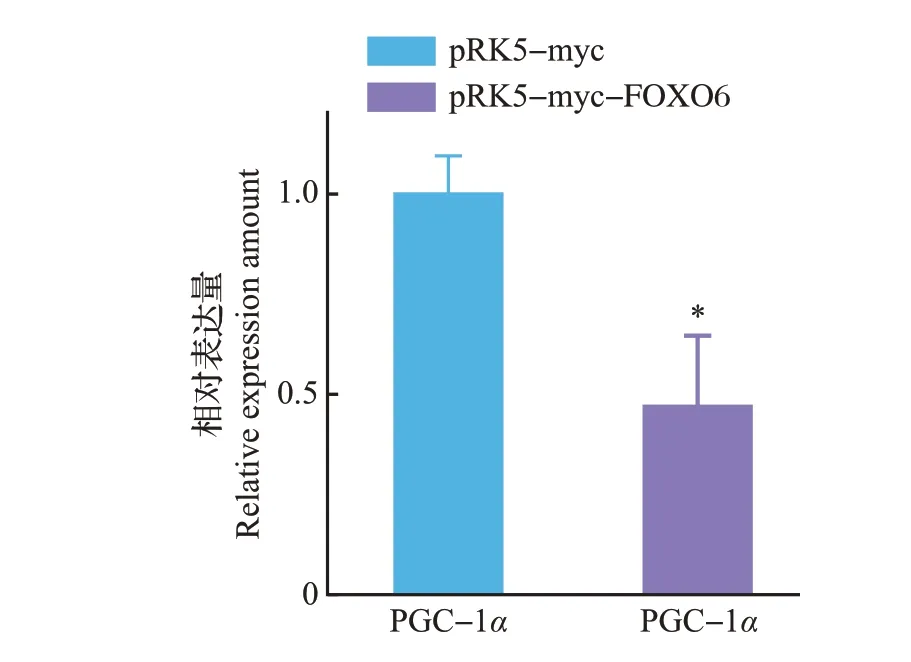
图7 PGC-1α表达情况的qPCR检测Fig.7 Expression of PGC-1α detected by qPCR
FOXO 家族是细胞应激反应的重要调节因子,ROS可以激活FOXOs的表达,促使其参与细胞氧化防御过程:在氧化应激状态下FOXO1对β细胞发挥短暂的 保护作用[18],FOXO3α 调控CAT 的生成[2],FOXO4 可通过上调锰超氧化物歧化酶(manganese superoxide dismutase, MnSOD)和CAT 来清除线粒体和细胞中的氧化应激产物,保护细胞免受氧化应激的损伤[19]等。而FOXO6 是否也如该家族的其他成员一样参与了氧化防御过程尚不明确,但是目前已经证实FOXO6在肿瘤进程中发挥着重要作用:LI等[6]的研究结果表明,FOXO6 与HNF4 结合形成复合物,激活C-myc的表达以促进胃癌的进程;而HU等[7]的研究发现,FOXO6的过表达会抑制A549人肺癌细胞的增殖,但内源性FOXO6 的表达下调则会增强细胞的增殖。
目的基因进入真核细胞并进行高效复制和蛋白质表达,需要装入载体才能实现。而质粒是染色体外能够进行自主复制的遗传单位,具有分子质量小、携带抗性基因、转化效率高等优点,因此是基因工程最常用的转运载体。我们的研究发现,转染了pRK5-myc-FOXO6 重组质粒组中的PGC-1α 的表达量显著下降,并且通过DAPI 染色发现,转染pRK5-myc-FOXO6 重组质粒组的细胞染色质出现固缩、染色加深,细胞核破裂、解体等现象,细胞死亡率为28%,显著高于转染pRK5-myc 空载体组。这表明FOXO6能够通过抑制PGC-1α的表达,抑制胶质瘤细胞的能量代谢及其氧化防御进程,从而促进了U251细胞的凋亡,因此,FOXO6可能成为治疗胶质瘤的靶点,但是其具体作用机制及相关信号通路尚不明确。本实验构建的pRK5-myc-FOXO6重组质粒因其带有myc 标签而使载体具有高度的免疫灵敏性,这为后续深入研究FOXO6 抑制胶质瘤的机制奠定了基础,也为胶质瘤的治疗开辟了新的途径。

