表没食子儿茶素没食子酸酯对葡聚糖硫酸钠诱导小鼠炎症性肠病的保护作用
赵悦伶,丁健,何佳,孔德栋,徐平*,王岳飞
(1.浙江大学农业与生物技术学院茶叶研究所,杭州310058;2.浙江大学医学院免疫研究所,杭州310058)
炎症性肠病(inflammatory bowel disease, IBD)包括溃疡性结肠炎和克罗恩病,主要以结肠持续或周期性炎症为特征。世界卫生组织统计发现,IBD的发病率在慢性病发病率中位列第2,仅次于风湿性关节炎。我国溃疡性结肠炎和克罗恩病的患病率暂无确切统计数据,据研究人员推测,每10 万中约有11.6 人次患溃疡性结肠炎,每10 万中约有1.4人次患克罗恩病,真实情况可能更加严峻[1]。IBD与增加的结肠氧化应激、由结肠上皮细胞和浸润炎细胞产生炎性细胞因子及肠道屏障功能的丧失相关联[2]。细胞因子在IBD发病机制中起着至关重要的作用。在试验性结肠炎和IBD患者体内,由肠道固有层细胞分泌产生的白介素-6(interleukin-6, IL-6)、肿瘤坏死因子(tumor necrosis factor,TNF)(多指TNF-α)都有增加,并发挥促炎症功能。T细胞产生的白介素-10(interleukin-10,IL-10)通过抗原呈递细胞和T细胞抑制促炎细胞因子的产生[3],相关的细胞因子治疗方法已在IBD患者上使用。
表没食子儿茶素没食子酸酯(epigallocatechin gallate,EGCG)是茶叶中最具有活性的成分,具有抗氧化[4-5]、抗炎、抗肿瘤[6]等作用,如:EGCG对过氧化氢引起的神经细胞损伤有保护作用[7],可降低人体血液中脂质的过氧化水平[8],对肝细胞氧化损伤具有积极的保护作用[9]等。流行病学调查研究表明,饮茶能够降低溃疡性结肠炎和克罗恩病的发病率[10-13],且在随机对照实验中,每天服用400 mg 或800 mg 的EGCG 对5-氨基水杨酸或咪唑硫嘌呤耐药的IBD病人有明显的治疗效果,且其副作用小[14]。
研究表明,儿茶素能够抑制过度的氧化应激和促进抗氧化物质的活化,减少结肠的氧化损伤,调控和活化炎症相关的氧化应激信号通路[15]。同时,儿茶素能够调控Toll 样受体4(Toll like receptor 4,TLR4)的表达,阻断NF-κB的活化及调控上游核因子kappa-B 激酶抑制剂(inhibitor of nuclear factor kappa-B kinase,IKK)复合物,抑制体内TNF-α的表达[16];儿茶素还能改善溃疡性结肠炎,稳定肥大细胞[17]。此外,研究人员还发现茶黄素和EGCG 能够减少IBD 的炎症情况,减少肠癌细胞的增殖[18]。而EGCG在肠道中是作用于肠上皮细胞还是肠道固有层细胞还未见报道。葡聚糖硫酸钠(dextran sulfate sodium, DSS)能够破坏肠道的黏膜屏障及上皮细胞,使得肠道微生物能够进入固有层,从而产生持续性的炎症反应,因此,EGCG对炎症性肠病的保护机制到底是修复了肠上皮细胞之间的紧密连接还是抑制了固有层细胞的炎症因子分泌,还不太明确。在本实验中,我们通过DSS 诱导损伤,建立了小鼠的炎症性肠炎模型,将小鼠肠道组织分离成肠上皮细胞和肠道固有层细胞,分别进行相关检测以探究EGCG 对这2 种细胞的作用情况,并研究EGCG对炎症小鼠小肠、脾及炎症因子等的影响,评价EGCG 对炎症性肠炎的保护作用,为阐释EGCG对炎症性肠病的作用机制提供参考。
1 材料与方法
1.1 实验材料和试剂
雄性C57BL/6J小鼠(7周龄,清洁级,购于上海斯莱科公司),于浙江大学实验动物中心饲养,且动物实验征得浙江大学实验动物伦理委员会同意(ZJU20190004)。DSS(MP Biomedicals公司,美国);96孔板(康宁公司,美国);8连管(康宁公司,美国);离心管[爱思进生物技术(杭州)有限公司];EGCG(99%纯度,浙江省湖州荣凯植物提取有限公司);小鼠IL-6、IL-10、TNF-α 酶联免疫吸附测定(enzymelinked immuno sorbent assay, ELISA)试剂盒(福建省泉州市科诺迪生物科技有限公司);反转录试剂盒(qPCR RT master mix,TOYOBO 公司,日本);Trizol 试剂、SYBR 荧光定量PCR 试剂盒(TaKaRa公司,日本);无血清RPMI 1640 培养基、磷酸盐缓冲液(phosphate buffer solution,PBS)、双抗溶液(杭州吉诺生物医药技术有限公司);无水乙醇、甲醇、异丙醇、甲醛溶液(国药集团化学试剂有限公司);乙二胺四乙酸二钠盐(ethylenediamine tetraacetic acid disodium salt, EDTA-2Na)(BIOSHARP 公司,中国);二硫苏糖醇(dithiothretiol, DTT)(Merck 公司,德国);4 型胶原酶、焦碳酸二乙酯(diethylpyrocarbonate,DEPC)水[生工生物工程(上海)股份有限公司]。
主要溶液的配制:
1)小鼠固有层消化液:将5%胎牛血清(fetal bovine serum, FBS)、300 U/mL 4 型胶原酶溶解到50 mL无钙镁PBS溶液中。
2)小鼠肠上皮分离液:将5% FBS、1.86 g EDTA-2Na 和1 mmol/L DTT 溶解到1 000 mL 无钙镁平衡盐溶液中。
3)DSS 水:将DSS 粉末溶解在无菌水中,配成质量分数为2%的溶液。
4)EGCG水:将99%EGCG粉末溶解在无菌水中,配成质量分数为0.5%的溶液。
1.2 仪器设备
医用低温保存箱(山东省青岛海尔特种电器有限公司),数显恒温水浴锅(国华电器有限公司),L600台式低速离心机(湖南湘仪实验室仪器开发有限公司),Infinite M200Pro 酶标仪(TECAN 公司,瑞士),实时荧光定量PCR 仪(Applied Biosystems 公司,美国),超净工作台(苏净集团苏州安泰空气技术有限公司),电子天平(赛多利斯科学仪器有限公司),明澈-D UV24纯水/超纯水一体机(彤迪科学仪器有限公司),CO2细胞恒温培养箱[赛默飞世尔科技(中国)有限公司]。
1.3 DSS 诱导的IBD 模型及EGCG 处理模型的建立
将7 周龄雄鼠随机平均分为3 组,如表1 所示:空白组正常给水11 d;对照组为前7 d喂2%DSS溶液,后4 d 正常给水;EGCG 处理组为前7 d 喂2%DSS 溶液,后4 d 喂0.5%EGCG 溶液。每天对小鼠进行称量,观察小鼠的活动状态及腹泻、便血情况,并按照相应的评分标准予以评分。

表1 模型建立和分组Table 1 Model building and groups
1.4 结肠组织上清液制备
通过脱颈椎处死小鼠,并对各组进行标记。取小鼠肠组织(直肠+结肠),置于干净的培养皿中,加入预冷的PBS溶液并用注射器反复多次洗净,取近肛门端约1 cm 处肠组织进行称量(约40 mg),记录后在超净台上加入含3 倍双抗浓度的PBS 溶液,反复冲洗多次以保证无粪便残留,然后将组织加入到450 μL 的RPMI 1640 培养基中,在CO2恒温细胞培养箱内培养24 h后,收集上清液,用于IL-6、IL-10、TNF-α的ELISA检测。
1.5 肠道固有层细胞和肠上皮细胞分离
1)将肠组织放入干净的培养皿中,加入预冷的PBS溶液,用注射器将小鼠肠道粪便冲洗净,然后纵向切开,再用PBS 溶液冲洗掉结肠内的黏液,倒去浑浊的PBS 清洗液,重复之前的清洗操作,反复多次,直到无明显的污渍、血迹。
2)将干净的肠组织剪成4 mm 左右的碎片,放入干净的15 mL 离心管中,加入适量预冷的PBS 溶液,轻轻摇晃,倒去PBS,重复清洗3次后,每管加入5 mL经37 ℃预热的肠上皮分离液,摇晃均匀,将离心管置于恒温摇床(150 r/min,37 ℃)上,消化20 min 左右后,剧烈上下颠倒,并振荡,同时准备新的15 mL 离心管,用移液枪吸出离心管内的分离液过筛网,过滤完成后将没有滤过筛网的未消化碎片重新放回原来的离心管中,再次加入新的肠上皮分离液进行消化,并过滤。将吸出的分离液收集到新的离心管中,在离心机上离心(400 g,5 min)结束后弃去上清液,收集得到小鼠肠上皮细胞,加入Trizol试剂,以备提取RNA。
3)将上一步未被消化的碎片重新收集到新的15 mL 离心管中,加入适量预冷的PBS 溶液充分混匀并振荡,用移液管吸出并弃去溶液,反复多次,保证尽量洗去残留的分离液。
4)取出碎片并用实验剪刀剪成1 mm左右的碎片,用移液枪加入6 mL经37 ℃预热的小鼠固有层消化液,摇晃均匀后放入恒温摇床(150 r/min,37 ℃)上,消化20 min左右后,上下颠倒并振荡20 s,将消化液过筛网过滤,然后收集到新的离心管中;将未消化完全的碎片重新收集到离心管中,再次加入适量固有层消化液继续消化,反复多次,直到看不到肉眼可见的碎片。
5)将上述含有固有层细胞的液体重新收集到新的15 mL 离心管中,300 g 离心10 min,然后加入适量PBS+3% FBS 的混合液,充分混匀后弃去液体,重悬细胞,反复2次,洗涤结束后每孔加入1 mL Trizol试剂,以备提取RNA。
1.6 ELISA 检测
肠组织培养上清液中IL-6、IL-10、TNF-α的蛋白水平采用相应的小鼠ELISA试剂盒进行测定,相关步骤按照试剂盒说明书进行,最后用Infinite M200Pro酶标仪进行检测。
1.7 RNA 提取、反转录和实时荧光定量聚合酶链式反应
小鼠总RNA 通过实验室常用的Trizol 法进行提取。向含有细胞的Trizol溶液中加入200 μL三氯甲烷并剧烈振荡,于冰上静置5 min 后,在1.2×104r/min、4 ℃条件下离心15 min,然后取400 μL 上清液移至新的试剂管内,加入400 μL 异丙醇,轻微颠倒振荡,在冰上静置15 min后,在1.2×104r/min、4 ℃条件下离心5 min。加1 mL 70%无水乙醇,在1.2×104r/min、4 ℃条件下离心5 min,小心去掉上清液;再加入1 mL无水乙醇,在1.2×104r/min、4 ℃条件下离心5 min;小心去掉上清液,等待风干,之后用20 μL DEPC 水溶解,65 ℃水浴5 min。置于冰上检测其浓度并调节浓度,然后用TOYOBO反转录试剂盒进行反转录,37 ℃水浴1 h,然后95 ℃水浴5 min,置于-80 ℃冰箱中保存。对反转录成的cDNA 浓度进行测定后,用DEPC 水稀释并进行实时荧光定量聚合酶链式反应(polymerase chain reaction,PCR)扩增。每孔反应体系如下:SYBR 混合物12.9 μL,上游引物0.3 μL,下游引物0.3 μL,cDNA 1.5 μL。
在冰上完成加样后用封板膜封口并离心,使用实时荧光定量PCR仪进行测定,引物序列见表2。

表2 引物序列Table 2 Primer sequences
1.8 苏木精-伊红染色
通过脱颈椎处死小鼠,取直肠近肛门处约1 cm长度的肠组织,放入10%甲醛水溶液中固定,石蜡包埋,进行苏木精-伊红(hematoxylin-eosin,HE)染色,并拍照。
1.9 便血和腹泻评分
便血评分标准如表3所示;腹泻评分标准如表4所示。

表3 便血评分标准[19]Table 3 Hematochezia scoring criteria[19]

表4 腹泻评分标准[19]Table 4 Diarrhea scoring criteria[19]
1.10 统计学分析
实验数据采用IBM SPSS Statistics 20.0 软件进 行配对样本t 检验分析。P<0.05 时用*表示,P<0.01 时用**表示。数据均由3 次或3 次以上独立重复实验获得。
2 结果与分析
2.1 小鼠体质量变化、便血和腹泻情况
小鼠体质量变化如图1A所示。由于DSS诱导引发了小鼠炎症反应,从第4天开始,小鼠体质量出现明显下降,而对照组在改喂水后,体质量逐渐趋于平稳,且之后略有上升,然而EGCG 处理组在改喂EGCG 后,体质量出现了进一步的下降,体质量减少率甚至达到了40%左右。
小鼠便血情况如图1B 所示。由于DSS 诱导小鼠引发肠道炎症反应,对照组和EGCG 组小鼠从第3 天开始粪便出现明显的血丝,并随着DSS 不断地摄入,便血情况不断加剧,在第5、6天时小鼠甚至出现了便血情况。对照组和EGCG 组在改喂水和EGCG后,便血情况没有进一步的加剧,而EGCG组相较对照组并没有出现明显的改善。
小鼠腹泻情况如图1C 所示。腹泻情况与便血情况相当,从第2、3天开始有轻微的腹泻出现,随着天数的增加,腹泻情况加重,到第7 天时,通过观察可以发现粪便已无具体形态,部分炎症小鼠有轻微的脱肛现象,身体蜷缩,活动状态大不如前,停止DSS摄入后,小鼠身体状况慢慢有所缓解。

图1 EGCG对小鼠体质量变化率和便血、腹泻情况的影响Fig.1 Effects of EGCG on body mass change rate,hematochezia and diarrhea of mice
2.2 小鼠肠组织长度和脾大小变化
小鼠结肠长度情况如图2A 所示。通过测量长度发现,空白组结肠长度明显长于其他2组,EGCG组略短于对照组,且EGCG 组回盲瓣部位皱缩。这说明对于DSS诱导的实验性肠道炎症,0.5%EGCG会加重炎性肠病的病理特征。
由图2B可以看出,对照组的脾大于EGCG组的脾。这说明对于DSS诱导的肠道炎症,0.5%EGCG会减轻由肠道炎症引起的小鼠体内免疫反应和全身性炎症反应。

图2 各组小鼠肠组织长度(A)及脾大小(B)比较Fig.2 Comparison of colons’length(A)and spleen size(B)of mice in each group
2.3 小鼠肠道固有层细胞中IL-6、IL-10、TNF-α的表达情况
分离各组小鼠的肠道固有层细胞,并检测炎症因子IL-6、IL-10、TNF-α的表达情况。如图3所示,由于DSS诱导引发小鼠炎症,在mRNA水平上,对照组和EGCG 组IL-6、IL-10、TNF-α 基因的表达水平明显高于空白组。另外,我们还发现EGCG 组小鼠IL-6、TNF-α的表达水平显著低于对照组(P<0.01),而IL-10的表达水平无明显变化(P>0.05)。这些都表明EGCG 能够作用于IBD 小鼠肠道固有层细胞,抑制其炎症因子的表达,具有一定的抑炎作用。
2.4 小鼠结肠组织上清液中IL-6、IL-10、TNF-α的表达情况

图3 EGCG对小鼠肠道固有层细胞中IL-6、IL-10和TNF-α表达的影响Fig.3 Effects of EGCG on IL-6,IL-10 and TNF-α expression in intestinal lamina propria cells of mice

图4 EGCG对小鼠结肠组织上清液中IL-6、IL-10和TNF-α表达水平的影响Fig.4 Effects of EGCG on the expression level of IL-6,IL-10 and TNF-α in culture supernatants of colon tissues of mice
从图4 可以发现:EGCG 组小鼠比对照组小鼠IL-6、TNF-α 的表达水平降低,说明在EGCG 作用下,炎症因子的分泌得到了一定的抑制;而IL-10的分泌无明显变化(P>0.05)。
2.5 小鼠肠道HE 染色结果及小鼠肠道病理组织变化
对小鼠肠道进行HE染色并观察,结果如图5所示。对照组和EGCG 组小鼠肠道细胞较空白组出现了明显的水肿、隐窝增生、肠道溃疡现象,且肠道黏膜和肠上皮屏障出现严重损伤,单核细胞、多形核细胞、淋巴细胞数量增多,但对照组和EGCG 组之间的变化无明显差别。提示0.5%EGCG 对肠组织的结构保护作用并不明显。
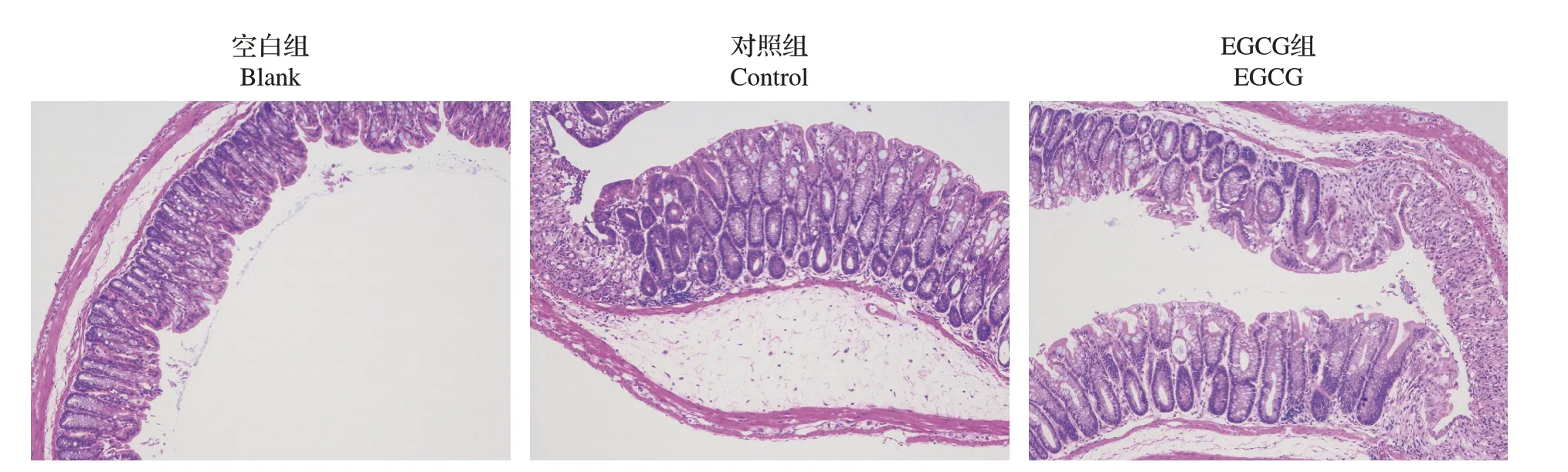
图5 各组小鼠肠道HE染色Fig.5 HE-staining of colonic sections of mice in each group
2.6 小鼠肠上皮细胞中紧密连接蛋白claudin-1、occludin 的表达情况
紧密连接蛋白是紧密连接结构和组成的重中之重,如果紧密连接蛋白的表达出现了异常,那么紧密连接结构的功能会受到极大的影响。近几年以来,有研究人员在细胞紧密连接区域不断发现各种具有特异性的蛋白,如claudin蛋白家族及跨膜蛋白occludin 等。有研究表明,在炎症反应中炎症因子的增加不仅会极大地影响紧密连接蛋白的表达,同时还会影响其在细胞胞膜上的分布,使得紧密连接结构的完整性受到破坏[20]。我们对小鼠肠上皮细胞中紧密连接蛋白occludin和claudin-1的表达情况进行了检测,结果如图6所示。在mRNA水平上,对照组和EGCG 组之间的claudin-1、occludin 表达量无明显变化(P>0.05)。

图6 EGCG 对小鼠肠上皮细胞紧密连接蛋白occludin 和claudin-1 mRNA表达的影响Fig.6 Effects of EGCG on occludin and claudin-1 mRNA expression in intestinal epithelial cell of mice
3 讨论
正常机体的免疫系统和肠道微生物相互作用并形成一种精细且微妙的稳态环境,而一旦有外来物影响机体与肠道微生物之间的稳态调节,原本的平衡就会被打破,进而导致炎症性肠病等一系列病症的发生[19]。所以,在本实验中DSS 诱导小鼠肠道炎症模型的原理,就是利用了DSS对黏膜屏障和肠上皮细胞功能破坏的特性,使机体内部的保护屏障出现漏洞,让外来抗原有机可乘,进入到固有层中,并诱发了一系列的免疫和炎症反应,最终形成炎症性肠病(IBD)模型。本实验通过设立空白组、对照组和EGCG 处理组来探究EGCG 对DSS 诱导小鼠炎症性肠病的影响。
有研究发现,EGCG 的治疗能够减缓DSS 诱导的结肠变短及脾变大[21]。在本实验中,通过记录小鼠的体质量变化、便血及腹泻情况,我们发现EGCG对便血、腹泻情况的影响无显著差异。另外,我们还发现在已经患有炎症性肠病的情况下,摄入EGCG 会进一步地引起体质量的降低,这与BITZER 等[21]的研究结果一致。但在BITZER 等[21]的研究中DSS浓度为1.5%,EGCG浓度为0.32%,均比本实验中这2 种物质的浓度低一些,故推测较轻度的肠炎模型可能在较低浓度的EGCG 中有一定的恢复效果,而在比较严重的肠炎模型中,较高浓度的EGCG 可能会加重肠炎的病症。另有文献表明,EGCG 可以减少热量和常量营养素的吸收[22-24]。在肥胖的情况下,这种减少热量和营养素消化吸收的作用有助于体质量的减轻。然而,本研究结果表明,EGCG 在IBD 模型中加剧了小鼠体质量减轻的症状,这说明如果将EGCG 用于炎症性肠病的治疗,必须考虑EGCG 对患者体质量减轻的不利影响。在炎症性肠病中,多种免疫细胞和基质细胞群(如巨噬细胞、树突状细胞、效应T细胞、脂肪细胞和成纤维细胞)会产生可溶性和膜结合性肿瘤坏死因子(TNF)。TNF在炎症性肠病的发炎黏膜中能发挥多种促炎作用,尤其是TNF 能诱导血管生成,增强巨噬细胞和T 细胞产生促炎细胞因子的能力,引起肠道屏障改变,促进肠上皮细胞和潘式细胞的死亡。TNF 还能通过增加肌成纤维细胞的基质金属蛋白酶分泌、驱动T 细胞的抗凋亡作用和激活NFκB来促使组织遭到更严重的破坏[3]。有研究通过检测IBD患者肠道内炎症因子的表达情况发现,TNFα mRNA表达水平明显升高[25-26]。
与TNF-α相似,IL-6也是肠炎炎症反应中重要的炎症因子。巨噬细胞及单核细胞在受到刺激后开始大量产生IL-6,而IL-6通过在局部的炎症反应及损伤过程中发挥作用,使细胞生长加速,并加快细胞的分化速度,其在炎症反应中担任了多种角色,如刺激细胞毒性T 细胞反应的发生;另外,IL-6还使B 细胞活化形成浆细胞,从而使免疫球蛋白在细胞中的浓度不断上升;IL-6还有一个非常大的作用就是加速了造血干细胞从G0期进入G1期的过程,大大缩短了干细胞的细胞周期,使单核细胞、巨噬细胞和粒细胞的数量在短时期内得到快速增加[27]。有研究人员发现,IL-6表达明显增加的情况在肠炎的损伤组织中均存在,其中在巨噬细胞的胞质内被发现含量最多,并且IL-6的表达程度及分布情况与患者肠炎的病变程度呈正相关[3,25]。
IL-6、IL-10 和TNF-α 在炎症反应过程中均发挥了非常重要的作用,被认为可以作为炎症反应重要的炎性调节介质。我们通过检测小鼠固有层细胞中IL-6、IL-10 和TNF-α 的表达情况发现,0.5%EGCG能够降低IL-6、TNF-α的表达,但对IL-10的分泌和产生无明显作用,说明EGCG 能够减少炎症因子的表达和分泌,即EGCG 在抗炎方面对IBD 小鼠可能起到了保护作用。
有资料显示,在保护机体免受外来抗原物入侵的过程中,肠道黏膜和肠道上皮屏障担任了非常重要的保护角色,同时还在维持肠道对食物的消化吸收、稳定机体内肠道微环境等机体活动中发挥着重要作用。在DSS诱导的肠炎中,肠道黏膜和肠上皮细胞都会受到不同程度的破坏,如肠上皮通透性增加,大分子物质的转运增多,紧密连接蛋白功能出现异常,肠道稳态微环境遭到破坏,肠道黏膜免疫系统失去对肠道菌群的耐受性,从而产生非正常的持续性应激免疫反应等[3,19]。
本实验发现,EGCG 对紧密连接蛋白claudin-1、occludin的表达无明显作用,小鼠肠道HE染色的病理变化情况在各实验组间也没有得到明显的修复。推测0.5%EGCG 可能对肠道上皮屏障的损伤无明显的修复作用,也可能EGCG 只在抗炎症反应方面对肠炎患者进行了保护,而在肠道中的病理症状和肠上皮中的紧密连接蛋白方面无明显保护作用。因此,EGCG 是否能够真正对患有炎症性肠炎的病人起到保护作用还有待进一步研究。综上所述,虽然0.5%EGCG对肠炎小鼠的肠道组织病理特征,肠上皮黏膜相关的组织、蛋白相关变化无明显影响,且会加重小鼠体质量的下降趋势,但是EGCG能够抑制炎症因子的分泌,甚至能减少由肠道炎症引起的小鼠全身性炎症反应,对DSS诱导的炎症性肠病小鼠起到一定的保护作用。

