葡萄F1代杂交种的SRAP分子标记鉴定
耿牡丹,刘 俊,孙瑞芬,赵 镒,石慧芹,苏慧明,金 珂
(1.内蒙古自治区园艺研究院,内蒙古 呼和浩特 010010;2.内蒙古自治区农牧业科学院 生物技术研究中心,内蒙古 呼和浩特 010031;3.包头市果树果品科学技术研究所,内蒙古 包头 014045)
葡萄是我国重要的经济果树,加速葡萄新品种培育对葡萄产业化发展具有举足轻重的作用。我国葡萄育种途径主要有实生选种、杂交育种、芽变选种、人工诱变育种等,其中杂交育种是最常用、也是成功率最高的育种手段,我国68%的优良品种来源于杂交育种[1]。葡萄品种繁多,资源丰富,不同地域品种杂交导致葡萄品种命名混乱,同名异物或同物异名成为普遍现象,且葡萄具有闭花受精习性,在杂交育种中,可能由于人工去雄套袋的不及时或去雄不彻底等原因使后代中混有自交苗,造成真假杂交种苗混杂,使杂交育种效率降低。因此,就杂交种的真实性进行鉴定对葡萄新品种创制具有重要意义。
葡萄杂交后代的鉴定方法主要有形态学、细胞学、同工酶及分子标记等方法。形态学鉴定是传统的鉴定方法,容易受环境条件和栽培措施的影响,且其周期较长;细胞学鉴定程序较烦琐,技术水平要求高,对于染色体小且相似的个体难于准确识别;同工酶标记难以体现亲缘关系近的杂种之间的差异,而且同工酶在植物体内较敏感,其标记结果易受取材多少、采样部位、时间及环境条件等诸多因素的影响[2];分子标记技术的发展提供了直接以DNA 图谱的方式显示、在基因水平上揭示杂交子代与父母本间的遗传差异,标记位点多、多态性高,且不受环境及发育等因素的影响,为杂交后代进行早期快速鉴定与选择提供新的理论依据。王西平等[3]利用RAPD标记技术鉴定了我国野生葡萄毛葡萄商-24 与欧洲葡萄龙眼的F1代杂交种。樊秀彩等[4]利用SSR 分子标记技术鉴定了山葡萄和河岸葡萄的种间杂交种。朱骏驰等[5]利用SSR 分子标记技术鉴定了玫瑰香与红地球的210 个杂交种后代。
SRAP 分子标记是一种基于PCR 的分子标记技术,该标记技术具有简便、高效、快速、重复性好、多态性高、无须预知物种序列信息的特点,已成功地应用于不同物种种质资源遗传多样性分析[6-8]、杂交种鉴定[9-10]、遗传图谱的构建[11-12]以及重要性状的标记[13]等方面的研究。本研究采用SRAP 技术对3 对葡萄种间杂交组合红提×红玫瑰、红提×贝达和红提×贵妃的F1代实生苗进行杂种真实性鉴定,以建立有效的葡萄杂交种鉴定方法,从而为葡萄新种质的创制提供辅助选择手段。
1 材料和方法
1.1 植物材料
葡萄亲本材料欧亚种品种红提、红玫瑰、贵妃和美洲种贝达幼嫩叶片采自内蒙古包头市沙尔沁村种植户;红提×红玫瑰的2 个F1代实生苗、红提×贝达的3 个F1代实生苗和红提×贵妃的3 个F1代实生苗幼叶均采自内蒙古自治区园艺研究院科技示范园13 号大棚。采集时间为2018年7月,采集的叶片于液氮中速冻后,-80 ℃保存备用。
1.2 主要试剂
植物基因组DNA 提取试剂盒、Loading Buffer购自天根生化科技(北京)有限公司;2×Taq PCR Master Mix、琼脂糖、核酸染料购自南京博尔迪生化试剂有限公司;50 bp DNA Ladder(Dye Plus)和100 bp DNA Ladder(Dye Plus)购自TakaRa 公司,其他常规试剂均为进口或国产分析纯试剂;引物由南京金斯瑞生物科技有限公司合成,引物序列见表1。

表1 SRAP 引物序列
1.3 植物基因组DNA 提取与检测
用植物基因组DNA 提取试剂盒提取各试验样品的基因组DNA,提取方法按照试剂盒说明书进行。提取的DNA 经1%琼脂糖凝胶电泳检测DNA的完整性,通过超微量紫外分光光度计检测DNA的浓度及纯度后,将样品DNA 浓度稀释为20 ng/μL,-20 ℃保存备用。
1.4 SRAP-PCR 引物的筛选
用14 条正向引物和14 条反向引物组合成196对SRAP-PCR 引物(表1),以4 个亲本材料的DNA为模板进行SRAP 扩增,每对引物重复3 次。SRAPPCR 反应体系为12.5 μL,其中2×Taq PCR Master Mix 6.25 μL,上游引物0.25 μL,下游引物为0.25 μL,dd H2O 4.75 μL,模板DNA 1 μL。PCR 扩增程序为94 ℃预变性5 min;94 ℃变性1 min,45 ℃退火1 min,72 ℃延伸1 min,循环5 次;94 ℃变性1 min,63 ℃退火1 min,72 ℃延伸1 min,循环35 次;72 ℃延伸10 min。PCR 产物经2%琼脂糖凝胶电泳后,利用Bio-Rad 凝胶成像系统扫描照相。将能够扩增出清晰、稳定的父本特异性条带的引物,或在每对杂交组合的父、母本间能够产生清晰、稳定的多态性条带的引物作为鉴定F1代杂交种的SRAP 扩增引物。
1.5 F1 代杂交种的SRAP-PCR 分析
在SRAP-PCR 中,以扩增出父本特异性条带的杂种确定为真杂种。以此为判定标准,鉴定F1代杂交种的真实性有2 种情况:(1)有父本的特异条带,有或无子代的特异条带;(2)既有母本的特异条带又有父本的特异条带,有或无子代的特异条带。如果只有母本和子代的特异条带而没有父本的特异条带,则认为母本的自交种或假杂种。每对引物重复3 次SRAP 扩增。
2 结果与分析
2.1 植物基因组DNA 检测
用植物基因组DNA 提取试剂盒提取4 份亲本材料及8 份F1代植株叶片总DNA,经1%琼脂糖凝胶电泳检测DNA 条带清晰且没有明显拖尾(图1);通过超微量紫外分光光度计检测DNA 的浓度及纯度,DNA 的A260/280比值均在1.8~2.0,说明所提DNA 完整性好,纯度较高,符合后续试验要求。将试验样品DNA 浓度稀释为20 ng/μL,用于SRAP 扩增的模板。

图1 葡萄基因组DNA 电泳结果
2.2 SRAP-PCR 引物组合筛选
由于SRAP 标记或为显性标记或为共显性标记,在双亲中进行引物筛选时,无法判断具有父本特异位点的类型是纯合显性位点还是杂合显性位点,故至少需要3~5 个SRAP 标记进行综合分析。将14 条正向引物和14 条反向引物组合成196 对SRAP 引物组合,分别对3 对亲本组合的父、母本进行SRAP-PCR 扩增,选择在每对组合的父、母本间产生清晰、稳定的多态性条带的引物,作为F1代杂交种鉴定的引物。经过反复筛选,选出可以鉴定红提×红玫瑰及其F1代杂交种的引物有4 对(Me1/Em10、Me8/Em13、Me9/Em3 和Me9/Em10);可以鉴定红提×贝达及其F1代杂交种的引物有10 对(Me1/Em10、Me2/Em11、Me3/Em10、Me4/Em10、Me5/Em6、Me8/Em13、Me9/Em3、Me9/Em10、Me13/Em5 和Me14/Em3);可以鉴定红提×贵妃及其F1代杂交种的引物有4 对(Me1/Em10、Me2/Em11、Me5/Em6 和M8/Em13)。
2.3 红提×红玫瑰的F1 代杂交种鉴定
从筛选出的4 对SRAP-PCR 引物中选择3 对进行红提×红玫瑰的2 个F1代杂交种的鉴定。以红提(♀)、红玫瑰(♂)以及红提×红玫瑰的2 个F1代植株基因组DNA 为模板,分别用引物Me1/Em10、Me9/Em3 和Me8/Em13 进行SRAP 扩增。在引物Me1/Em10 的扩增中,400~500 bp,2 个子代均有父本的特异条带,说明有父本基因的渗入;子代2(2F1)在1 500 bp 以上还有1 条自己的特异条带(图2A,箭头所示),说明在子代2 中产生了变异,符合真实杂交种的判定标准。在引物Me9/Em3 的扩增中,由图2B 可知,2 个子代在700~800 bp 均有1 条父本的特异条带,说明均有父本基因渗入;子代1(1F1)在1 000~1 500 bp 有1 条清晰的母本特异条带,所以认为,2 个子代均为真杂种。在引物Me8/Em13 的扩增中,由图2C 可知,2 个F1代植株均在1 000 bp 处和600~700 bp 分别有1 条清晰的父本特异条带,在1 000~1 500 bp 有1 条清晰的母本特异条带;子代2(2F1)在500~600 bp 和350~400 bp 各有1 条母本特异条带,且子代2(2F1)在150 bp 处和150~200 bp既有1 条母本特异条带,同时有1 条父本特异条带。除此之外,子代1(1F1)在350~500 bp 还有4 条父本特异条带,由此,进一步确定2 个F1代杂交种均为红提×红玫瑰的真杂种。

图2 引物Me1/Em10(A)、Me9/Em3(B)和Me8/Em13(C)的SRAP-PCR 电泳结果
2.4 红提×贝达的F1 代杂交种鉴定
从筛选出的10 对SRAP-PCR 引物中,随机选取3 对(Me3/Em10、Me13/Em5、Me14/Em3)进行红提×贝达的3 个F1代杂交种的鉴定。从引物Me3/Em10扩增的电泳图(图3A)可知,在500 bp 处,3 个F1子代均有1 条父本的特异条带,且在700~800 bp、400~450 bp、300~350 bp 均有1 条母本的特异条带;另外,在1 500 bp 处,子代2(2F1)有2 条母本特异条带;在450 bp 处,子代1(1F1)有1 条母本特异条带;在1 500 bp 以上、300~350 bp 位点处,子代1(1F1)各有1 条父本特异条带,在150~200 bp,子代2(2F1)和子代3(3F1)均有1 条父本的特异条带。引物Me13/Em5 扩增电泳结果显示(图3B),3 个子代在300~350 bp 均有父本的特异条带,且在400 bp 处均有母本的特异条带。所以,用引物Me13/Em5 很容易鉴定出3 个子代均为真杂种。用引物Me14/Em3 进行SRAP-PCR 反应,电泳结果显示(图3C),3 个子代在200 bp 处均有父本的特异条带,且子代1(1F1)和子代2(2F1)在1 500 bp 以上有1 条父本的特异条带,子代1(1F1)和子代3(3F1)在600~700 bp 有1 条父本的特异条带;子代1(1F1)和子代2(2F1)在接近700 bp 处均有1 条自己的特异带型,所以,3 个子代均为红提×贝达的真杂种。
2.5 红提×贵妃的F1 代杂交种鉴定
从筛选出的4 对引物中,用其中3 对引物Me1/Em10、Me2/Em11 和Me5/Em6 对红提(♀)、贵妃(♂)及其3 个F1代杂交种进行SRAP-PCR 分析。在引物Me1/Em10 的扩增电泳结果中(图4A),子代2(2F1)和子代3(3F1)在700~900 bp 均有3 条父本特异条带,子代1(1F1)在700~800 bp 有1 条父本特异条带,子代1(1F1)和子代3(3F1)在1 000 bp 以上均有1 条父本特异条带,说明3 个子代均有父本基因渗入。子代1(1F1)和子代3(3F1)在600 bp 处均有1 条母本特异条带,子代2(2F1)在1 000 ~1 500 bp有1 条母本特异条带,说明3 个子代均有母本特异条带。除此之外,3 个子代分别在400~500 bp、500~600 bp、500 bp 处均有各自的特异条带。子代既有父本特异型条带又有母本特异型条带,并且还有自己的特异条带,所以,3 个子代无疑为红提×贵妃葡萄的杂交种。在引物Me2/Em11 的扩增电泳结果中(图4B),3 个子代在350 bp 处和250~300 bp 均有父本的特异条带,子代3(3F1)在700 bp 处有自己的特异条带。由于鉴定子代以扩增出父本的特异条带为依据,所以,引物Me2/Em11 可以确定3 个子代均为真杂种。引物Me5/Em6 的扩增电泳结果显示(图4C),3 个子代在400~450 bp 和1 000~1 500 bp 均各有1条清晰可见的父本的特异条带,且在700 bp 处均有1 条母本特异条带;子代2(2F1)在1 000~1 500 bp 有1 条父本特异条带,在接近1 500 bp 处还有1 条母本特异条带。所以,引物Me5/Em6 也较容易将红提、贵妃及其二者的杂交后代区别开来。

图3 引物Me3/Em10(A)、Me13/Em5(B)和Me14/Em3(C)的SRAP-PCR 电泳结果
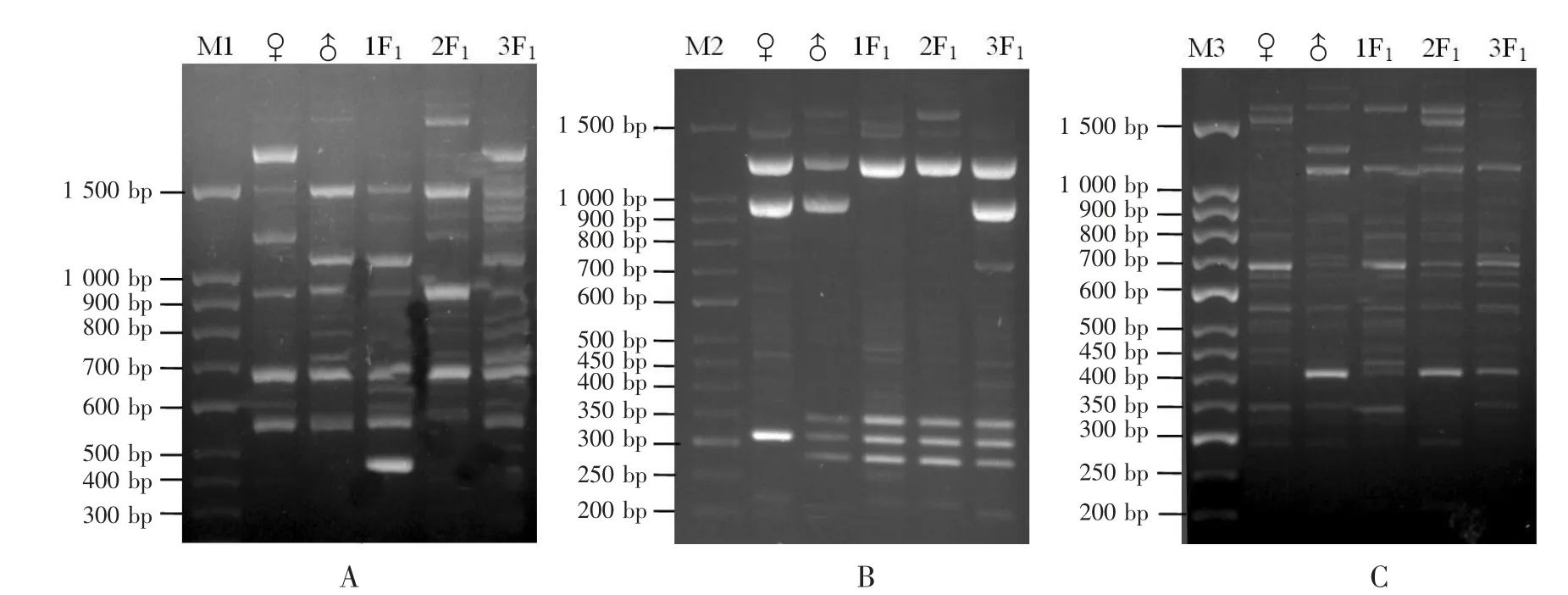
图4 引物Me1/Em10(A)、Me2/Em11(B)和Me5/Em6(C)的SRAP-PCR 电泳结果
3 讨论与结论
葡萄杂交育种是种质创制的重要途径。由于葡萄育种周期长、且自花授粉习性容易导致假杂种产生,因此,对杂交种进行早期鉴定、早期选择是提高育种效率、节约育种成本、加速育种进程的重要环节。分子标记辅助选择则是快速、有效进行杂交种早期鉴定与选择的手段。
SRAP 分子标记技术是由LI 等[14]开发,称为序列相关扩增多态性。它是以双引物扩增为基础,旨在对基因组中的开放阅读框架(ORF)进行扩增,因此能够体现物种间基因的多态性,更能体现出个体间真实的亲缘关系。本研究的3 对杂交组合中,红提和贝达分别属于欧亚种和美洲种,二者的亲缘关系较远,故196 对SRAP-PCR 引物中,可用于鉴别双亲和子代的SRAP 引物相对较多,为10 对;而红提和红玫瑰、红提和贵妃均属于欧亚种,亲缘关系相对较近,故196 对引物中,可用于鉴别双亲及其后代的引物相对较少,红提和红玫瑰组合为4 对,红提和贵妃组合也为4 对,这8 对引物同时可鉴定红提和贝达及其二者的杂交后代。
本研究利用SRAP 技术,对红提×红玫瑰的2 个F1代实生苗、红提×贝达的3 个F1代实生苗和红提×贵妃的3 个F1代实生苗进行了真杂种的早期鉴定。我们的判定标准主要是依据父本特异条带的产生,即父本遗传信息的渗入。在此基础上,结合有母本特异条带的扩增或者F1代实生苗中出现新的特异条带(新带型可能是不同等位基因上同源序列的遗传重组)。在LI 等[14]的研究结果中,20%的SRAP 标记为共显性标记。因此,本研究中有些杂交种只有父本的特异带型,而没有出现父母本标记位点信息的叠加。通过反复试验,筛选出能够鉴定不同亲本组合的F1代杂交后代的特异引物,表明采用SRAP 技术快速鉴定葡萄真伪杂交种是可行的,这些相应的引物可以继续用来分别进行3 对亲本组合的其他F1代杂交植株的鉴定。

