L-半胱氨酸处理对青脆李果实常温贮藏品质的影响
令 阳,邓丽莉,2,姚世响,2,曾凯芳,2,*
(1.西南大学食品科学学院,重庆 400715;2.西南大学食品贮藏与物流研究中心,重庆 400715)
青脆李(Prunus salicinaLindell cv. Qingcui)是我国西南地区特色水果之一。因果实风味独特、营养丰富、绿色清爽、方便易食等特点,深受消费者的喜爱[1]。青脆李成熟于高温高湿的夏季,且是一种典型的呼吸跃变型果实,在采后常温贮藏过程极易后熟软化,并易受病原菌的侵染而腐烂,造成巨大的经济损失[2]。目前,李果实的贮藏保鲜技术包括物理防治(如冷库贮藏、气调贮藏、减压贮藏)和化学防治(防腐剂、杀菌剂等[3])。虽然这些贮藏手段可以有效抑制李果实采后病害的发生和提高果实的贮藏品质,但物理防治所需的保鲜设备当前难以大规模推广,化学杀菌剂处理虽便于使用,但会造成果实农残量超标,导致生态环境污染、人类健康受损。因此,需要寻求一些新型、安全的保鲜方法。近年来,氨基酸因安全、易得、高效等特点在农业上具有广阔的应用空间,一些研究已经证明L-蛋氨酸、L-精氨酸、L-谷氨酸等外源氨基酸处理可以调节果蔬的生长发育、改善果蔬品质、提高果蔬的抗逆能力[4-6]。
L-半胱氨酸作为一种重要的含硫氨基酸,在植物初级和次级代谢中都占据重要地位[7-11]。目前已通过美国食品药品监督管理局的安全认证[12]。因其良好的抑菌和抗氧化性能,L-半胱氨酸多被用作鲜切果蔬的保鲜剂[13-14]。有研究已证明,外源L-半胱氨酸处理可增强黄瓜种子抵抗非生物胁迫能力,延缓采后荔枝果实品质的下降[12,15]。但关于L-半胱氨酸处理在核果类果实贮藏品质方面的研究还较少。因此,本实验拟通过外源L-半胱氨酸浸泡处理青脆李果实,探讨其在保持‘青脆李’果实贮藏品质和延缓果实衰老方面的作用,进而为核果类果实的安全贮藏提供一定的理论参考。
1 材料与方法
1.1 材料与试剂
供试材料‘青脆李’(Prunus salicinaLindell cv.Qingcui)采摘于重庆市北碚区缙云山果园,采摘后当天运回实验室。挑选无病害、无机械伤且大小均匀、成熟度一致的果实。摊平去除田间热后,于室温条件下贮藏待用。
L-半胱氨酸(纯度>99%) 中国Adamas-Bata公司。
1.2 仪器与设备
SL602N高精显电子天平 上海民桥精密仪器有限公司;UltraScan PRO色差仪 美国Hunter Lab公司;YP6102色差仪 上海光正医疗仪器有限公司;DDS-307A电导率仪 上海仪电科学仪器股份有限公司;HZQ-F100全温振荡培养箱 苏州培英实验设备有限公司;WH-2微型漩涡混合仪 上海沪西分析仪器有限公司;AvantiTMJ-30I高速冷冻离心机 美国Beckman公司;GS-25 FTA质地分析仪 北京阳光亿事达科技有限公司;L-8800型氨基酸自动分析仪 日本日立公司。
1.3 方法
1.3.1 原料处理
参考Wang Lei等[16]的方法,略有修改。果实用体积分数2%次氯酸钠浸泡消毒1 min后用自来水冲洗,在常温(20 ℃)条件下自然晾干。实验共有4 个处理组,即青脆李果实分别用自来水(对照),100、500、1 000 mg/LL-半胱氨酸浸泡10 min。待完全晾干后,所有果实单果包装,于20 ℃、相对湿度80%~90%环境下贮藏15 d。每3 d统计这5 组果实的自然发病率和病情指数,并测定12 d内对照和L-半胱氨酸处理组的其他指标。
1.3.2 果实发病率、病情指数的测定
果实发病率按公式(1)计算。

果实病情指数的分级统计参考张紫微等[17]的方法,按病斑面积的大小将病害程度分为5 级:无病斑为0级;病斑面积小于25%为1级;病斑面积在25%~50%之间为2级;病斑面积在50%~75%之间为3级;病斑面积大于75%为4级。每组20 个果实,重复3 次。病情指数按公式(2)计算。
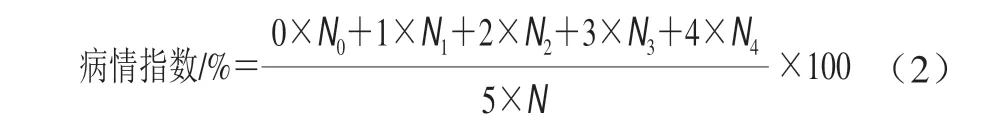
式中:N表示每组果实个数;Nn表示病害级别(n)所对应的果实数。
1.3.3 色泽的测定
采用UltraScan®PRO色差仪测量果实赤道部位的L*、a*和b*值[18]。每个果实测定赤道表面等距的3 个点,每组15 个果实,实验重复3 次。
1.3.4 硬度的测定
通过FTA质地分析仪测定青脆李果实赤道部位的硬度,探头直径为7.7 mm,下压距离为4 mm,在赤道部位等距离测定3 个点,每组6 个果实,实验重复3 次。
1.3.5 质量损失率的测定
质量损失率的测定采用称质量法[19],每组15 个果实,其计算见公式(3)。

1.3.6 可溶性固形物质量分数的测定
可溶性固形物质量分数的测定参照曹建康等[20]的方法,略有修改。取6~10 个果实,去核后用挤压器挤压出果汁。然后用塑料滴管吸出汁液,并使用数显手持式折光仪器测定每个样品中可溶性固形物质量分数。
1.3.7 可滴定酸质量浓度的测定
可滴定酸质量浓度的测定参考曹建康等[20]的方法,略有修改。取6~10 个果实,去核后用挤压器挤压出果汁。吸取1.0 mL果汁转移到10 mL容量瓶中,用蒸馏水定容至刻度线,充分摇匀后。吸取8.0 mL溶液加到25 mL的三角瓶中,并加入2 滴1%酚酞指示剂,用标定好的0.01 mol/L NaOH溶液滴定。在滴定结束时,溶液呈粉红色并在30 s内不褪色,即为滴定终点。用蒸馏水代替果汁按同样步骤滴定,作为空白对照。可滴定酸质量浓度按式(4)计算。

式中:V表示样品定容后的体积/mL;c表示NaOH标定液浓度/(mol/L);V1表示消耗NaOH溶液的体积/mL;V0表示滴定蒸馏水消耗的NaOH体积/mL;Vm表示样品定容前体积/mL;f表示折算系数,果实的可滴定酸以苹果酸计,f=0.067 g/mmol;VS表示滴定时所取样液体积/mL。
1.3.8 抗坏血酸含量的测定
抗坏血酸含量的测定参照Mditshwa等[21]的方法,略有修改。称取约1.0 g青脆李果实冷冻组织,加入少量体积分数2%经4 ℃预冷后的草酸溶液,在冰浴条件下快速研磨成浆,将匀浆转入到25 mL容量瓶中,用体积分数2%草酸溶液冲洗研钵并定容至刻度线。充分摇匀提取10 min后,过滤。吸取10 mL滤液到25 mL烧瓶中,用2,6-二氯靛酚溶液滴定,直到溶液呈微红色并在15 s内不褪色,即为滴定终点。用5 mL体积分数2%草酸溶液代替果汁按同样步骤滴定,作为空白对照。结果以鲜质量计,抗坏血酸含量按公式(5)进行计算。
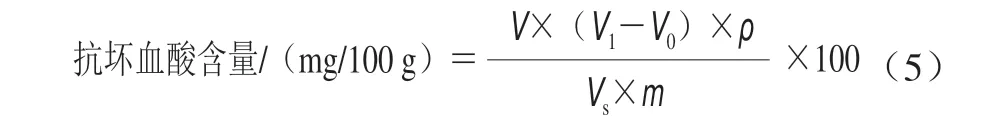
式中:V表示定容后的体积/mL;V1、V0分别表示样液、空白滴定消耗的染料体积/mL;ρ表示1 mL染料溶液相当于抗坏血酸的质量浓度/(mg/mL);VS表示滴定时吸取样品溶液的体积/mL;m表示样品的质量/g。
1.3.9 相对电导率的测定
相对电导率的测定参考曹建康等[20]的方法,略有修改。用小刀在果实赤道周围取厚度均匀的果皮组织,准确称取2.0 g放到盛有20 mL去离子水的烧杯中,振荡清洗3 遍,每次清洗10 min。然后用滤纸吸干组织表面的水分,再把果皮组织放入盛有20 mL去离子水的试管中于振荡器上振荡1 h。恒温条件下,用电导率仪测定溶液电导率(L1/(μS/cm))。再将试管煮沸10 min,冷却至室温后测定煮沸后溶液的电导率(L0/(μS/cm))。每组取15 个青脆李果实的果皮组织,相对电导率按式(6)计算。
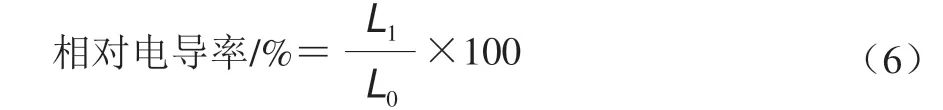
1.3.10 丙二醛含量的测定
丙二醛含量测定参考Li Shunmin等[19]的方法并略有修改。称取约1.0 g果皮冷冻组织,分两次加入5 mL质量浓度为10 g/100 mL且经4 ℃预冷后的三氯乙酸(trichloroacetic acid,TCA)溶液,并将混合物在冰浴的研钵中快速研磨成浆,4 ℃、12 000×g离心30 min,取2 mL上清液,加入2 mL质量浓度为0.67 g/100 mL硫代巴比妥酸溶液,混匀后在沸水浴中加热煮沸20 min。取出后快速冷却并再次在4 ℃、12 000×g的条件下离心20 min,获得的上清液分别在450、532 nm和600 nm波长处测定吸光度。以2 mL 10 g/100 mL TCA溶液作为空白进行参比调零,并按照式(7)计算丙二醛含量。

1.3.11 游离氨基酸含量的测定
游离氨基酸含量的测定参考Ábrahám等[22]的方法并略有修改。取约1.5 g青脆李果实冷冻组织,加入1.5 mL 6 g/100 mL预冷的磺基水杨酸溶液,充分研磨至匀浆状态,12 000×g条件下离心10 min,之后通过0.22 μm滤膜过滤。使用L-8800型氨基酸自动分析仪测定样品中游离氨基酸的含量,单位为μg/g,结果以鲜质量计。
1.4 数据处理与分析
所有实验重复3 次,结果取平均值,采用Excel 2016软件统计分析数据,应用SPSS 22.0软件对数据进行方差分析,利用Duncan’s多重比较进行显著性分析,P<0.05表示差异显著,P<0.01表示差异极显著。运用GraphPad Prism 7、Adobe Photoshop CS6软件绘制图表。
2 结果与分析
2.1 L-半胱氨酸浸泡处理对青脆李果实自然发病率和病情指数的影响
如图1所示,100、500、1 000 mg/LL-半胱氨酸处理可有效控制青脆李果实贮藏期间的自然发病率及病情指数。在贮藏前9 d,L-半胱氨酸处理可很好地抑制青脆李果实的自然发病率和病情指数。但贮藏12 d后,100、500、1 000 mg/LL-半胱氨酸处理组的发病率和病情指数逐渐接近对照组,其中100 mg/LL-半胱氨酸处理组发病率增长最快,其次是500 mg/L处理组,1 000 mg/LL-半胱氨酸处理组的发病率增长速度较慢。
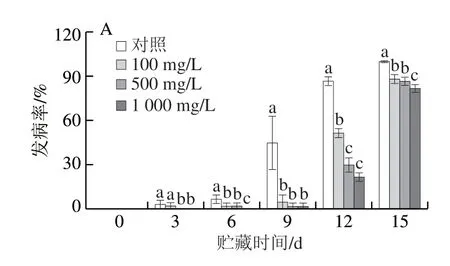
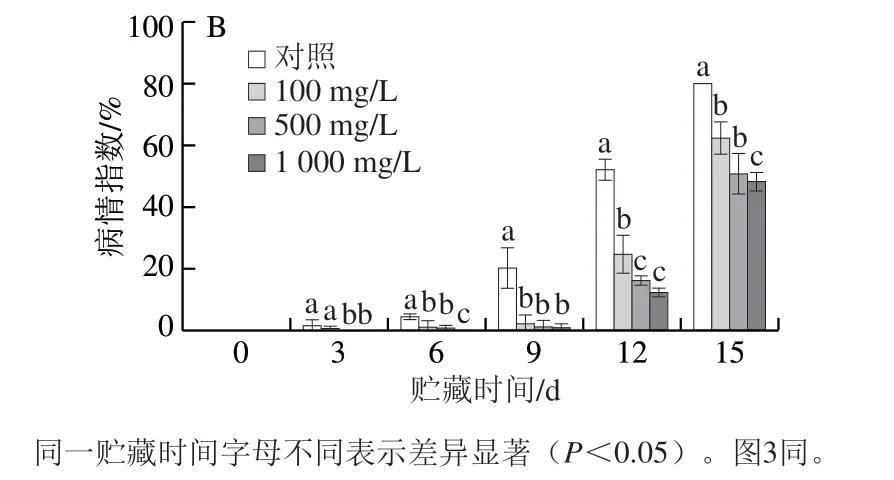
图 1 L-半胱氨酸浸泡处理对采后青脆李果实自然发病率(A)和病情指数(B)的影响Fig. 1 Effect of of L-cysteine treatment on natural infection incidence (A)and disease index (B) of ‘Qingcui’ plum fruits
2.2 L-半胱氨酸浸泡处理对青脆李果实色泽的影响
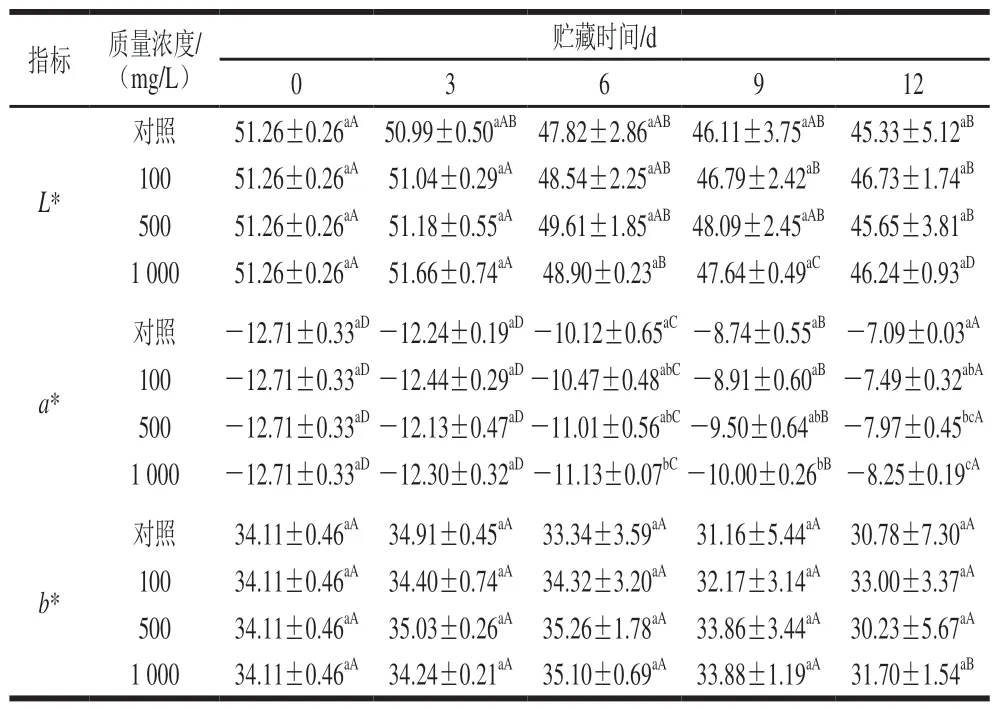
表 1 L-半胱氨酸浸泡处理对采后青脆李果实L*、a*、b*值的影响Table 1 Effect of L-cysteine treatment on L*, a* and b* values of‘Qingcui’ plum fruit
如表1所示,L-半胱氨酸处理组及对照组青脆李果实的L*值随着贮藏时间的延长而降低,且处理组与对照组间无显著差异(P>0.05)。处理组及对照组果实的a*值随着贮藏时间的延长逐渐升高,但在6、9 d与对照组无显著差异。500、1 000 mg/LL-半胱氨酸浸泡处理可以延缓果实a*值的上升速度,并在贮藏第6、9、12天与对照组差异显著(P<0.05)。在整个贮藏期间b*值基本稳定。
2.3 L-半胱氨酸浸泡处理对青脆李果实硬度的影响
如图2所示,青脆李果实的硬度随着贮藏时间的延长而不断下降。其中,100 mg/LL-半胱氨酸处理组果实硬度在贮藏的前3 d骤减,并在整个贮藏期内与对照组果实无显著性差异(P>0.05),500 mg/L和1 000 mg/LL-半胱氨酸处理组果实硬度在贮藏3~6 d迅速下降,且与对照组存在极显著差异(P<0.01)。常温贮藏9 d后,500 mg/LL-半胱氨酸处理组果实硬度下降到与对照组果实硬度相当的水平,但1 000 mg/LL-半胱氨酸处理组果实硬度与对照组相比仍存在极显著差异(P<0.01)。
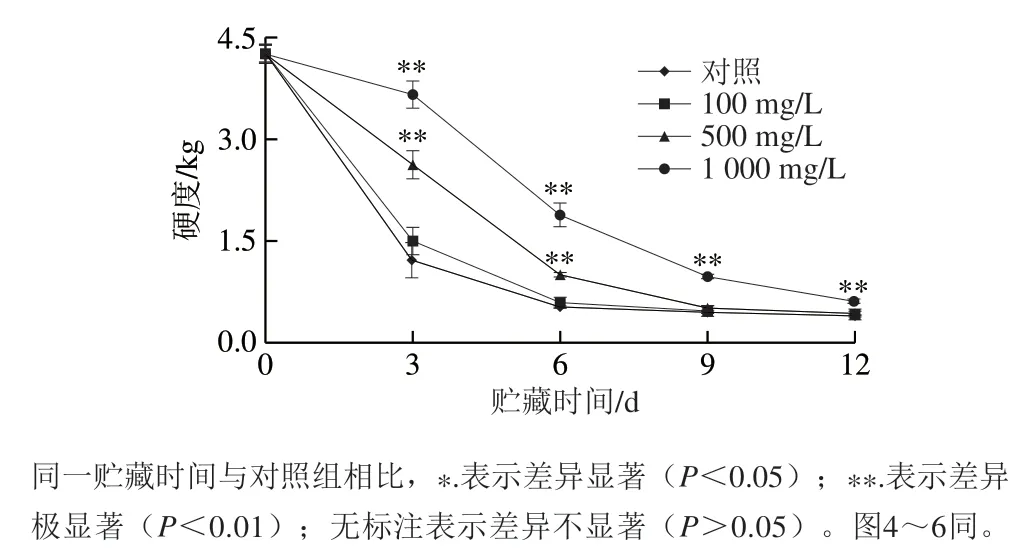
图 2 L-半胱氨酸浸泡处理对采后青脆李果实硬度的影响Fig. 2 Effect of L-cysteine treatment on firmness of ‘Qingcui’ plum fruit
2.4 L-半胱氨酸浸泡处理对青脆李果实质量损失率的影响

图 3 L-半胱氨酸浸泡处理对采后青脆李果实质量损失率的影响Fig. 3 Effect of L-cysteine treatment on mass loss rate of ‘Qingcui’ plum fruit
如图3所示,青脆李果实的质量损失率随着贮藏时间的延长而不断升高。在贮藏第3天,L-半胱氨酸处理组与对照组果实无显著差异(P>0.05)。第6天开始,1 000 mg/LL-半胱氨酸处理组的质量损失率与对照组之间开始存在显著差异(P<0.05);500 mg/LL-半胱氨酸浸泡处理在贮藏第12天对果实质量损失有微弱的抑制作用;100 mg/LL-半胱氨酸浸泡处理在整个贮藏过程中对果实的质量损失率几乎没有影响。
2.5 L-半胱氨酸浸泡处理对青脆李果实可溶性固形物质量分数和可滴定酸质量浓度的影响
如图4A所示,青脆李果实可溶性固形物质量分数随着贮藏时间的延长整体呈先上升后降低的趋势。在贮藏第6天,对照组和100 mg/LL-半胱氨酸处理组果实可溶性固形物质量分数都达到峰值。在贮藏第9天,500、1 000 mg/LL-半胱氨酸处理组果实可溶性固形物质量分数均达到最大值并极显著高于对照组果实(P<0.01)。虽然在贮藏9~12 d,青脆李果实可溶性固形物质量分数整体呈下降趋势,但在贮藏的第12天,500 mg/L和1 000 mg/LL-半胱氨酸处理组果实可溶性固形物质量分数仍极显著高于对照组果实(P<0.01),均为对照组果实的1.05 倍。
如图4B所示,青脆李果实的可滴定酸质量浓度随着贮藏时间的延长而逐渐降低。根据方差分析可知,1 000 mg/LL-半胱氨酸处理组果实可滴定酸质量浓度在贮藏第3、9天显著高于对照组,且在贮藏第12天与对照组果实存在极显著差异(P<0.01)。500 mg/LL-半胱氨酸处理组果实可滴定酸质量浓度在贮藏第12天与对照组果实存在显著差异(P<0.05),是对照组果实可滴定酸质量浓度的1.10 倍。100 mg/LL-半胱氨酸处理组果实的可滴定酸质量浓度在整个贮藏期内与对照组均没有显著差异(P>0.05)。
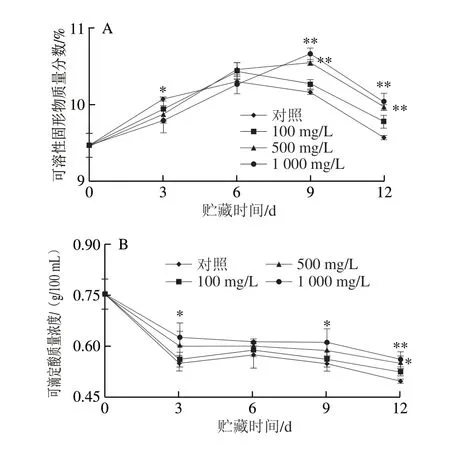
图 4 L-半胱氨酸浸泡处理对采后青脆李果实可溶性固形物质量分数(A)和可滴定酸质量浓度(B)的影响Fig. 4 Effect of L-cysteine treatment on total soluble solid content (A)and titratable acid content (B) of ‘Qingcui’ plum fruit
2.6 L-半胱氨酸浸泡处理对青脆李果实抗坏血酸含量的影响

图 5 L-半胱氨酸浸泡处理对采后青脆李果实抗坏血酸含量的影响Fig. 5 Effect of L-cysteine treatment on ascorbic acid content of‘Qingcui’ plum fruit
如图5所示,青脆李果实抗坏血酸含量随着贮藏时间的延长整体呈下降趋势。在贮藏第3天,1 000 mg/LL-半胱氨酸处理组果实抗坏血酸为3.43 mg/100 g,极显著高于对照组果实(P<0.01)。在贮藏第6、9天,1 000 mg/LL-半胱氨酸处理组果实抗坏血酸含量显著高于对照组果实(P<0.05),分别是对照组果实的1.15、1.32 倍。在贮藏第12天,1 000 mg/LL-半胱氨酸处理组果实抗坏血酸含量与对照组无显著差异(P>0.05)。100、500 mg/LL-半胱氨酸处理组抗坏血酸含量在整个贮藏期内均与对照组无显著性差异(P>0.05)。
2.7 L-半胱氨酸浸泡处理对青脆李果实相对电导率和丙二醛含量的影响
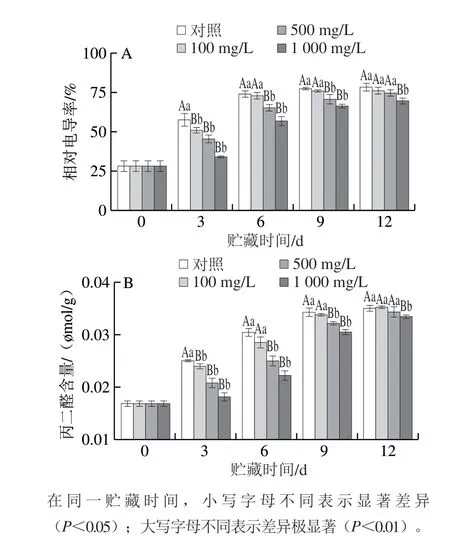
图 6 L-半胱氨酸浸泡处理浸泡对采后青脆李果实电导率(A)和丙二醛含量(B)的影响Fig. 6 Effect of L-cysteine treatment on relative electrolyte leakage (A)and MDA content (B) of ‘Qingcui’ plum fruit
如图6A所示,青脆李果实相对电导率随着贮藏时间的延长逐渐增加。在贮藏第3天,对照组果实相对电导率极显著高于100、500、1 000 mg/LL-半胱氨酸处理组果实(P<0.01)。在贮藏第6、9天,对照组和100 mg/LL-半胱氨酸处理组果实相对电导率无显著性差异(P>0.05),但与500、1 000 mg/LL-半胱氨酸处理组仍存在极显著差异(P<0.01)。在贮藏第12天,500 mg/LL-半胱氨酸处理组相对电导率已与对照组果实无显著差异,但1 000 mg/LL-半胱氨酸处理组仍与对照组果实存在显著差异(P<0.05)。如图6B所示,青脆李果实丙二醛含量随着贮藏时间的延长呈现逐渐上升的趋势。与相对电导率结果相似,L-半胱氨酸处理可以不同程度地降低果实中MDA含量上升。其中,500 mg/L和1 000 mg/LL-半胱氨酸处理的效果最为明显。
2.8 L-半胱氨酸浸泡处理对青脆李果实游离氨基酸含量的影响
如表2所示,1 000 mg/LL-半胱氨酸浸泡处理组与对照组果实中均检测出16 种游离氨基酸。其中,1 000 mg/LL-半胱氨酸浸泡处理显著提高了贮藏期间青脆李果实中游离半胱氨酸的含量。在贮藏第3、6、9、12天,1 000 mg/LL-半胱氨酸处理组果实中游离半胱氨酸含量分别是对照组的1.99、1.29、1.55、2.48 倍。贮藏第3、9、12天,1 000 mg/LL-半胱氨酸处理组果实中谷氨酸、天冬氨酸和脯氨酸含量均显著高于对照组果实(P<0.05)。在贮藏第12天,L-半胱氨酸处理组中谷氨酸、天冬氨酸、脯氨酸含量分别是对照组果实的1.16、1.23、1.14 倍。但1 000 mg/LL-半胱氨酸处理组果实中的其他11 种游离氨基酸(甘氨酸、丙氨酸、丝氨酸、缬氨酸、亮氨酸、异亮氨酸、组氨酸、蛋氨酸、精氨酸、苯丙氨酸、酪氨酸)在整个贮藏期内基本显著低于对照组果实(P<0.05)。
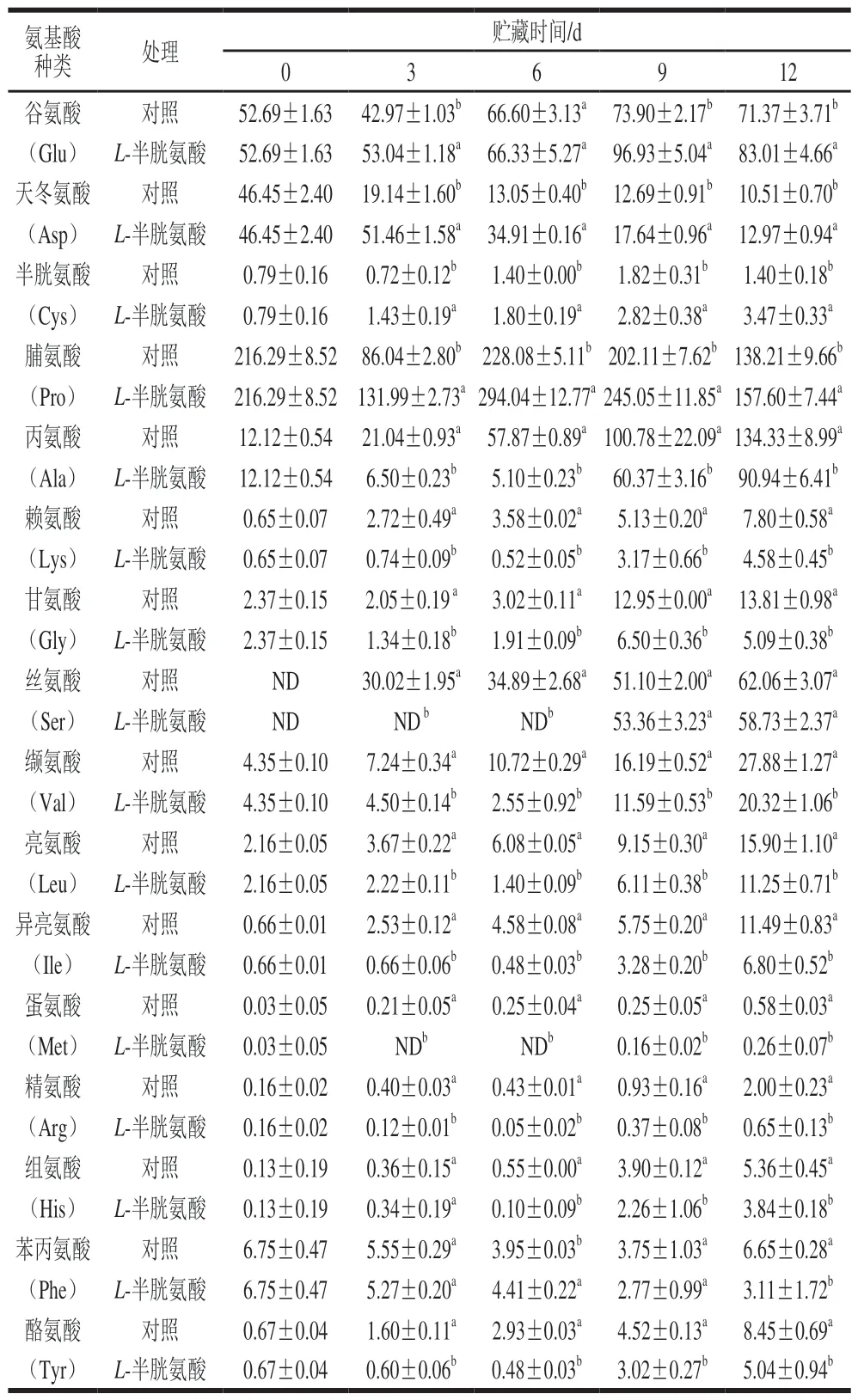
表 2 L-半胱氨酸浸泡处理对采后青脆李果实游离氨基酸含量的影响Table 2 Effect of L-cysteine treatment on free amino acids content in‘Qingcui’ plum fruit
3 讨 论
作为典型的呼吸跃变型果实,青脆李在贮藏期间会发生一系列不可逆的后熟反应,例如果实软化、颜色退化、可滴定酸含量降低等现象,这会造成采后果实贮藏品质下降,从而降低青脆李果实的市场竞争力。因此,果实品质的变化是评价处理方法是否合理有效的一个重要指标[23]。
腐烂率和质量损失率是评价果实贮藏效果的两个重要指标。在本实验中,不同质量浓度L-半胱氨酸浸泡处理均可在一定程度控制采后青脆李果实贮藏期间的自然发病率和病情指数。此外,500、1 000 mg/LL-半胱氨酸处理还可延缓采后果实质量损失率的上升。
果实的颜色、硬度、可溶性固形物质量分数、可滴定酸质量浓度、抗坏血酸含量等是反映果实外在和内在品质的重要指标。其中,硬度也是反映果实成熟和衰老的直观指标之一[24-25]。本实验结果表明,500 mg/L和1 000 mg/LL-半胱氨酸处理可有效延缓采后青脆李果实的软化进程。这与使用1-甲基环丙烯(1-methylcyclopropene,1-MCP)外源处理可一定程度抑制李果实软化的结果[24]相似。同时,500 mg/L和1 000 mg/LL-半胱氨酸处理还可延缓青脆李果实贮藏过程中可溶性固形物质量分数、可滴定酸质量浓度和抗坏血酸含量的下降。Ali等[12]也发现L-半胱氨酸外源处理可使采后荔枝果实保持较高的可溶性固形物、可滴定酸以及抗坏血酸含量。此外,1 000 mg/LL-半胱氨酸可延缓a*值的升高,说明可一定程度上抑制常温贮藏过程中青脆李果实的转黄。
丙二醛是膜脂过氧化作用的主要产物,其含量可以间接反映果实的衰老状况。此外,果实贮藏期间细胞外液的电导率可以反映细胞膜的受损程度,从而可据其判断果实的贮藏品质[26-27]。在本实验中,500 mg/L和1 000 mg/LL-半胱氨酸处理均可在一定程度抑制采后青脆李果实贮藏期间相对电导率和丙二醛含量的上升。
本实验选取3 个处理组中效果最好的1 000 mg/LL-半胱氨酸处理组果实,进行了游离氨基酸含量的测定。结果发现,在所测得的16 种游离氨基酸中,仅有4 种氨基酸(半胱氨酸、脯氨酸、谷氨酸、天冬氨酸)在1 000 mg/LL-半胱氨酸组果实中的含量高于对照组果实。李岩[27]在1-MCP处理薄皮甜瓜果实中也发现了相似的结果,即1-MCP处理组薄皮甜瓜果实中的氨基酸含量明显低于对照组果实,但乙烯处理可以增加薄皮甜瓜果实中氨基酸含量。可能原因是由于果实中部分氨基酸的含量变化受乙烯调控,外源保鲜剂处理可降低果实中乙烯含量从而间接影响果实中氨基酸的合成。虽然1 000 mg/LL-半胱氨酸处理组中仅有4 种氨基酸含量高于对照组,但谷氨酸和天冬氨酸作为两种主要的鲜味氨基酸,其清鲜的味道在果实风味中发挥重要作用[28-29]。而且1 000 mg/LL-半胱氨酸处理可以增加青脆李果实中含量最高且甜味较强的脯氨酸含量[30]。同时,这4 种氨基酸在果实抗逆反应中也发挥着重要作用[31-33]。
综上,不同质量浓度的L-半胱氨酸浸泡处理可以降低常温(20 ℃)贮藏期间青脆李果实的自然发病率和病情指数。且500、1 000 mg/LL-半胱氨酸浸泡处理可保持李果实的贮藏品质,其中,1 000 mg/LL-半胱氨酸浸泡处理的效果更好。因此认为,适宜质量浓度的L-半胱氨酸在保持青脆李果实采后品质方面具有极大的开发应用价值。

