6种医院制剂微生物限度检查方法适用性试验研究
陈 静,严 佳,钟桂香,宋洪涛
(中国人民解放军联勤保障部队第九〇〇医院,福建 福州350025)
微生物限度检查是保证药品安全性的重要环节,采用通过方法适用性试验的检查方法是获得可靠结果的基本保证[1]。复方氯霉素搽剂、复方苯甲酸搽剂、水杨酸搽剂、复方呋喃西林滴鼻液、苯酚甘油滴耳液和硼酸滴耳液均是医院制剂中常见的外用给药制剂,6种制剂均有不同程度的抑菌性[3]。中国药典2015年版规定,应先消除供试品的抑菌活性,再依法进行检查。为了避免消除抑菌成分的方法损伤药品中污染的微生物,中国药典规定在微生物计数法中,应首先在供试液环节加入试验菌株,如果供试品抑菌作用仍无法消除,再考虑经处理后加入菌悬液进行试验[2]。因此本文依据《中华人民共和国药典》2015年版四部通则1105、1106、1107具体规则作为检测依据,对加菌顺序、冲洗量体积和供试液稀释级别进行摸索,对6个品种的微生物限度检查方法进行适用性试验研究,消除制剂的抑菌性,建立准确可靠的微生物限度检查方法,以用于日常药品质量控制检验工作[2]。
1 仪器与试剂
1.1 仪器
AE240精密电子天平(瑞士METTLER公司);HWS24型电热恒温水浴锅、DHG-9145A电热恒温鼓风干燥箱、GHP-9160隔水式恒温培养箱(上海一恒科技有限公司); YP3001ND电子天平(上海精科有限公司);MJPS-150型霉菌培养箱(上海精宏实验设备有限公司); WJ-6无菌检查仪(天津市罗根科技有限公司);SW-CJ-1B净化工作台(苏州太仓净化设备厂);LDZX-40KBS立式压力蒸汽灭菌器(上海申安医疗器械厂)。
1.2 试药
复方氯霉素搽剂(批号:180528、180727、181114)、复方苯甲酸搽剂(批号:180314、180615、180925)、水杨酸搽剂(批号:180524、180706、180821)、复方呋喃西林滴鼻液(批号:180320、180718、180905)、苯酚甘油滴耳液(批号:180509、180711、181105)和硼酸滴耳液(批号:180622、180726、181213),均由联勤保障部队900医院制备。
1.3 培养基、稀释液和冲洗液
培养基:胰酪大豆胨液体培养基(批号:1612071)、胰酪大豆胨琼脂培养基(批号:1610252)、沙氏葡萄糖琼脂培养基(批号:1609214)、沙氏葡萄糖液体培养基(批号:1611162)、甘露醇氯化钠琼脂培养基(批号:1703202)、溴化十六烷基三甲胺琼脂培养基(批号:160309)、麦康凯液体培养基(批号:170320)、麦康凯琼脂培养基(批号:160826);稀释液及冲洗液:pH 7.0无菌氯化钠-蛋白胨缓冲液(批号:1709062)。均购自北京三药科技开发公司。
1.4 菌株
金黄色葡萄球菌(Staphylococcusaureus)、枯草芽孢杆菌(Bacillussubtilis)、铜绿假单胞菌(Pseudomonasaeruginosa)、白色念珠菌(Candidaalbicans)、黑曲霉(Aspergillusniger),大肠埃希菌(Escherichiacoli)以上菌株均为第3代,均购自福建省药检所。
1.5 微生物限度标准
复方氯霉素搽剂、复方苯甲酸搽剂和水杨酸搽剂为皮肤给药制剂;酚甘油滴耳液和硼酸滴耳液为耳用制剂;复方呋喃西林滴鼻液为鼻用制剂。皮肤给药制剂和耳用制剂的微生物限度标准如下:需氧菌总数不超过100 cfu/ml(1 ml或1 g 可接受的最大菌数为200),霉菌和酵母菌总数不超过10 cfu/ml(1 ml或1 g可接受的最大菌数为20),不得检出金黄色葡萄球菌、铜绿假单胞菌(1 ml)[2]。鼻用制剂的微生物限度标准如下:需氧菌总数不超过100 cfu/ml(1 ml或1 g 可接受的最大菌数为200),霉菌和酵母菌总数不超过10 cfu/ml(1 ml或1 g可接受的最大菌数为20),不得检出大肠埃希菌、金黄色葡萄球菌、铜绿假单胞菌(1 ml)[2]。
2 方法与结果
2.1 菌液制备
取经(30~35)℃培养18~24 h的金黄色葡萄球菌、枯草芽孢杆菌和铜绿假单胞菌的胰酪大豆胨液体培养物和经(20~25)℃培养24~48 h的白色念珠菌沙氏葡萄糖液体培养物1 ml,加9 ml pH 7.0的氯化钠-蛋白胨缓冲液,10倍递增稀释,制成适宜浓度的菌悬液。
取经(20~25)℃培养7 d的黑曲霉沙氏葡萄糖琼脂斜面培养物,加5 ml含0.05%(ml/ml)聚山梨酯80的pH 7.0的氯化钠-蛋白胨缓冲液,将孢子洗脱,并将孢子过滤至无菌试管内,取孢子液1 ml用含0.05%(ml/ml)聚山梨酯80的pH 7.0氯化钠-蛋白胨缓冲液10倍递增稀释,制成适宜浓度的菌悬液。
2.2 供试液制备
从两支供试品中各取5 ml,共10 ml,加pH 7.0的氯化钠-蛋白胨缓冲液至100 ml,搅拌混匀,作为1:10供试液。从1∶10供试液中取50 ml,加入pH 7.0的氯化钠-蛋白胨缓冲液至100 ml,充分混匀,作为1∶20供试液。
2.3 回收比值的计算
试验组的回收比值=(试验组平均菌落数-供试品对照组平均菌落数)/菌液对照组平均菌落数
2.4 微生物计数方法适用性试验
2.4.1试验组(供试液经过处理后加菌)
(1)需氧菌总数计数:取供试液10 ml(每膜),经薄膜过滤后,用pH7.0无菌氯化钠-蛋白胨缓冲液冲洗,每次冲洗100 ml,冲洗次数不大于10次,在最后一次冲洗液中分别加入铜绿假单胞菌、金黄色葡萄球菌、枯草芽孢杆菌、白色念珠菌、黑曲霉的菌悬液1 ml(含菌不大于100 cfu/ml),混匀,过滤。将滤膜菌面朝上贴于胰酪大豆胨琼脂培养基平板上,35 ℃倒置培养3 d,计数。每株试验菌每种培养基平行制备两张滤膜。
(2)霉菌、酵母菌总数计数:取供试液10 ml(每膜),经薄膜过滤后,用pH 7.0无菌氯化钠-蛋白胨缓冲液冲洗,每次冲洗100 ml,冲洗次数不大于10次,在最后一次冲洗液中分别加入白色念珠菌、黑曲霉的菌悬液1 ml(含菌不大于100 cfu/ml),混匀,过滤。将滤膜菌面朝上贴于沙氏葡萄糖琼脂培养基平板上,25 ℃倒置培养5 d,计数。每株试验菌每种培养基平行制备两张滤膜。
2.4.2试验组(供试液制备时加菌)
(1)需氧菌总数计数:分别取1∶10供试液100 ml于5个灭菌锥形瓶中,分别加入上述稀释至10-6的铜绿假单胞菌、金黄色葡萄球菌、枯草芽孢杆菌、白色念珠菌、黑曲霉的菌悬液1 ml,使其最终浓度为每膜不大于100 cfu菌液,混匀后取10 ml经薄膜过滤,用pH 7.0无菌氯化钠-蛋白胨缓冲液冲洗数次(不大于10次),每次冲洗量为100 ml,转移滤膜菌面朝上贴于胰酪大豆胨琼脂培养基平板上,置35 ℃倒置培养3 d,计数。每株试验菌每种培养基平行制备两张滤膜。
(2)霉菌、酵母菌总数计数:分别取1:10供试液100 ml于2个灭菌锥形瓶中,分别加入上述稀释至10-6的白色念珠菌、黑曲霉的菌悬液1 ml,使其最终浓度为每膜不大于100 cfu菌液,混匀后取10 ml经薄膜过滤,用pH 7.0无菌氯化钠-蛋白胨缓冲液冲洗数次(不大于10次),每次冲洗量为100 ml,转移滤膜菌面朝上贴于沙氏葡萄糖琼脂培养基平板上,置25 ℃倒置培养5 d,计数。每株试验菌每种培养基平行制备两张滤膜。
2.4.3菌液对照组
取稀释液代替供试液,按试验组操作加入试验菌液进行微生物回收试验。
2.4.4供试品对照组
取制备好的供试液,以稀释液代替菌液,其他操作同试验组。
2.4.5验证结果
6种样品分别在供试液制备环节和供试液经过处理后(薄膜过滤法最后一次冲洗液中)加菌,进行回收比值的测定,结果见表1。加菌方式栏中A代表在供试液制备环节加菌可使各试验菌种的回收比值均在0.5~2范围内,B代表在供试液经过处理后加菌可使各试验菌种的回收比值均在0.5~2范围内。除了复方苯甲酸搽剂,其余5种样品运用同一种方法在两种加菌环节进行测定,试验菌种的回收比值均在0.5~2范围内,加菌顺序对结果不会产生影响。复方苯甲酸搽剂经薄膜过滤法处理后,在最后一次冲洗液中加菌,微生物计数方法为1∶10供试液(每膜10 ml),冲洗量每膜700 ml,将加菌顺序前移至供试液制备环节,需增加供试液的稀释倍数,微生物计数方法为1∶20供试液(每膜10 ml),冲洗量每膜300 ml。结果表明,虽然6种样品都有一定的抑菌作用,但是加菌顺序对6种样品的影响不大,最终均选择更为科学合理的加菌方式——供试液制备环节加菌。
在供试液制备环节加菌,6种样品的回收比值结果见表2,复方氯霉素搽剂需氧菌总数、真菌和酵母菌总数的计数方法为1:10供试液(每膜10 ml),冲洗量每膜500 ml;复方苯甲酸搽剂需氧菌总数、真菌和酵母菌总数的计数方法为1∶20供试液(每膜10 ml),冲洗量每膜300 ml;水杨酸搽剂需氧菌总数、真菌和酵母菌总数的计数方法为1∶10供试液(每膜10 ml),冲洗量每膜400 ml;复方呋喃西林滴鼻液1∶10供试液(每膜10 ml),冲洗量每膜600 ml;苯酚甘油滴耳液1∶10供试液(每膜10 ml),冲洗量每膜500 ml和硼酸滴耳液1∶10供试液(每膜10 ml),冲洗量每膜300 ml。5种试验菌种的回收比值均在0.5~2范围内,符合中国药典2015版四部通则1105微生物计数法的要求,方法科学有效。
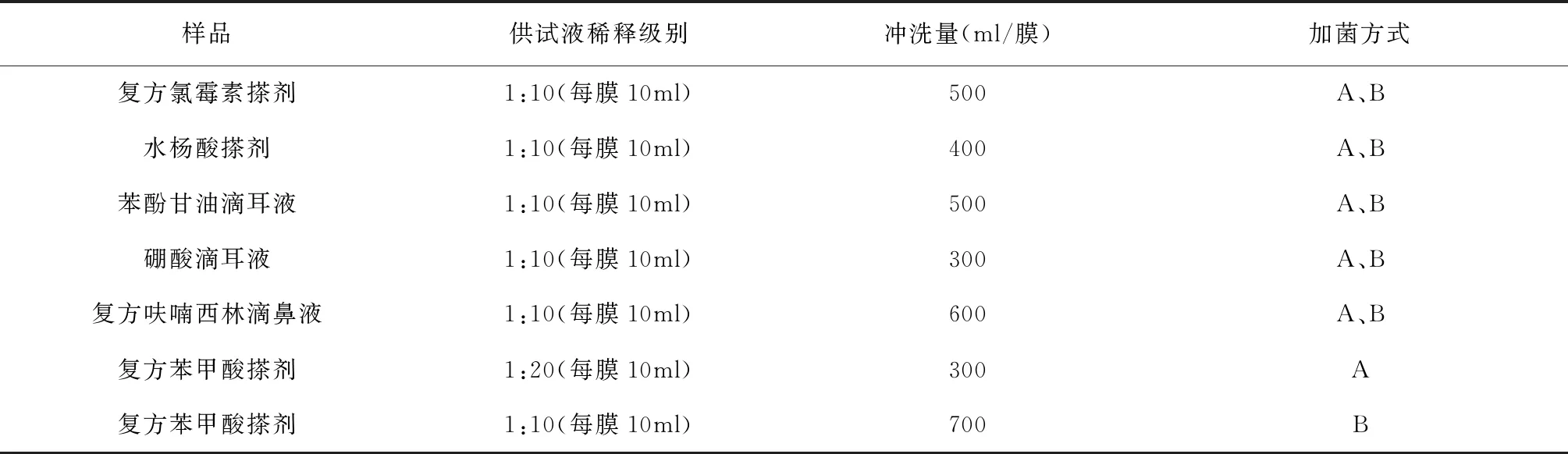
表1 6种样品微生物计数法适用性试验薄膜过滤法条件及加菌方式
注:A.供试液制备环节加菌;B.供试液经过处理后(薄膜过滤法最后一次冲洗液中)加菌

表2 6种样品需氧菌总数、真菌和酵母菌总数回收比值(n=3)
2.5 控制菌检查方法的验证
2.5.1铜绿假单胞菌检查方法的验证
(1)试验组:取1∶10供试液10 ml,经薄膜过滤后,用pH 7.0无菌氯化钠-蛋白胨缓冲液冲洗,每次100 ml,冲洗数次(不大于10次),在最后一次冲洗液中加入铜绿假单胞菌的菌悬液1 ml(含菌≤100 cfu/ml),混匀,过滤。取出滤膜,加至100 ml的胰酪大豆胨液体培养基中,混匀,(30~35)℃培养24 h;取上述培养物划线接种至溴化十六烷基三甲胺琼脂培养基中,(30~35)℃培养72 h。
(2)阴性对照组:取稀释液10 ml代替供试液,不加菌液,其他操作同试验组。
(3)阳性对照组:取稀释液10 ml代替供试液,其他操作同试验组。
(4)供试品对照组:取稀释液1 ml代替菌液,其他操作同试验组。
2.5.2金黄色葡萄球菌检查方法的验证
(1)试验组:取1:10供试液10 ml,经薄膜过滤后,用pH 7.0无菌氯化钠-蛋白胨缓冲液冲洗,每次100 ml,冲洗数次(不大于10次),在最后一次冲洗液中加入金黄色葡萄球菌的菌悬液1 ml(含菌≤100 cfu/ml),混匀,过滤。取出滤膜,加至100 ml的胰酪大豆胨液体培养基中,混匀,(30~35)℃培养24 h;取上述培养物划线接种至甘露醇氯化钠琼脂培养基中,(30~35)℃培养72 h。
(2)阴性对照组:取稀释液10 ml代替供试液,不加菌液,其他操作同试验组。
(3)阳性对照组:取稀释液10 ml代替供试液,其他操作同试验组。
(4)供试品对照组:取稀释液1 ml代替菌液,其他操作同试验组。
2.5.3大肠埃希菌检查方法的验证
(1)试验组:取1:10供试液10 ml,经薄膜过滤后,用pH 7.0无菌氯化钠-蛋白胨缓冲液冲洗,每次100 ml,冲洗数次(不大于10次),在最后一次冲洗液中加入大肠埃希菌的菌悬液1 ml(含菌≤100 cfu/ml),混匀,过滤。取出滤膜,加至100 ml的胰酪大豆胨液体培养基中,混匀,(30~35)℃培养24 h;取上述培养物1 ml接种至含100 ml麦康凯液体培养基中,42 ℃培养48 h;取麦康凯液体培养基划线接种于麦康凯琼脂培养基平板上,35 ℃培养72 h。
(2)阴性对照组:取稀释液10 ml代替供试液,不加菌液,其他操作同试验组。
(3)阳性对照组:取稀释液10 ml代替供试液,其他操作同试验组。
(4)供试品对照组:取稀释液1 ml代替菌液,其他操作同试验组,按规定的培养条件培养。
2.5.4验证结果
由表3和表4可知,6种样品的控制菌检查法都是薄膜过滤法,培养基稀释体积均为100 ml,试验组和阳性对照组正常检出,阴性对照阻和供试品对照组未检出,符合中国药典2015版四部通则1106控制菌检查的要求。

表3 6种样品控制菌检查方法适用性试验薄膜过滤法条件

表4 6种样品控制菌检查方法适用性试验结果(n=3)
注:表中“-”代表无菌落生长;“+”表示典型菌落生长;“/”表示无需进行实验
3 讨论
医院制剂是医院临床用药不可或缺的部分,由于医院制剂主要在本院临床中使用,生产规模一般不大,设备相对简单,制剂质量易存在不稳定的风险,因此需严格按照2015版《中国药典》的规定,进行微生物限度检查方法适用性试验,保证制剂质量的安全可控[4-5]。2015版《中国药典》微生物限度检查方法适用性试验与USP等国际方案趋向一致,更为科学有效[6-7]。
本文按照《中华人民共和国药典》2015年版四部通则1105、1106、1107具体规则作为检测依据,确立了6种外用医院制剂的微生物限度检查方法。6种制剂均有一定的抑菌性,且易溶于水,采用薄膜过滤法可快速、有效地去除药品中所含有的抑菌性,提高检验的效率和结果的准确性[8-9]。《中国药典》2015版四部将加菌提前至供试液制备环节,不仅考虑样品因素对检验的影响,同时考虑了检验过程特别是供试液制备过程的影响,更贴近药品在生产、贮存和运输过程中微生物污染的实际情况,提高试验的科学性[10]。本研究中6种医院制剂均将加菌顺序前移至供试液制备环节,复方氯霉素搽剂、水杨酸搽剂、苯酚甘油滴耳液、硼酸滴耳液和复方呋喃西林滴鼻液均可达到规定的回收比值,复方苯甲酸搽剂采用更高的供试液稀释级后,回收比值可达到规定。本研究建立的方法可为含抑菌成分的外用制剂的微生物限度检查方法适用性试验的研究提供思路。

