单核细胞移动抑制因子对大鼠创伤性颅脑损伤保护作用研究
丁华敏,秦春霞,马凯源,孙莉莉,章越凡,李铁军,
(1.上海市浦东新区浦南医院药剂科,上海 200125;2.安徽中医药大学药学院,安徽 合肥 230012)
颅脑损伤(TBI)是创伤中常见的病症之一,统计数据表明,TBI发病率位于各类创伤之首,有着较高的病残率和病死率,严重影响人们的身体健康与生活质量。而随着社会交通的发展,TBI发病率也在逐年攀升。研究证明,TBI诱发的水肿、炎症和氧化应激等复杂的反应会进一步导致细胞损伤。目前,在临床中缺乏治疗TBI的药物,至今30多个III期前瞻性临床试验均未能获得令人满意的结果,无一种药物具有确切的临床疗效[1]。
单核细胞迁移抑制因子(monocyte locomotion inhibitory factor,MLIF)是由溶组织内阿米巴产生的一种热稳定性化合物[2](相对分子质量583000)。体内、外研究发现,MLIF可以发挥抗炎和免疫保护作用,对类风湿关节炎、神经损伤、心肌缺血、脑缺血及痴呆具有良好的保护作用。Zhang等[3]证实MLIF通过与核糖体蛋白翻译延长因子eEF1A1结合而发挥作用。其中,MLIF与eEF1A1结构域的区段1(domain1)结合,抑制脑微血管内皮细胞炎症黏附分子ICAM-1和VCAM-1的表达,升高eNOS的表达量,改变内皮细胞功能,从而发挥保护作用。MLIF使体循环中NO含量和脂质过氧化物的水平降低,iNOS基因表达降低,同时MLIF提高IL-10和TGF-β的表达,进而发挥神经保护作用[4]。
本课题组前期研究发现MLIF在脑缺血损伤方面能够发挥显著的保护作用,MLIF可以降低大鼠/小鼠脑缺血模型中脑梗死面积,能够抑制细胞黏附因子发挥保护血管的作用,并且可抑制MPO、TNF-α、IL-1β的过量表达。提示MLIF可能具有颅脑损伤保护作用[5]。本实验采用液压冲击法建立大鼠颅脑损伤模型,观察MLIF对大鼠颅脑创伤的保护作用,探索MLIF可能的神经保护作用机制,为其预防与治疗颅脑损伤提供科学依据。
1 材料
1.1 药物与试剂
MLIF(杭州中肽生化有限公司);超氧化物歧化酶(SOD)活性检测试剂盒、丙二醛(MDA)活性检测试剂盒(碧云天生物技术有限公司);水合氯醛、4%多聚甲醛(国药集团化学试剂有限公司)。
1.2 实验动物
健康成年SD大鼠,雄性,清洁级,体重250~300 g,购自上海斯莱克实验动物有限公司。实验前,动物房适应饲养1周,室温(25±2)℃,相对湿度40%~70%,自由进食和饮水。所有动物实验过程均符合实验动物伦理学要求。
1.3 仪器与设备
ALC-FP6型动物液压冲击颅脑损伤仪(上海奥尔科特生物科技有限公司);FA1104型电子分析天平(上海舜宇恒平科学仪器有限公司);脑立体定位仪(瑞沃德生命科技有限公司);电热恒温鼓风干燥箱(上海精宏实验设备有限公司)。
2 方法
2.1 大鼠颅脑创伤模型的制备
参照Mcintosh等[6]的实验方法,采用液压冲击法建立大鼠颅脑创伤模型。大鼠称重,10%水合氯醛腹腔注射麻醉,俯卧于手术台上,大鼠头部固定于脑立体定位仪上。大鼠头顶部去毛,碘酒消毒头皮。沿正中矢状线剪开长约1.5 cm的头皮切口,分离骨膜,暴露颅骨。脑立体定位仪定位选取右侧颅顶冠状缝后2 mm、矢状缝旁开2 mm处,用牙科钻磨开一直径为5 mm的圆形骨窗,保持硬脑膜的完整。将自制打击管用牙科水泥粘接固定于圆形骨窗上,待打击管固定牢固后,用37℃生理盐水将打击管注满。待大鼠恢复角膜反射或夹尾反射后,将打击管与液压冲击仪端口连接,调整液压冲击仪(强度为2.026×105Pa)进行打击。然后取下打击管,消毒、缝合头皮,将大鼠放回笼中饲养。打击后瞬间,大鼠出现四肢抽搐,同时有数秒的呼吸抑制现象,表明打击造模成功。假手术组仅剪开头皮,分离骨膜,磨出骨窗,不进行液压冲击,其余步骤与模型组相同。
2.2 脑组织含水量测定
2.2.1不同给药剂量下大鼠脑组织含水量测定
实验大鼠分为5组:假手术组、模型组、MLIF低、中、高剂量组(0.33、1、3 mg/kg)。假手术组、模型组给予等体积的生理盐水。颅脑创伤后30 min内完成第1次尾静脉注射给药。创伤后24 h,水合氯醛麻醉大鼠处死,迅速断头取脑,滤纸吸干表面水分,用天平精密称取湿重,置于110℃烘箱中烘烤24 h至恒重,称取干重。参考Elliot公式计算:脑组织含水量(%)=(湿重-干重)/湿重×100%。
2.2.2不同给药时间点大鼠脑组织含水量测定
实验大鼠分为3组:假手术组、模型组、MLIF(1 mg/kg)组。颅脑创伤后30 min内完成第1次给药,创伤后每天尾静脉注射给药1次,连续7 d。假手术组、模型组给予等体积的生理盐水。分别于颅脑创伤后1、3、7 d,取出脑组织,测定脑组织含水量。
2.3 血清中超氧化物歧化酶(SOD)和丙二醛(MDA)含量检测
大鼠分组及给药方法同“2.2.2”项。分别于颅脑创伤后1、3、7 d,大鼠取血后离心,分离血清。按照SOD和MDA试剂盒说明书检测两者水平。
2.4 脑组织病理学检查
大鼠分组及给药方法同“2.2.2”项。分别于颅脑创伤后1、3、7 d,大鼠用10%水合氯醛麻醉,用生理盐水和4%多聚甲醛心脏灌注后,断头取脑,置于4%多聚甲醛中固定24 h。石蜡包埋切片,行HE染色和尼氏染色,观察脑组织神经元细胞病理形态学变化。
2.5 统计学分析
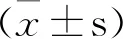
3 结果
3.1 MLIF对颅脑创伤大鼠的保护作用
3.1.1不同给药剂量对脑创伤大鼠脑组织含水量的影响
与假手术组比较,模型组大鼠脑创伤后脑含水量显著增加(P<0.01),见图1。MLIF低、中、高剂量组(0.33、1、3 mg/kg)脑含水量与模型组相比明显降低,具有统计学差异(P<0.01)。MLIF中剂量组(1 mg/kg)脑水肿程度减轻效果最好,故实验选用MLIF 1 mg/kg剂量进行氧化应激水平和病理学研究。
图1 不同剂量MLIF对颅脑创伤大鼠脑组织含水量 的影响(-x±s,n=12)**P<0.01,与模型组比较;##P<0.01,与假手术组比较
3.1.2MLIF对大鼠脑创伤不同时间点脑组织含水量的影响
分别于大鼠在脑创伤后1、3、7 d断头取脑,创伤后1 d,模型组大鼠脑含水量显著高于假手术组(P<0.01);与模型组比较,给予MLIF(1 mg/kg)组大鼠脑含水量显著降低(P<0.01)。创伤后3 d,模型组脑含水量到达一个高峰,显著高于假手术组(P<0.01);MLIF(1 mg/kg)组大鼠脑含水量明显低于模型组(P<0.01)。创伤后7 d,模型组与MLIF(1 mg/kg)组大鼠脑含水量均下降,差异无统计学意义。结果见图2。

图2 大鼠颅脑创伤后不同时间点脑 含水量变化(%)(-x±s,n=8)**P<0.01,与模型组比较;##P<0.01,与假手术组比较
3.2 MLIF对脑创伤大鼠血清中SOD和MDA水平的影响
MLIF对颅脑创伤大鼠血清中SOD和MDA含量的影响结果见图3。

图3 MLIF对颅脑创伤大鼠血清中SOD和MDA含量 的影响(-x±s,n=8) A.大鼠血清SOD水平;B.大鼠血清MDA水平*P<0.05, **P<0.01,与模型组比较;##P<0.01,与假手术组比较
创伤后1 d,模型组大鼠血清中SOD含量显著降低,与假手术组比较(P<0.01);与模型组比较,MLIF (1 mg/kg)组大鼠血清中SOD含量明显升高(P<0.05)。创伤后3 d,模型组大鼠血清中SOD含量显著低于与假手术组(P<0.01);MLIF(1 mg/kg)组大鼠血清中SOD含量显著高于模型组,差异具有统计学意义(P<0.05)。创伤后7 d,模型组与MLIF (1 mg/kg)组大鼠血清中SOD含量差异无统计学意义。MDA检测水平方面,创伤后1 d,模型组大鼠血清中MDA含量显著升高,与假手术组比较(P<0.01);MLIF (1 mg/kg)组大鼠血清中MDA含量较模型组明显降低(P<0.01)。创伤后3 d,模型组大鼠血清中MDA含量明显高于假手术组(P<0.01);MLIF (1 mg/kg)组大鼠血清中MDA含量显著降低,与模型组比较(P<0.05)。创伤后7 d,模型组与MLIF (1 mg/kg)组大鼠血清中MDA含量差异无统计学意义。
3.3 MLIF对脑创伤大鼠脑组织病理损伤的影响
HE染色结果如图4所示。假手术组:脑组织皮层结构正常,未见出血、水肿及损伤,各细胞层次清楚,排列整齐有序,神经元核仁清晰,无血管扩张现象。模型组:创伤后1 d,创伤灶及其周边组织发生明显水肿,神经元和胶质细胞胞体轻微肿胀,可见细胞核固缩或破碎。创伤后3 d,脑创伤灶及其周边组织水肿加重,神经细胞肿胀进一步加深,胞浆浓染,细胞核固缩及缺失,炎性细胞浸润。创伤后7 d,神经细胞肿胀明显减轻,正常细胞数量稍有增多。MLIF(1 mg/kg)组:创伤后1 d,创伤区域组织较模型组水肿程度明显减轻,神经细胞肿胀减少。创伤后3 d,创伤及周围组织仍有水肿,但较模型组明显减轻。部分空泡中央细胞缺失,核固缩程度稍有好转。创伤后7 d,水肿显著减轻,神经细胞肿胀好转。
图4 HE染色观察各组大鼠脑组织病理学变化(400×)
3.4 MLIF对脑创伤大鼠脑组织神经元存活的影响
神经组织的基本组成成分主要包括神经细胞和神经胶质细胞。而尼氏体为神经元合成蛋白质的主要场所,因此与神经元的功能发挥关系密切。当各种诱发因素导致神经元受损害变性时,则会通过尼氏体的形状、大小和数量表现出来。课题组分别对颅脑创伤后1、3、7 d大鼠大脑皮层神经元进行尼氏染色,观察脑组织神经元细胞形态的改变。从图5可以看出,假手术组:皮层区神经元形态规则,排列整齐,尼氏小体数量较多,染色均匀,清楚可见。模型组:神经元细胞大量减少,同时可见坏死、核固缩,神经元排列紊乱、无层次感。MLIF(1 mg/kg)组:神经元细胞数量明显增加,正常形态细胞较模型组稍多,神经元损伤较模型组轻。
4 讨论
啮齿动物模型在TBI研究中最为常见[7]。目前,颅脑创伤主要有4个具体的动物模型广泛用于研究:流体冲击伤害(FPI)模型、受控皮质影响(CCI)损伤模型、重物下降冲击加速度损伤模型和爆炸伤模型。FPI模型复制临床TBI而无颅骨骨折。FPI可以复制颅内出血、脑肿胀和进行性灰质损害,这些都是人类TBI的病理生理学标志。
脑水肿是临床常见的病症,水肿的形成主要是由于血管外液体积聚和水代谢紊乱。目前,脑水肿可以分为两大类,即细胞毒性(又称细胞性)水肿或血管源性水肿[8]。事实上,一些研究报告指出,大脑水肿引起的死亡率可能占总死亡率的一半,年轻人群中 TBI 的患病率更高[9-10]。脑水肿会导致细胞肿胀,改变细胞代谢物浓度,从而改变细胞生理学、生物化学和其他细胞功能。肿胀不仅涉及细胞本身而且涉及薄壁组织,从而引起颅内压迅速增加,导致血管压缩,组织血流减少,进而损害大脑正常功能[11]。本实验结果显示,与模型组相比,MLIF能够明显降低脑含水量,减轻脑水肿,从而发挥对颅脑创伤的保护作用。

图5 尼氏染色观察各组大鼠脑组织神经元细胞形态(400×)
氧化应激增加是影响创伤后损伤的另一个关键因素,因为大脑对游离的自由基高度敏感[12]。在TBI之后,自由基过量产生的几个潜在来源包括:线粒体呼吸链、儿茶酚胺氧化、膜磷脂分解、氧化酶活化、浸润嗜中性粒细胞、在细胞内和细胞外抗氧化防御系统受到攻击。目前认为氧化应激是引起TBI后继发性损伤级联反应的主要原因。而氧化应激指标SOD和MDA的含量则能反映机体氧化应激的水平[13]。
课题组采用大鼠液压冲击法制备大鼠颅脑创伤模型,给予MLIF干预,结果显示,MLIF能够降低脑创伤大鼠脑组织含水量,减轻脑水肿;MLIF可以提高SOD活性,减少MDA含量,抑制脑损伤氧化应激反应;并且保护脑组织神经元受损,对脑组织病理损伤有明显的改善作用;实验表明,MLIF对颅脑创伤具有保护作用。对于MLIF保护颅脑创伤的具体作用环节和主要作用靶点尚不清楚,还有待深入研究。

