“质量源于设计”在制备N-乙酰半胱氨酸注射液中的应用
张莉燕,宋金春
(武汉大学人民医院药学部,湖北 武汉 430060)
2004年9月,美国食品药品监督管理局(FDA)提出将质量源于设计(QbD)理念应用于药品的研发和生产[1];2006年,人用药品注册技术标准国际协调会(ICH)Q8 指南指出,QbD是从预定义产品目标开始,基于科学和风险管理的方法,加强对产品的理解及过程控制的一种系统的开发方法[2]。基于 QbD 理念建立满足预定义目标且工艺稳健的设计空间,对相关工艺参数或物料属性的超限范围进行界定[3],重点关注控制策略和工艺的耐用性,参数在设计空间内变动时,产品质量也能保持一致。
N-乙酰半胱氨酸(N-acetylcysteine,NAC)是半胱氨酸的乙酰基衍生物[4],作为对乙酰氨基酚过量的解毒剂被广泛认可[5],可通过作用于谷氨酸能和多巴胺能神经传递、氧化应激、神经发生、线粒体障碍和炎症途径等发挥作用[6-7]。在国内,其注射液用于肝衰竭早期治疗,以降低胆红素、提高凝血酶原活力;但在滴注时可出现恶心、呕吐、皮疹、瘙痒、支气管痉挛、头痛头晕、发热、过敏反应等。实验参考Cumberland Pharmaceuticals Inc.原研制剂的处方组成,基于QbD理念对处方因素进行优化和选择,保障注射液质量。
1 仪器与试剂
CPA225D电子分析天平(德国赛多利斯公司);ZNCL-GS智能磁力搅拌器(巩义市予华仪器有限责任公司);BF2000氮气吹干仪(北京八方世纪科技有限公司);雷磁PHS-3E型pH计(上海仪电科学仪器股份有限公司);砂芯过滤器(天津市津腾实验设备有限公司);SK5200H超声波清洗器(上海科导超声仪器有限公司);Milli-Q超纯水系统(美国密理博公司);安捷伦1100高效液相色谱仪(配有G1379A真空脱气机、G1311A四元梯度泵、G1313A自动进样器、G1316A柱温箱、G1315B-DAD检测仪及Agilent化学工作站,美国Agilent公司)。
N-乙酰半胱氨酸原料药(武汉远大弘元股份有限公司)、依地酸钙钠(上海易恩化学技术有限公司);磷酸二氢钠、磷酸均为分析纯;甲醇为色谱纯[赛默飞世尔科技(中国)有限公司];水为超纯水。
2 试验方法
2.1 定义目标产品的质量概况
通过查阅原研产品说明书、文献信息,查询目标产品的临床给药特点、给药途径、剂型、规格、容器密闭系统等信息,进行前瞻性的总结,定义目标产品的质量特性(guality target product profile,QTPP)[8],如表1所示。

表1 NAC注射剂的目标产品质量概况
2.2 识别产品关键质量属性
注射剂的关键质量属性(CQAs)通常包括:①无菌保证;②热原或细菌内毒素;③外源性杂质;④注射液的稳定性(如pH值、颜色、有关物质、含量等)以及复溶性等[8]。NAC易氧化变色,进行处方开发时,将注射液灭菌前后pH值的变化量及主药含量作为关键评价指标,即响应。
2.3 风险评估
根据实验过程绘制鱼骨图筛选出影响制剂质量的因素(图1),主要包括处方因素及工艺因素两部分。
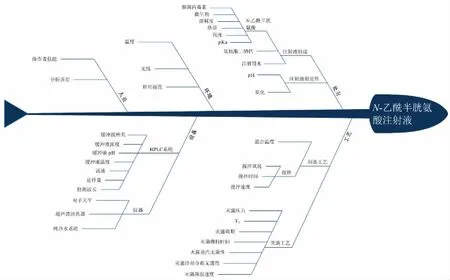
图1 影响制剂质量因素的鱼骨图
采用失效模式与效应分析(FMEA)对各因素风险进行定量评估[9],根据风险评估系数值(risk priority number,RPN)确定关键工艺参数。RPN值是由各因素严重程度(S)、发生率(O)和检测难易程度(D)的得分值相乘得到[3],当某参数的RPN值大于8时,则被确定为关键工艺参数。S、O、D评分原则及参数RPN见表2和图2。

表2 严重程度(S)、发生率(O)和检测难易程度(D)的评分原则
注:由于本试验中影响制剂质量的因素或可通过仪器检测间接评估,或为特性参数可直接直观判断(图1、图2),故对于检测难易程度(D)只设置了容易检测到和很难被检测到两种情况
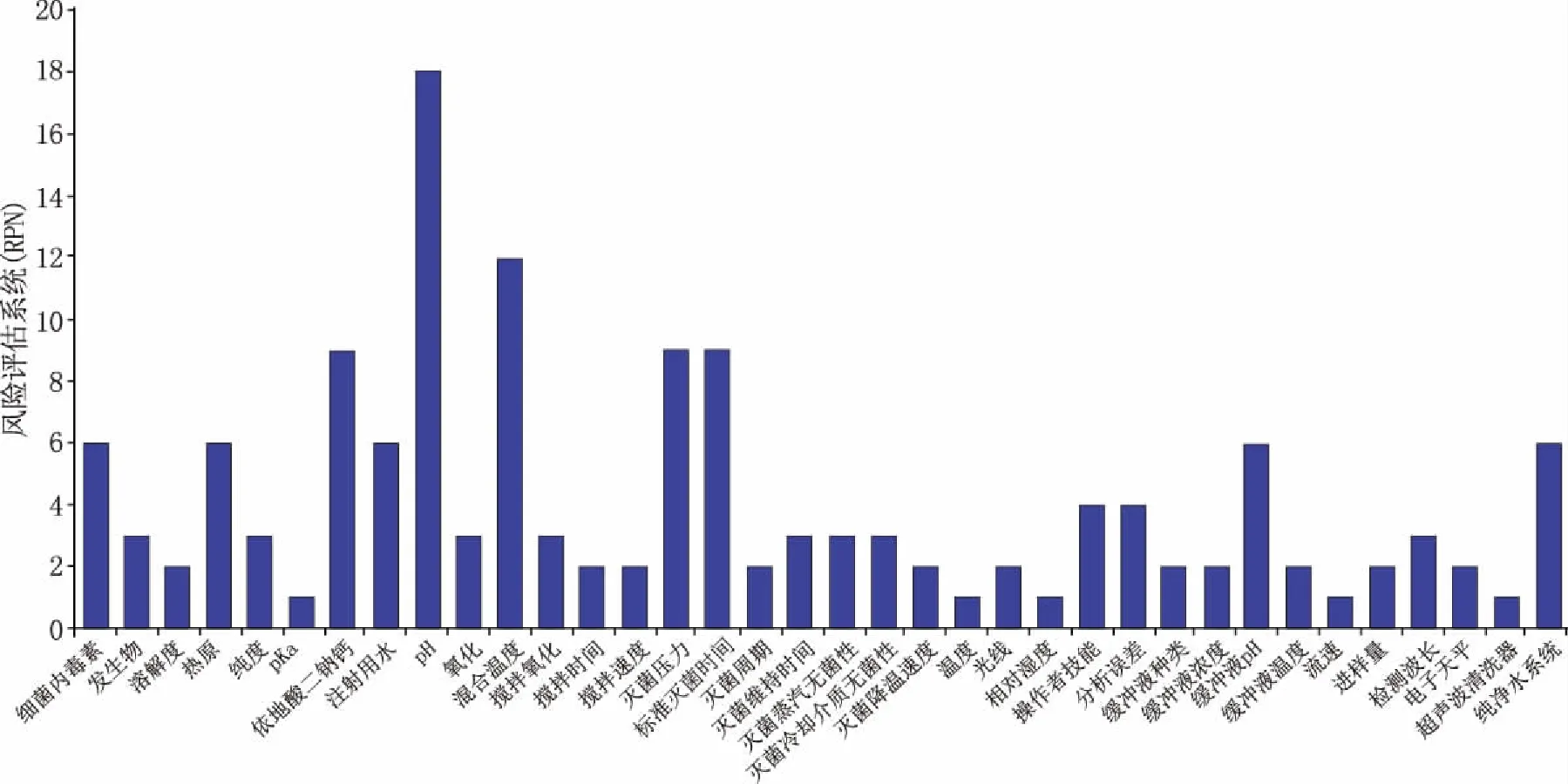
图2 FMEA风险评估结果
2.4 关键工艺参数
由风险评估结果(图2)可知,依地酸钙钠、pH值、配液温度、灭菌压力、标准灭菌时间的RPN值较大,pH值由预实验结果已确定,因此,本实验选取依地酸钙钠添加量、配液温度及灭菌条件作为影响制剂质量的关键工艺参数。
2.5 试验设计
对3个关键工艺参数:依地酸钙钠添加量(A)、配液温度(B)、灭菌条件(C)用Minitab软件做全因子试验设计,以灭菌后pH值变化量(Y1)、主药含量(Y2)为响应,试验设计因子水平和响应(表3、表4),各序列处方见表5。
2.6 注射剂的制备
量取约80%处方量的注射用水,通氮气饱和后加入处方量的NAC和不同比例的依地酸钙钠,在氮气条件下搅拌使之溶解,加入饱和NaOH溶液,调节pH 为6.5~7.5,加入氮气饱和的注射用水至处方量,0.45 μm微孔滤膜过滤,检查滤液澄明度后灌封,通氮气于上部空间,灭菌后灯检,按照规定方法进行可见异物检查,合格样品即为成品。

表3 试验设计因子水平表

表4 相应目标值与可接受范围

表5 析因试验设计表
2.7 分析方法
2.7.1色谱条件
色谱柱:Wondasil C18柱(250 mm×4.6 mm,5 μm);流动相:10 mmol/L磷酸盐缓冲液(浓磷酸调节pH至2.15)-甲醇(90:10,V/V);流速:1.0 ml/min;检测波长:210 nm;柱温:25 ℃;进样量:20 μl。
2.7.2 对照品溶液的制备
取NAC对照品适量,精密称定,加流动相制成0.08 mg/ml的溶液,按上述色谱条件进样。
2.7.3供试品溶液的制备
量取制备的NAC注射剂适量,加流动相制成2 mg/ml的溶液,再精密量取上述溶液适量,加流动相制成0.08 mg/ml的溶液,按上述色谱条件进样。
2.7.4线性关系考察
制备不同浓度的NAC对照品溶液,按上述色谱条件进样,以NAC对照品峰面积(Y)对质量浓度(X)作图,进行线性回归,得NAC的标准曲线回归方程为Y= 14 679X-99.267,相关系数R2=0.999 7。
3 结果
3.1 试验设计结果
按表5设计的试验顺序进行试验,结果见表6。对结果进行分析,各响应的因子效应图见图3、图4,方差分析结果见表7。
因子效应图表明,因子A、B、C及其相互作用产生的复合因子AB、AC、BC均对响应Y1、Y2有显著影响。相关性好的模型R2应大于0.8,本试验 Y1、Y2模型的R2分别为0.994 0和0.989 0,且与R2(调整)接近,表明回归模型对试验拟合较好,可以信赖;Y1、Y2模型弯曲P值大于0.05,表明模型不存在弯曲;失拟P值大于0.05,表明不存在更高阶的相互作用,构建模型合适。

表6 试验设计结果

图3 Y1因子效应图(α=0.05) A.标准化效应的Pareto图;B.标准化效应的正态图

图4 Y2因子效应图(α=0.05) A.标准化效应的Pareto图;B.标准化效应的正态图

来源模型P值弯曲P值失拟P值R2(%)R2(调整)(%)Y1全模型0.0000.8790.45299.4098.51Y2全模型0.0010.8060.24398.9097.25
注:a=0.05

表8 NAC设计空间验证结果
由图5可见,残差均在正常范围内,且满足正态分布,最终得到响应Y1、Y2的回归方程:
Y1=0.419 09+0.112 50A+0.050 00 B+0.067 50C+0.042 50AB-0.080 00AC+0.167 50 BC
Y2=105.234-3.826A-1.456B-1.499C-1.351AB+3.856AC-4.934BC
从输出的Y1、Y2等值曲线图(图6)可见,较浅区域的响应更满足要求,对响应进行叠加得到等值曲线叠加图(图7),确定可接受范围。图中白色区域为可行区域,即建立的设计空间。最后运用响应优化器进行优化,如图8所示,A、B、C因素分别从低水平变化到高水平时,两个响应的变化趋势相反;由预实验结果已知注射液最适合的pH值在6.5~7.5,虽然注射液灭菌前后的pH值变化较大,但仍处于上述范围内,故对响应Y2给予更多的关注。将Y2和Y1的权重比调至9:1进行优化时,复合合意性为0.7269,表明两个响应均获得较好的结果,从而得出最佳工艺参数:依地酸钙钠添加量(A)为0.049 192%,配液温度(B)为60℃,灭菌条件(C)为116℃,40 min。
3.2 设计空间的验证
为了验证设计空间的可靠性,选择空间内的点(0.5,0.0),即依地酸钙钠添加量为0.045%,配液温度为50℃,灭菌条件为116℃, 40 min进行验证,平行3次测定,结果显示,实验值与预测值相近,表明建立的模型具有较好的预测能力,且在设计空间内改变生产工艺和参数时能保证制剂质量的均一可控。

图5 Y1、Y2残差图 A.Y1残差正态概率图;B. Y1残差直方图;C.Y2残差正态概率图;D. Y2残差直方图

图6 Y1、Y2等值曲线图 A.Y1与B(t/℃)、A(依地酸钙钠)的等值线图;B.Y2与B(t/℃)、A(依地酸钙钠)的等值线图

图7 Y1、Y2等值曲线叠加图

图8 多响应优化图
4 讨论
本实验参考Cumberland Pharmaceuticals Inc.原研制剂处方组成,基于QbD理念,开发了稳定性好、致敏性低的注射液。绘制鱼骨图结合FMEA法进行因子风险评估,确定了依地酸钙钠添加量、配液温度及灭菌条件作为影响制剂质量的关键工艺参数;通过析因实验设计研究了CPPs对响应的影响,最终得到最佳工艺参数及设计空间,且验证空间结果与预测值接近。按照QbD理念设计的注射液,其工艺参数在设计空间内变化时,质量仍能保持均一稳定,从而保障了药品质量。

