不同小鼠肝炎病毒对ELISA方法检测其血清抗体的影响*
吴朋朋 白 冰 张彩勤 赵 勇 苗海港 师长宏
(空军军医大学实验动物中心,西安 710032)
小鼠肝炎病毒(Mouse Hepatitis Virus,MHV)是国家标准(GB14922.2—2011)中规定的实验用鼠病毒学重要检测项目。MHV具有高度传染性,但在鼠群中通常以潜伏性感染存在,并可通过胎盘垂直传播。当感染小鼠群免疫功能下降时,即可能引起整个鼠群爆发性的急性感染,导致动物大量死亡,严重影响实验动物的生产和动物实验的结果[1]。除此之外,小鼠肝炎病毒感染后会引起小鼠各种免疫应答参数的改变,干扰试验结果,影响研究结果的准确性和可靠性[2-3]。
国家标准(GB14922.2—2011)规定实验用小鼠每3个月至少进行一次微生物检测,故MHV血清抗体的检测是实验用小鼠质量控制的重要举措[4-5]。然而,现今已分离到的MHV病毒株有MHV1、MHV2、MHV3、JHM、A59、MHV-S、MHV-Z、MHV-U等[6],不同的MHV毒株因其嗜组织性不同具有不同的致病性,如JHM为嗜神经毒性,MHV3为嗜肝性,A59同时具有嗜神经毒性和嗜肝性两种特性[7-8]。由于MHV有多个毒株,在研制ELISA抗体检测试剂盒时,选用哪些毒株作为检测用的抗原,将直接影响到血清抗体检测结果的特异性和敏感性。各国及各地区MHV流行情况不一样,所选用的毒株也各不相同[9]。国家标准(GB/T14926.22—2001)规定了MHV1、MHV3、JHM和A59 4种病毒作为MHV抗体检测的抗原[10]。
本实验室每季度都会对本地区饲养的实验小鼠进行病毒检测,采用的方法是ELISA监测(GB/T14926.50—2001)、免疫荧光复检(GB/T14926.52—2001)和核酸测序确诊[11]。其中MHV抗体水平检测采用的是国内生产的ELISA检测试剂盒。使用中发现ELISA抗体检测结果和IFA抗体检测结果存在一定差异,具体表现在:当血清抗体水平处于判定临界值左右时(0.15~0.22),ELISA抗体检测阴性结果在IFA复检时存在29.7%的阳性结果(11/37),病毒核酸测序结果也提示本地区的MHV流行毒株与ELISA抗原包被的MHV病毒株有所不同。为了获得适合本地区MHV抗体检测的ELISA方法,本研究选取了3种MHV毒株MHV1、JHM和A59,通过L929细胞扩增培养获得纯化浓缩抗原,筛选获得了适合本地区的包被抗原类型,优化了ELISA反应体系,建立了规范化的MHV血清抗体检测方法。
1 材料与方法
1.1 病毒、细胞及实验动物等实验材料来源
小鼠肝炎病毒MHV1(ATCC VR-261)、MHV-JHM(ATCC VR-765)、MHV-A59(ATCC VR-764)购于美国模式培养物集存库(ATCC);细胞L929购于国家实验细胞资源共享平台;DMEM细胞培养基及其他添加剂均为Hyclone公司产品;小鼠肝炎病毒(MHV)、小鼠仙台病毒(SV)、小鼠肺炎病毒(PVM)、呼肠孤病毒III型(Reo3)、小鼠细小病毒(MVM)和鼠痘病毒(Ect)阳性血清购于中国食品药品检定研究院;HRP-羊抗鼠IgG酶标抗体购买于Abcam公司;酶标仪购于Bio-rad公司;超速离心机购于Beckman公司;商品化MHV抗体ELISA诊断试剂盒购买于国内某公司;165份小鼠血清由本实验室保存。
SPF级BALB/C小鼠30只,6~8周龄,体质量25~27 g,购于北京维通达生物技术有限公司[SCXK(京)2014-001],隔离饲养于空军军医大学实验动物中心SPF级动物设施[SYXK(陕)2014-001],动物实验通过了空军军医大学实验动物福利及伦理委员会批准(编号17034)。
1.2 病毒的扩增及纯化
将购买的3株小鼠肝炎病毒MHV-A59、MHV1和MHV-JHM冰上融化后分别用无血清DMEM培养基稀释(0、1∶5、1∶10、1∶20、1∶40)后接种到培养成单层的L929细胞中,同时以无血清DMEM培养基作为阴性对照孔,在37 ℃、5%的CO2培养箱中孵育3 h(每30 min摇晃一下细胞),孵育结束后弃掉病毒孵育液补加适量的完全细胞培养液(含10%胎牛血清)继续于37 ℃、5%的CO2培养箱中,培养至出现明显的细胞病变。
将出现病变的细胞培养物反复冻融5次,每组取少量病毒冻融液用于病毒滴度测定,其余冻融液经56 ℃ 30 min灭活处理后,5 000 r/min离心30 min,除去细胞碎片,收集上清病毒液再4 ℃超速离心(25 000 r/min,82 700 g)3 h以浓缩病毒,将浓缩后的病毒液作为抗原用于后期的ELISA检测板包被[12]。
1.3 病毒滴度(TCID50)测定
将扩增后的病毒液10倍梯度稀释(10-1~10-8共8个梯度)后接种到L929细胞中,每个梯度8个重复,72 h后观察细胞病变情况,按照Reed-Muench法计算病毒滴度[13]。
1.4 血清的制备
阳性对照血清制备:取灭活的3种MHV病毒等体积混合液接种6~8周龄SPF级BALB/C小鼠30只,免疫程序参考侯丽波等[14]方法,接种方法如下:第1天完全佐剂+病毒液(50 μg)每只小鼠肌肉注射0.1 mL,腹腔注射0.2 mL;第14天不完全佐剂+病毒液(50 μg)每只小鼠肌肉注射0.1 mL,腹腔注射0.2 mL;第21天不完全佐剂+病毒液(50 μg)每只小鼠肌肉注射0.1 mL,腹腔注射0.2 mL;第28天不完全佐剂+病毒液(50 μg)每只小鼠肌肉注射0.1 mL,腹腔注射0.2 mL。分别于免疫后第1、3、5、7、14、21、28、35、42天采血测定MHV抗体,确定最佳采血时间。抗体△A值介于1.0~1.5之间的稀释血清均可作为后续ELISA检测的阳性对照血清。
阴性对照血清制备:收集排除MHV感染的SPF级BALB/C小鼠血清,经MHV抗体检测抗体△A值小于0.2的稀释血清均可作为后续ELISA检测的阴性对照血清。
165份待检血清制备:采取待检小鼠的血液500 μL以上,室温静置后离心分离血清,储藏在-80 ℃冰箱中备用。
1.5 ELISA反应体系的优化
用不同稀释倍数的病毒浓缩液包被ELISA酶标板,测定梯度稀释的免疫血清和标准对照血清的A值,挑选出最为合适的病毒包被浓度、封闭液浓度以及血清稀释倍数,并比较在不同的反应条件下免疫血清检测结果的差异,确定适合本实验室的最佳反应条件。
1.6 血清样品的检测及判定标准的确定
按照优化的最佳ELISA反应条件与步骤,随机选取50份已知抗体浓度的免疫血清,用本研究制备的诊断试剂盒进行抗体浓度的测定,取波长492 nm和405 nm,读取各孔A值,结果以A492减A405(△A)表示。
结果判定:阳性对照△A值≥0.2,阴性对照△A值<0.2,同时满足以上两个条件实验成立;否则不成立。
以已知阳性临界血清测量值为参考,计算出阴性血清样品平均△A值和标准差SD,且每份阴性样品△A值是通过3次ELISA测定求的平均值,进而计算出阳性判定临界值(cut-off value):临界值=阴性样品的平均△A值+3SD。
1.7 检测体系的质量控制
特异性试验:按照优化好的最适ELISA反应条件与步骤,用本试剂盒分别检测MHV、SV、PVM、Reo3、MVM和Ect阳性血清,每个样品重复检测3次,同时做阴性和阳性对照孔,分别计算每份血清的△A均值,从而确定本试剂盒的特异性。
重复性试验:用本试剂盒在相同的试验条件下,将5份ELISA阳性样品,2份ELISA阴性样品,每个样品重复检测3次,分别计算每份血清的△A均值(average value,AV)、标准差(standard deviation,SD)、变异系数(the coefficient of variation,CV)。同时用不同批次包被的酶标板进行批次间重复性检验。
稳定性试验:为评价所建立的ELISA检测方法的稳定性,将包被好的ELISA酶标板分别置于37 ℃、25 ℃、4℃环境,每天取出1块,连续测定7 d,观察阳性血清样品和阴性血清样品的△A值的变化。
灵敏度试验:将MHV阳性血清做倍比稀释,检测本研究制备的试剂盒所能检测出的最低抗体滴度。
1.8 性能评价与初步应用
用本研究制备的ELISA诊断试剂盒与商品化MHV ELISA试剂盒平行检测165份小鼠血清样品,评价本研究制备的试剂盒与商品化试剂盒的检测结果符合率。
1.9 统计方法
所有计量数据以平均数表示,应用SPSS19.0统计学软件对各项指标数据进行统计学分析,应用配对t检验对组间进行分析比较,以P<0.05为差异有显著性。
2 结果
2.1 病毒的扩增及病毒滴度的测定
L929细胞感染MHV-JHM病毒株36 h即可观察到细胞病变,48~60 h病变最为明显,72 h后细胞逐渐崩解;MHV-A59和MHV1毒株则于感染48 h以后出现细胞病变,病变明显时间段为60~72 h,随后细胞逐渐崩解(图1),分别在感染96 h后收取3种病毒的细胞培养物进行病毒滴度测定(图2),发现3种病毒的最佳接种浓度(病毒稀释倍数)均不相同,MHV1(1∶5稀释)、MHV-A59(1∶10稀释)、MHV-JHM(1∶20稀释)。病毒培养物经56 ℃ 30 min灭活处理后,5 000 r/min离心30 min除去细胞碎片,收集上清病毒液再经4 ℃超速离心(25 000 r/min,82 700 g)3 h浓缩病毒,将浓缩后的病毒液作为抗原用于后期的酶标板包被。

图1 不同MHV感染L929细胞出现的细胞病变(72 h,×10)注:A:MHV-A59;B:MHV1;C:MHV-JHM;D:L929细胞Fig.1 The cytopathic effect inoculated with L929 in 72 hourNote:A:MHV-A59;B:MHV1;C:MHV-JHM;D:L929

图2 不同稀释倍数MHV感染L929细胞96 h病毒滴度Fig.2 L929 cells were infected with different dilutions of MHV at 96 h
2.2 阳性标准血清的制备
如图3所示,BALB/C小鼠感染MHV后,第3天即可检测到抗体水平,5~7 d抗体水平开始快速升高,21 d左右抗体水平的△A值达到1.0以上,在35 d达到最高峰并维持一段时间,因此可于免疫后35 d采取全部小鼠血清,MHV抗体滴度(△A)介于1.0~1.5之间的稀释血清均可作为后续ELISA检测的阳性对照血清。
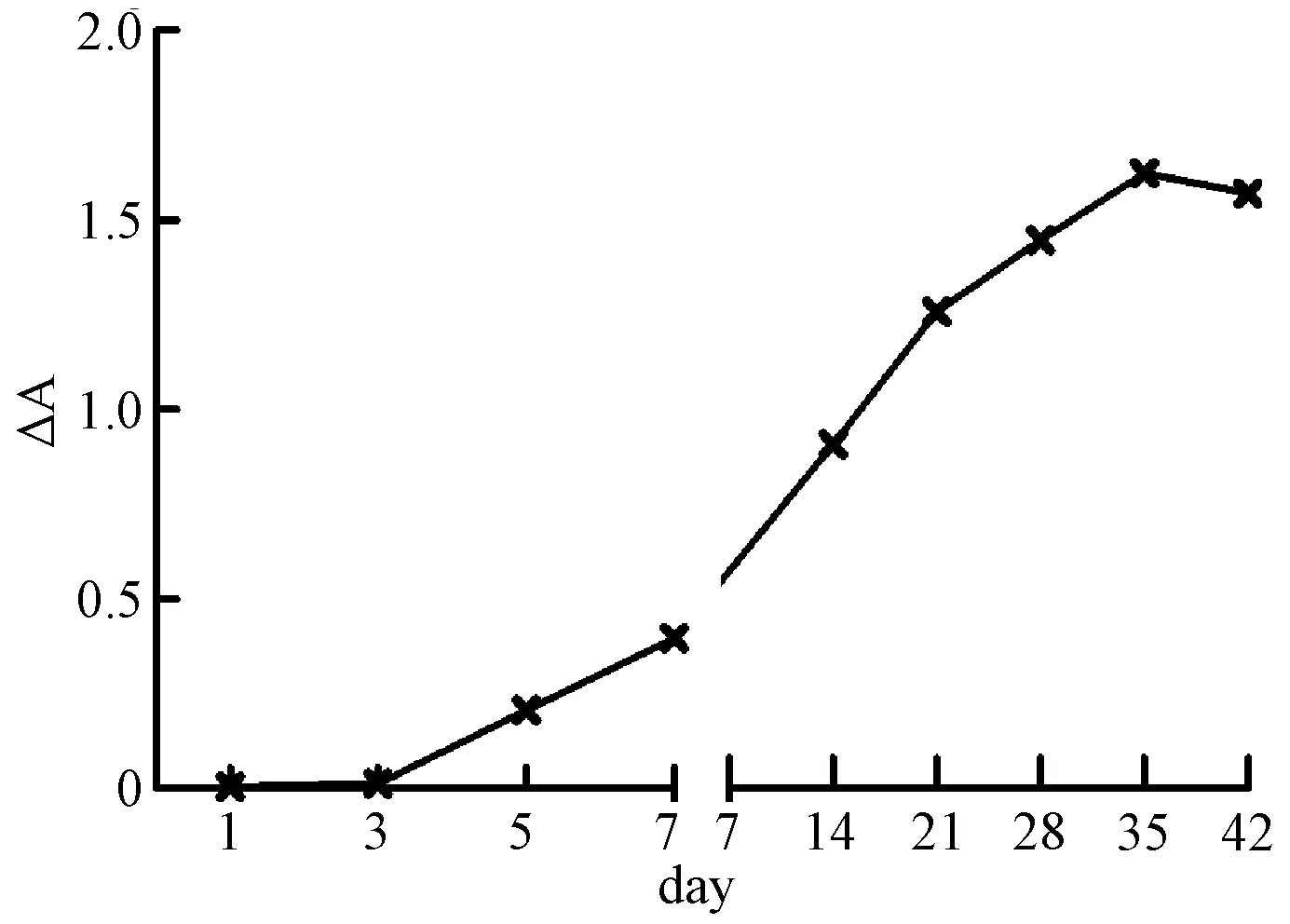
图3 MHV免疫BALB/C小鼠血清MHV抗体变化Fig.3 The antibody variation of SPF mice(BALB/C)inoculated with MHV
2.3 ELISA反应体系的优化
2.3.1病毒类型及包被浓度:分别用灭活的3种小鼠肝炎病毒MHV-A59、MHV1和MHV-JHM病毒包被ELISA酶标板孔,测定已知浓度的免疫阳性血清和标准血清的△A值,每组3个重复,以△A值最大为最优的包被病毒,结果如图4所示,MHV1包被的ELISA酶标板测定的血清浓度更为接近商品化试剂盒,与A59和JHM包被的ELISA酶标板测定的血清浓度差异显著(P<0.05)。

图4 不同MHV测定小鼠血清MHV抗体注:C1-C6:C57BL/6J小鼠血清;B1-B4:BALB/C小鼠血清;K2:昆明小鼠血清;Positive:MHV阳性血清; Negative:MHV阴性血清;BLANK:空白对照Fig.4 The MHV antibody of mice test with different MHVNote:C1-C6:C57BL/6J;B1-B4:BALB/C;K2:Kunming;Positive:MHV antibody positive serum sample; Negative:MHV antibody negative serum sample;BLANK: MHV antigen-free control
MHV1病毒浓缩液用包被缓冲液稀释为不同浓度(0、1∶5、1∶10、1∶20、1∶40)包被ELISA酶标板孔,测定已知浓度的免疫阳性血清和标准血清的△A值,每组3个重复,以△A值最大为最优的病毒包被浓度。结果显示,1∶10倍稀释的MHV1包被的ELISA酶标板测定的血清浓度更为接近商品化试剂盒,与其他稀释倍数组(0、1∶5、1∶20、1∶40)包被的ELISA酶标板测定的血清浓度差异显著(P<0.05)。故本实验采用1∶10倍的病毒稀释浓度为最优的病毒包被浓度(即病毒包被浓度为10-7.73/0.1 mL TCID50,抗原蛋白浓度为4.0 μg/mL)。
2.3.2待检血清工作浓度的优化:将待检血清做0、1∶10、1∶20、1∶40、1∶80、1∶160稀释,同时设3个阴性和阳性对照(不稀释),每组3个重复,100 μL/孔,孵育时间均为60 min,测定不同稀释浓度的待检血清的△A值,以△A值最大为待检血清工作浓度。结果显示,1∶40倍稀释血清的浓度更为接近商品化试剂盒,与其它血清稀释组(0、1∶10、1∶20、1∶80、1∶160)测定的结果差异显著(P<0.05),故本实验采用1∶40稀释的待检血清浓度为最优待检血清浓度。
2.3.3HRP-羊抗鼠酶标抗体工作浓度的优化:将HRP-羊抗鼠酶标抗体1∶100、1∶200、1∶500、1∶1 000、1∶2 000、1∶4 000稀释,100 μL/孔,每组3个重复,测定待检血清的△A值,以△A值最大为酶标抗体工作浓度,孵育时间均为1 h。结果显示,随着HRP-羊抗鼠酶标抗体浓度降低,各组抗体滴度呈缓慢下降的趋势,1∶4 000稀释的酶标抗体测定的血清浓度更为接近商品化试剂盒,故本实验采用1∶4 000酶标抗体稀释浓度为最优酶标抗体浓度。
2.3.4显色时间的优化:每孔加100 μL配好的OPD显色液[0.2 mol/L Na2HPO42.57 mL,0.1 mol/L柠檬酸2.43 mL,蒸馏水5 mL,邻苯二胺(OPD)4 mg,3%H2O2150 μL],37 ℃显色时间分别设为10 min、20 min、40 min、60 min和90 min,每组设3个重复,显色结束后加入50 μL终止液(0.5 mol/L H2SO4)终止反应;取波长492 nm和405 nm,读取各孔A值,结果以A492减A405(△A)表示,以△A值最大为最佳显色时间。结果显示,显色10 min内,血清抗体呈现显著升高的趋势,随后抗体增长平缓,各显色时间组之间无显著差异(P>0.05),因此本实验采用的最优显色时间为10 min。
综上所述,适合本实验室的最佳ELISA反应条件及步骤如下:
浓缩后的病毒液用0.05 mol/L碳酸盐缓冲液(pH 9.6)稀释至抗原蛋白浓度为4.0 μg/mL,每孔加100 μL,4 ℃包被过夜,同时做只加包被液的孔作为空白对照;弃去病毒液,每孔加入250 μL封闭液(pH 9.6,0.05 mol/L碳酸盐缓冲液含2.0% BSA),4 ℃孵育过夜;将待检血清做1∶40倍稀释,每孔100 μL,振荡混匀,37 ℃孵育1 h;PBST(pH 7.4)重复洗涤5次后甩干液体;每孔加入100 μL HRP标记的羊抗鼠酶标抗体(1∶4 000稀释),37 ℃孵育1 h;弃去孔内液体,重复上述洗涤步骤;每孔加100 μL OPD显色液显色10 min,加入50 μL终止液;取波长492 nm和405 nm,读取各孔A值,结果以A492减A405(△A)表示。
2.4 血清样品的检测及判定标准的确定
使用本研究制备的诊断试剂,按照优化好的ELISA反应条件与步骤,随机选取本实验室保存的小鼠血清165份,用于进行抗体浓度的测定,同时用商品化试剂盒测定的血清抗体浓度作为对照。阳性对照△A值≥0.2,阴性对照△A值<0.2,同时满足以上两个条件则实验成立;否则不成立。以已知阳性临界血清测量值为参考,计算出阴性血清样品平均△A值和标准差SD,且每份阴性样品△A值是通过三次ELISA测定求的平均值,进而计算出阳性判定临界值(cut-off value):临界值=阴性样品的平均△A值+3SD。结果如表1所示。
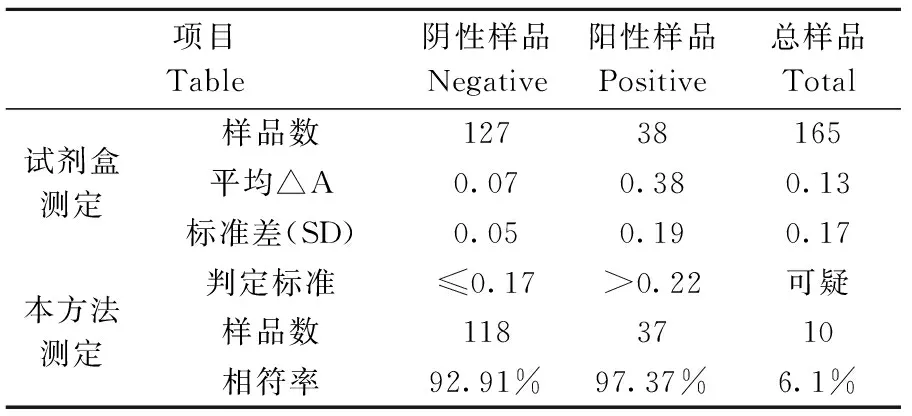
表1 小鼠MHV血清抗体检测Table 1 MHV antibody of mouse serum
2.5 检测体系的质量控制
使用本研究制备的诊断试剂,按照优化好的ELISA反应条件与步骤,分别检测MHV、SV、PVM、Reo3、MVM和Ect阳性血清,每个样品重复检测3次,同时做阴性和阳性对照孔,分别计算每份血清的△A均值,从而确定本试剂盒的特异性。结果如表2所示,只有MHV阳性血清的△A值远大于0.22判定为阳性,ECT和SV阳性血清△A值虽处于可疑值范围之内,考虑的阴性血清△A值较高(>0.1),可视为血清非特异性结合,PVM、Reo3、MVM阳性血清△A值均低于0.17,判定为阴性,表明该方法具有良好的特异性。

表2 特异性检测Table 2 Specific tests
重复性试验:用本试剂盒将5份MHV阳性样品,2份MHV阴性样品,每个样品重复检测3次,分别计算每份血清的△A均值(average value,AV)、标准差(standard deviation,SD)、变异系数(the coefficient of variation,CV)。结果如表3所示,各组血清的重复性均良好(CV值<10%)。

表3 批次内重复性检测Table 3 Batch of repeatability tests
同时用不同批次包被的酶标板进行批次间重复性检验,结果如表4所示,阴性血清变异系数偏大(10%),但也在酶标仪测定误差范围之内,其余各组血清的重复性均良好(CV值<10%)。
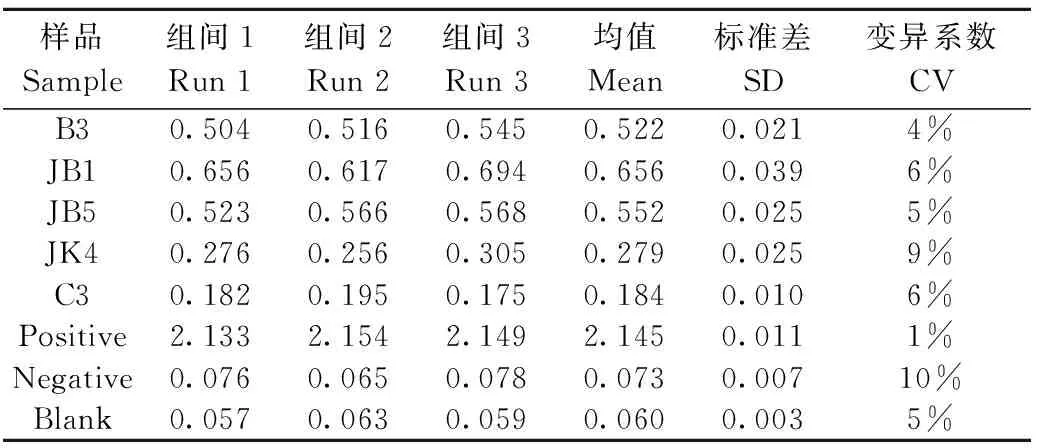
表4 批次间重复性检测Table 4 Batch to batch repeatability tests
稳定性试验:为评价所建立的ELISA检测方法的稳定性,将包被好的ELISA酶标板分别置于37 ℃、25 ℃、4℃环境,每天取出1块,连续测定7 d,观察其在405 nm和492 nm波长处其△A值的变化。结果如表5所示,孵育环境(37 ℃)和室温环境(25 ℃),无论是样品血清(B3)还是阴阳性对照血清,随着时间的延长(7 d),MHV血清抗体水平呈缓慢下降的趋势且批次间△A值变异系数偏大(>10%),不适合试剂盒的长期储存;冷藏环境下(4 ℃),MHV血清抗体水平各批次间△A值变异系数最小(<10%),适合于长期储存。
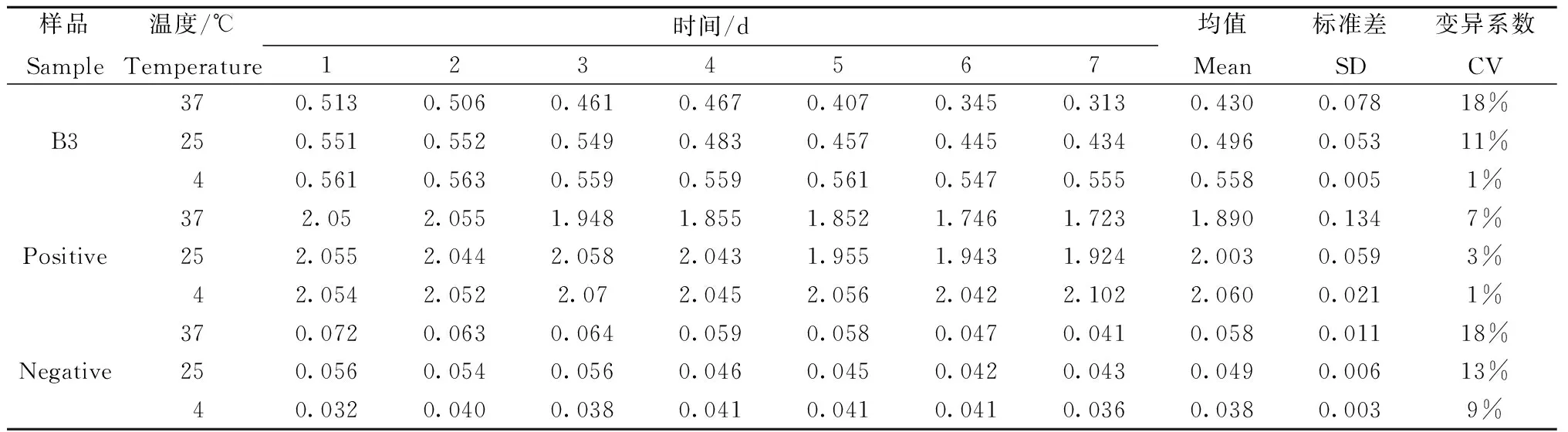
表5 稳定性检测Table 5 stability tests
灵敏度试验:将MHV阳性血清做倍比稀释,检测本研究制备的试剂盒所能检测出的最低检出量。结果如表6所示,阳性对照(2.113)在稀释倍数大于1∶4 000时△A值小于0.22,临床阳性血清B3(0.603)则在稀释倍数大于1∶1 000时△A值小于0.22,具有一定的灵敏性,这与临床血清本身MHV抗体水平偏低有关。
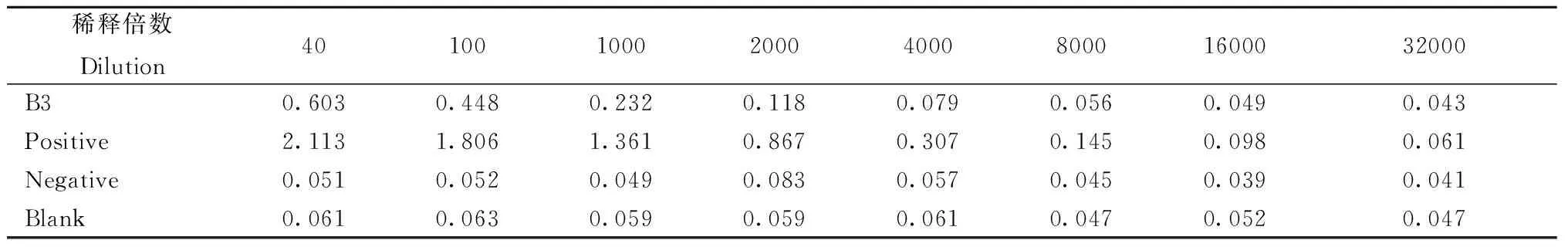
表6 灵敏性检测Table 6 Sensitivity tests
2.6 性能评价与初步应用
用本研究制备的ELISA诊断试剂盒与商品化MHV ELISA试剂盒平行检测165份小鼠血清样品,评价本研究制备的试剂盒与商品化试剂盒的符合率。阴阳性判定结果如表1所示,阴性样品符合率为92.91%(118/127),阳性样品符合率为97.37%(37/38)不符合样品为10份,主要分布在邻近商品化试剂盒判定标准附近的血清(0.15~0.22),需进一步复检,两次结果均为可疑则可判定为阳性。
3 讨论
由于MHV有多个毒株亚型,且不同地区之间MHV流行情况不一样,所选用的毒株也各不相同。在研制试剂盒时,选用哪些毒株作为检测用的抗原将直接影响到检测结果的特异性和敏感性,需要根据不同组织型的MHV选择不同的包被抗原进行检测[15]。在实际应用中通常需要用不同的诊断试剂对同一份样品反复进行验证,才能确定其准确结果。或者采用同时包被多种抗原类型来达到一次操作能够检测多种病毒的目的,但由于不同抗原之间的干扰及各地区实际感染现状的差异,结果准确性较单一抗原有所降低,容易造成误判,使整个实验动物群体存在隐形感染MHV的风险[16-17]。为此,在全面对本地区实验小鼠进行流行病学性调查的基础上,我们从美国ATCC购买了我国主要流行的3株小鼠肝炎病毒MHV1(ATCC VR-261)、MHV-JHM(ATCC VR-765)、MHV-A59(ATCC VR-764)作为不同的ELISA包被抗原,用于本地小鼠MHV阳性临床血清抗体的检测。
在用L929细胞进行病毒扩增培养时我们发现,L929细胞感染MHV-JHM病毒株36 h即可观察到细胞病变,48~60 h病变最为明显,72 h后细胞逐渐崩解;MHV-A59和MHV1毒株则于感染48 h以后出现细胞病变,病变明显时间段为60~72 h,随后细胞逐渐崩解(见图1),分别在感染96 h后收取3种病毒的细胞培养物进行病毒滴度测定(图2),发现3种病毒的最佳接种浓度(病毒稀释倍数)均不相同,MHV1(1∶5稀释)、MHV-A59(1∶10稀释)、MHV-JHM(1∶20稀释),这说明病毒的扩增有一定的浓度要求。选取最佳接种剂量的小鼠肝炎病毒可以在感染细胞2~3 d的时间内出现病毒的快速增长,病毒的培养较为稳定,在接种后72 h收获病毒,符合试剂盒病毒生产的需要。
研究表明MHV-A59与其它毒株之间有交叉反应,是一个有广泛反应性的抗原,曾作为ELISA检测的包被抗原,我国MHV抗体酶标检测试剂盒主要使用三价抗原,结合模式一般为经典毒株与新分离毒株相结合的组合,检出率也明显高于单抗原,阳性率的差别主要表现在对弱阳性样品或不确定样品的阳性检出率上[18-21]。本研究用不同MHV病毒株抗原包被,检测本地小鼠MHV阳性临床血清抗体,结果发现相比于商品化试剂盒测定的血清抗体浓度,MHV1抗原包被的ELISA酶标板测定的血清阳性检出率更为接近商品化试剂盒,与A59和JHM包被的ELISA酶标板测定的结果差异显著(P<0.05),MHV-A59检测结果只有参考值的一半,MHV-JHM无论阴阳性血清均无明显反应,这说明本地小鼠MHV阳性临床血清主要是MHV1和MHV-A59感染引起,这与前期的病毒核酸测序鉴定结果相符。另一方面,该商品化试剂盒的参考阳性血清检测结果MHV-A59和MHV-JHM抗体水平最高,反而MHV1的检测结果最低,这说明该试剂盒抗原包被时虽然都含有以上3种病毒类型,但以MHV-A59和MHV-JHM病毒为主,MHV1次之,这与本地区流行的病毒株有很大的出入,也可能是该试剂盒在使用过程中ELISA抗体检测结果和IFA抗体检测结果有着一定的差异的原因之一。
随后,本研究选取了MHV1作为适合本地区的包被抗原类型并优化ELISA反应体系,以期获得一种稳定、精密、检测准确的MHV血清抗体ELISA诊断方法,可以用于MHV的日常病原学监测。通过对大量临床小鼠血清样本(165)的测试,小鼠的MHV阴性血清检测数据多控制在0.07左右,而不同实验条件对此标准会有一定影响,例如显色时间和显色液类型,因此我们采取阴性参比血清的检测结果加2SD(阴性ΔA+2SD,0.17)作为阴性判定标准。以此标准对大量样品做多次检测,检测的准确性达到92.91%(118/127),因此在检测过程中低于此标准的样品可做阴性判定。而高于此标准的血清样品,仍有少量不能用IFA和Western blot等方法做阳性判定,因此在本试剂盒中增设了阳性临界浓度血清判定指标阴性ΔA+3SD(0.22),当ELISA检测结果高于此标准时,使用IFA和Western blot等方法可对此样品做出一致的判断。而低于此标准高于阴性判定标准的样品(0.15~0.22),其来源动物的种群需要做进一步的检测来确认。

