小鼠巨细胞病毒荧光定量PCR检测方法的建立及应用*
李晓波 付 瑞 王 吉 王淑菁 王莎莎 李 威 秦 骁 黄宗文 贺争鸣 岳秉飞
(中国食品药品检定研究院实验动物资源研究所,北京 102629)
小鼠巨细胞病毒(Mouse Cytomegalovirus, MCMV)分类上属疱疹病毒科,乙型疱疹病毒亚科,具有严格的种属特异性,野生小鼠是该病毒的主要来源,主要通过动物亲密接触传播,也可经胎盘垂直传播[1]。
自然感染小鼠多呈亚临床过程,但病毒会潜伏在免疫功能健全动物体内[2],胎鼠或免疫缺陷动物感染会发生严重疾病[3],如会改变小鼠呼吸系统、血液系统内环境的平衡,从而对细菌和病毒更加易感,更重要的是会抑制动物的免疫应答,抑制抗体产生及Tc细胞的功能[4]。欧洲实验动物联合会(FELASA)、Charles river实验室及Harlan实验室等均已将MCMV列为实验小鼠日常监测项目[5],早在八九十年代就有学者建议将MCMV作为SPF动物应排除的病原体[6],目前我国的实验动物国家标准对MCMV的检测没有规定。本研究建立的MCMV特异的TaqMan探针实时荧光定量PCR(FQ-PCR)方法,具有高灵敏度和特异性的特点,为实验小鼠MCMV日常监测及动物源性生物制品中MCMV的检测提供了技术参考。
1 材料与方法
1.1 试剂
FQ-PCR引物探针由ABI公司合成,TaqMan Universal PCR Master Mix为ABI产品;病毒核酸提取试剂盒购自Takara公司。
1.2 病毒株和样品
小鼠巨细胞病毒(MCMV)smith株(103.75 TCID50/0.1 mL),大鼠巨细胞病毒(RCMV)购自ATCC,编号VR-991;猴巨细胞病毒(SCMV)、人单纯疱疹病毒sm44株(HSV)、伪狂犬病毒(PRV)及猫疱疹病毒I型(FHV-1)均为本室保存;2018年14家单位送检的SPF级小鼠抗凝血样品307份,清洁级小鼠抗凝血102份,具体见表1。

表1 临床样本信息Table 1 Clinical samples information
1.3 方法
1.3.1引物设计:选择小鼠巨细胞病毒Smith株(Genbank:KY348373)DNA polymerase基因保守序列设计引物和探针,序列见表2。

表2 MCMV FQ-PCR引物探针信息Table 2 Primers and probes for MCMV FQ-PCR
1.3.2病毒核酸的提取:小鼠巨细胞病毒、大鼠巨细胞病毒、猴巨细胞病毒、人单纯疱疹病毒sm44株、伪狂犬病毒及猫疱疹病毒I型,各取0.2 mL病毒液按试剂盒说明提取DNA,最后用150 μL灭菌水洗脱。
1.3.3质粒标准品的制备:由擎科生物合成MCMV(Genbank:KY348373)80691~80880 bp的DNA序列,转入pClone007 Blunt Vector载体,构建质粒标准品pClone007-MCMVp,经测定其浓度为4.7×1010copies/μL。
1.3.4MCMV FQ-PCR扩增体系及标准曲线的建立:对引物、探针浓度、退火温度等条件进行优化,优化后的反应体系为:TaqMan Universal PCR Master Mix 10 μL,上下游引物(10 μmol/L)各0.4 μL,探针(10 μmol/L)0.2 μL,DNA模板1 μL,灭菌ddH2O补足至终体积20 μL。反应程序为:50 ℃ 2min;95 ℃ 10 min;95 ℃ 15 s,60 ℃ 1min,40个循环。将质粒标准品pClone007-MCMVp 10倍系列稀释为109~100copies/μL,以其为模板,按上述反应体系和反应条件进行PCR扩增,每个稀释度做3 个平行,选取线性较好的7 个稀释度绘制标准曲线。
1.3.5MCMV FQ-PCR方法的敏感性验证:
1.3.5.1 以4.7×109~4.7×100copies/μL系列稀释的质粒标准品为模板,用优化好的反应条件进行检测,每个稀释度做3个平行,验证方法的敏感性。
1.3.5.2 与其他PCR方法敏感性比较:将步骤1.3.2提取的MCMV核酸10-1至10-8系列稀释,使用本方法、文献报道的常规PCR法、FQ-PCR方法分别检测[7],比较各方法的灵敏性。
1.3.6MCMV FQ-PCR方法特异性验证:用建立的荧光定量PCR法检测小鼠巨细胞病毒,大鼠巨细胞病毒,猴巨细胞病毒,人单纯疱疹病毒,伪狂犬病毒及猫疱疹病毒I型等疱疹病毒科病毒的核酸,验证方法的特异性。
1.3.7MCMV FQ-PCR方法的重复性和稳定性验证:应用优化好的的反应条件,以不同浓度的质粒标准品(4.7×106,4.7×104和4.7×102copies/μL)为模板进行FQ-PCR扩增,每个浓度设置3个重复,同时选择不同的3个时间点检测,计算组内和组间Ct值均值,标准差及变异系数。
1.3.8MCMV FQ-PCR方法的应用
1.3.8.1 模拟感染样本的检测:MCMV病毒液(103.75 TCID50/0.1 mL)分别按10-1~10-8的比例掺入MCMV阴性小鼠抗凝血,模拟病毒感染样品,每个稀释度做3个平行,各取200 μL,按DNA提取试剂盒说明提取核酸,用MCMV FQ-PCR方法进行检测。
1.3.8.2 临床样本的检测:应用建立的MCMV FQ-PCR方法检测2018年14个实验动物生产和使用单位送检的小鼠抗凝血样品,包括SPF级小鼠血清307份,清洁级小鼠102份(表1)。
2 结果
2.1 MCMV荧光定量PCR扩增体系及标准曲线的建立
用优化好的体系扩增108~102copies/μL的标准质粒,各稀释度扩增曲线间距均匀,标准曲线Slope为-3.418(在-3~-3.5之间),R2值为0.999(>0.99),扩增效率为96.137%(90%~105%之间)(图1、2)。
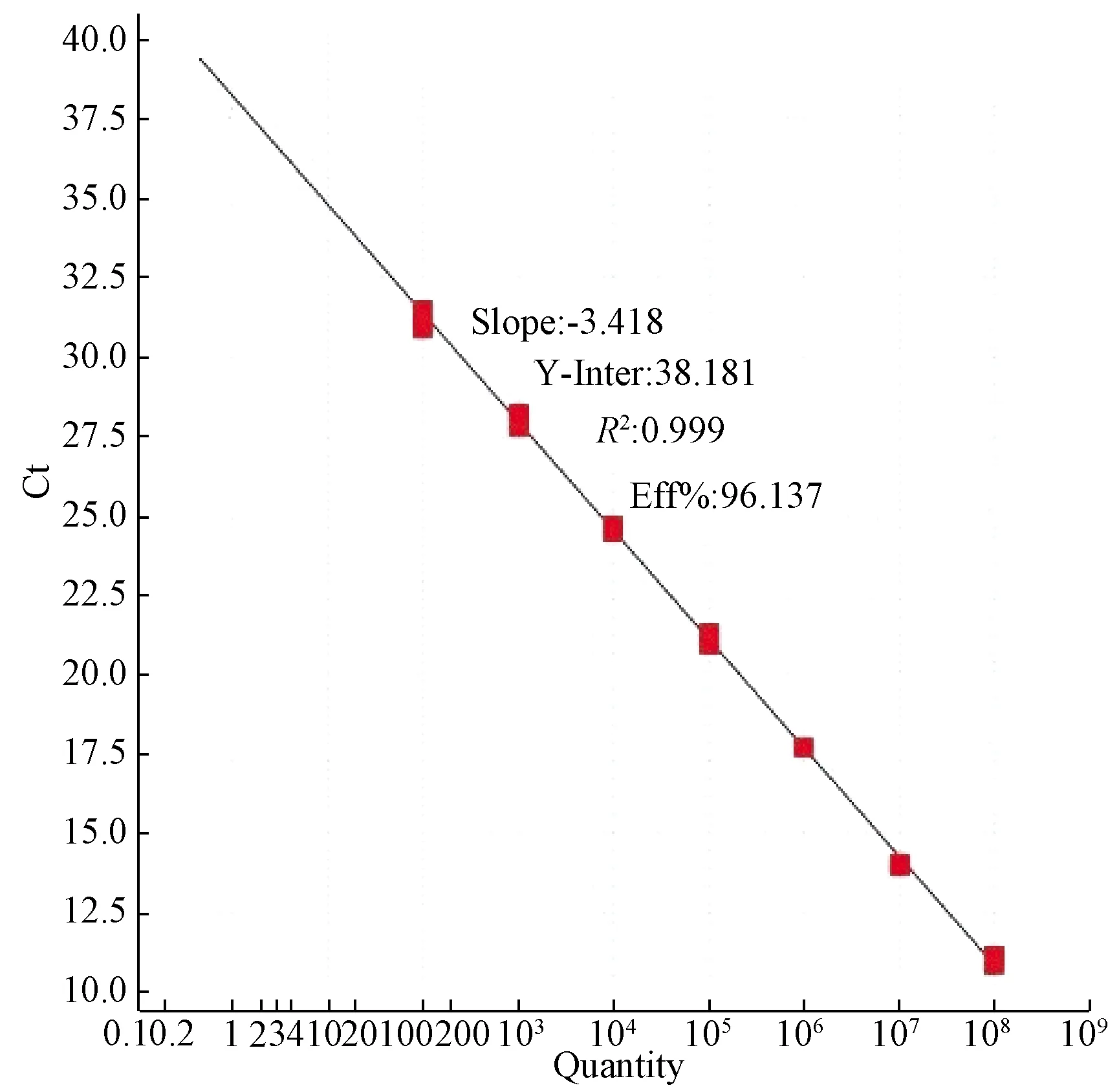
图1 MCMV荧光定量PCR标准曲线Fig.1 MCMV FQ-PCR standard curve

图2 MCMV荧光定量PCR方法扩增曲线Fig.2 MCMV FQ-PCR amplification curve
2.2 MCMV FQ-PCR方法的敏感性验证
如图3所示,4.7×109~4.7×101copies/μL各稀释度的质粒标准品均出现S型扩增曲线,而4.7×100copies/μL的3个平行实验有1个未出现S型扩增曲线,说明本方法最低可定量检测到47copies/μL的样品。用MCMV FQ-PCR方法和常规PCR方法检测同样的10-1至10-8系列稀释的MCMV核酸样品,由图4可见,MCMV FQ-PCR方法最低可检测到10-4稀释度的MCMV核酸,常规PCR最低可检测到10-2稀释度,表明MCMV FQ-PCR方法敏感性比常规PCR方法高两个数量级;用建立的MCMV FQ-PCR方法与文献报道的FQ-PCR方法检测相同的10-1至10-8系列稀释的MCMV核酸样品,每个稀释度做3个平行,两种方法检测到的最大稀释度均为10-4,但本方法每个稀释度的Ct值均值均低于文献方法(表3),说明本方法的敏感性高于文献方法。
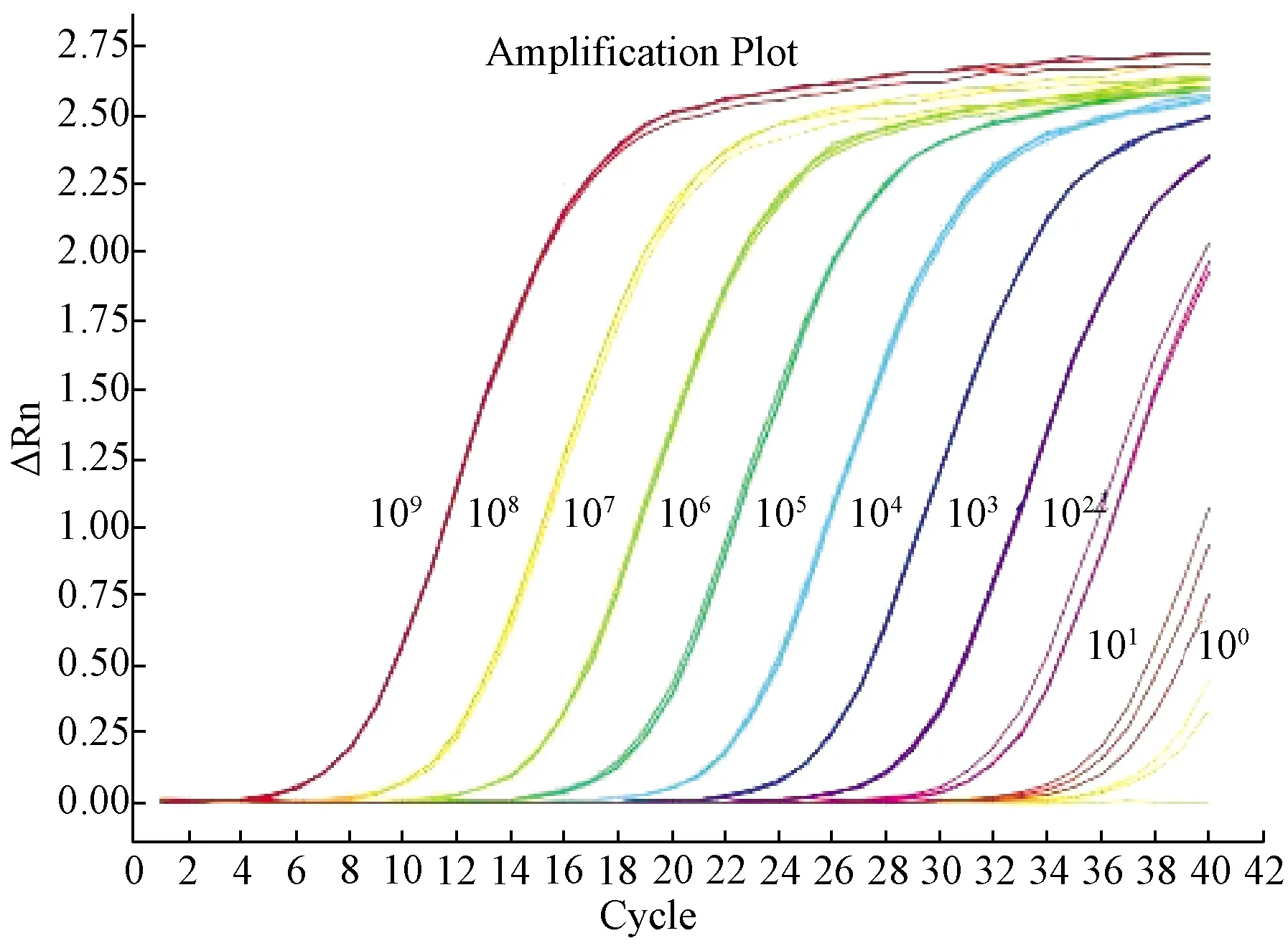
图3 MCMV荧光定量PCR方法敏感性验证扩增曲线Fig.3 MCMV FQ-PCR sensitivity test amplification curve
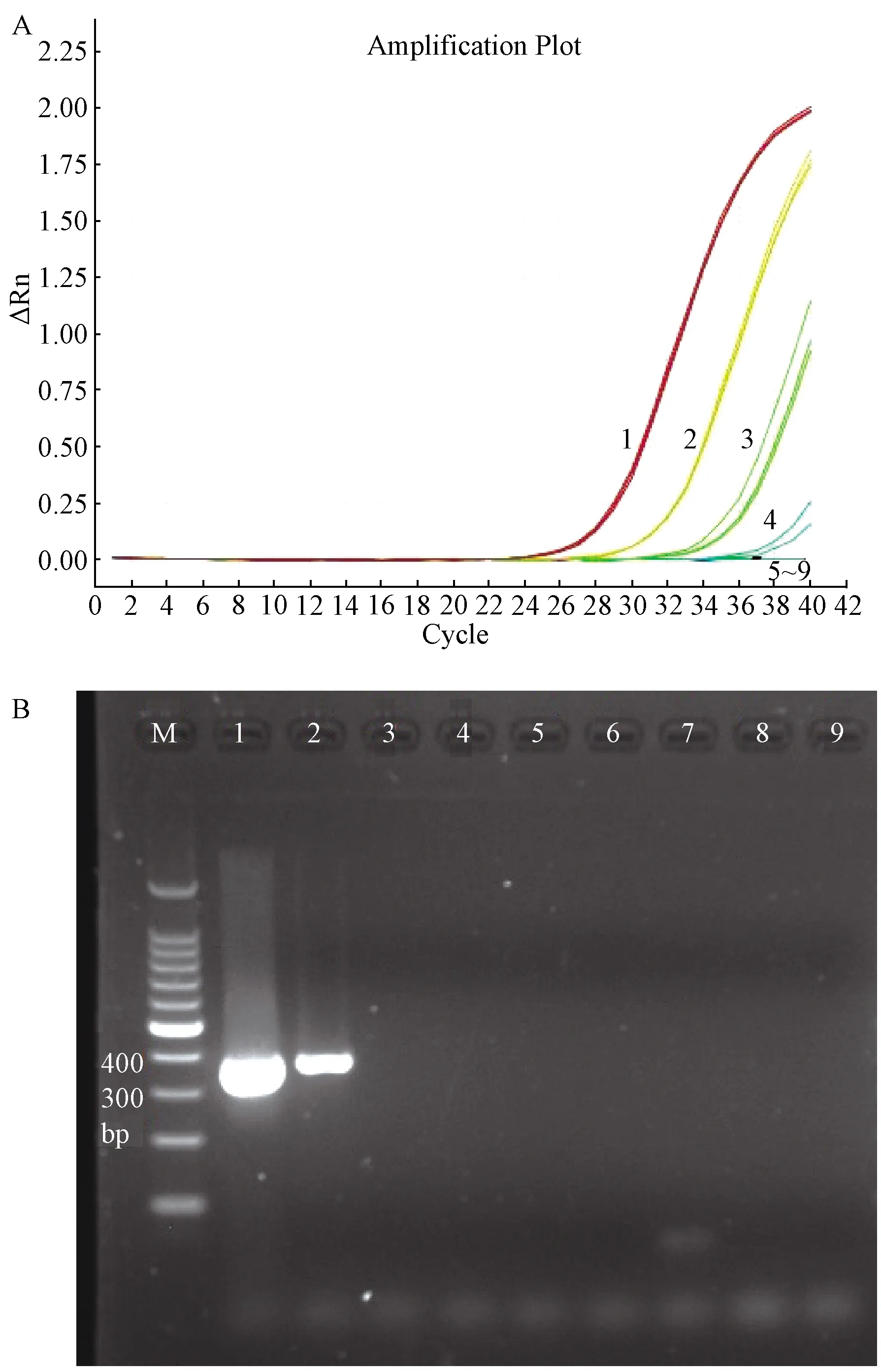
图4 MCMV荧光定量PCR方法(A)与常规PCR方法(B)敏感性比较注:M:100 bp DNA Marker;1~8:10-1至10-8系列稀释的MCMV核酸;9:阴性对照Fig.4 Comparison of sensitivity between MCMV FQ-PCR (A) and conventional PCR (B)Note: M: 100 bp DNA Marker;1-8:10-1 to 10-8 serially diluted MCMV nucleic acids; 9:Negative control
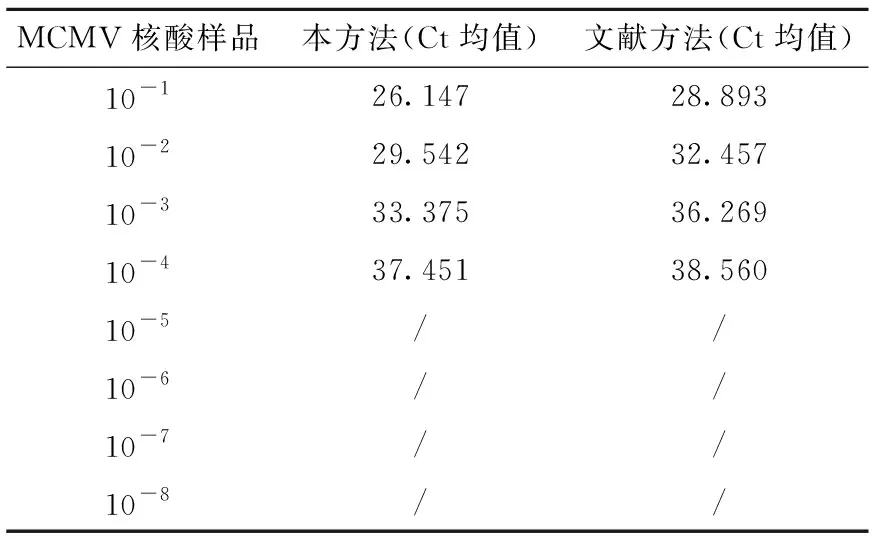
表3 两种荧光定量PCR方法敏感性比较Table 3 Comparison of sensitivity between two fluorescence quantitative PCR methods
2.3 方法的特异性验证
图5显示,当以MCMV为模板时,出现FAM荧光扩增曲线(Ct值为26,对应浓度为7.71×104copies/μL),以大鼠巨细胞病毒,猴巨细胞病毒,人单纯疱疹病毒,伪狂犬病毒及猫疱疹病毒I型为模板均无明显扩增曲线。表明所建立的荧光定量PCR法特异性强,与其他病毒均无交叉反应。

图5 MCMV荧光定量PCR方法特异性验证扩增曲线注:1~7分别为MCMV、RCMV、SCMV、HSV、PRV、FHV-1、阴性对照Fig.5 MCMV FQ-PCR specificity test amplification curveNote: 1-7: MCMV、RCMV、SCMV、HSV、PRV、FHV-1 and negative control
2.4 MCMV FQ-PCR方法的重复性和稳定性验证
用建立的FQ-PCR方法检测4.7×106,4.7×104和4.7×102copies/μL三个浓度的质粒标准品,由表4可见其组内变异系数为0.39%~0.68%,组间变异系数为0.48%~1.01%,方法的重复稳定性良好。
2.5 MCMV FQ-PCR方法的应用
用建立的MCMV FQ-PCR方法检测掺入MCMV(103.75 TCID50/0.1 mL)病毒的小鼠抗凝血样品,10-1~10-3稀释度3个平行均为阳性,其Ct值均值分别为30.566、33.012、36.337,10-4稀释度有2个平行出现扩增曲线,1个平行未出现,10-5~10-8稀释度均为阴性,表明本方法可检测到小鼠抗凝血样品中MCMV的最大稀释度为1∶1000,对应病毒毒力为100.75 TCID50/0.1 mL(图6)。检测2018年送检的307份SPF小鼠及102份清洁级小鼠抗凝血样品,结果均为阴性。
3 讨论
荧光定量PCR方法灵敏度高,耗时少,特异性强,目前已广泛用于病原体的检测[8-9],本研究选取小鼠巨细胞病毒DNA polymerase基因保守序列设计引物和探针,建立了MCMV FQ-PCR检测方法,各稀释度扩增曲线间距均匀,以标准质粒建立标准曲线,Slope为-3.418,相关系数R2值为0.999,扩增效率为96.14%,说明本FQ-PCR方法可实现对MCMV的有效定量。MCMV FQ-PCR在以大鼠巨细胞病毒、猴巨细胞病毒等同类病毒及人单纯疱疹病毒、伪狂犬病毒、猫疱疹病毒I型(FHV-1)等同科病毒为模板时均无扩增,说明方法的特异性良好;敏感性方面最低可检测到47copies/μL的MCMV,比常规PCR方法的敏感性高两个数量级,与已有的FQ-PCR法[7]相比各浓度的Ct值均低于后者,说明本方法的敏感性更高。选取各相差两个数量级的3个浓度的标准质粒做方法的重复性及稳定性验证,组内变异系数小于1.0%,组间变异系数小于1.5%,表明本方法有很好的重复性和稳定性。
MCMV感染小鼠后可分布在血液、唾液腺、肝、脾、肺等组织中[7,10],本研究选取小鼠EDTA抗凝血作为检测样品,根据动物福利的“3R”原则,对方法进行应用时本研究未进行动物感染实验,而是检测了模拟感染样品,即将MCMV按10倍系列稀释掺入小鼠抗凝血样品进行检测,结果10-1~10-3每个稀释度的3个平行实验均为阳性,说明本方法可有效检测到动物血液样品中的MCMV。不同品系小鼠对MCMV的易感性不同,其中BALB/c小鼠对MCMV较易感,而C56BL/6小鼠对MCMV有较强抵抗力[11-13],研究人员对2018年北京地区14家单位送检的409份小鼠血液样品进行检测,其中BALB/c小鼠占大多数,既有SPF级也有清洁级,结果均为阴性,表明现阶段北京地区实验小鼠中MCMV的控制情况良好,与前几年报道的14.94%的感染率相比大幅下降[9],原因可能在于实验小鼠于2001年取消了普通级后,最低等级变为清洁级,要求在屏障环境中饲养,管理水平也相应提高,杜绝了与野生鼠接触的机会,因而感染率得到了有效控制。
鉴于MCMV传播特点及对动物尤其是胎鼠的危害,且目前并未纳入实验动物国家标准,因而在实验小鼠种群中仍存在爆发流行的风险,对MCMV的日常监控不容忽视。本研究建立的MCMV荧光定量PCR方法特异性、重复性和稳定性好,并且有更高的检测灵敏度,适用于实验小鼠及鼠源性制品中MCMV的监测,同时可为实验动物相关标准的制定和补充提供技术参考。

