实验动物雪貂阿留申病病毒核酸检测方法的建立*
赵 鹏 郭 智 佟 巍 向志光
(1. 中国医学科学院医学实验动物研究所,北京 100021)(2. 北京城市学院,北京 100083)
阿留申病病毒(Aleutian disease virus,ADV)属于细小病毒。病毒核酸为单链DNA[1]。该病毒会引发阿留申病(Aleutian disease,AD)又称浆细胞增多症,是一种慢性传染病,感染后表现终生病毒血症,持续性感染,全身淋巴细胞增生,血清γ-球蛋白增多,肾小球性肾炎,动脉炎和肝炎[2]。感染后动物一般会慢性死亡,会对实验的进行产生巨大影响,严重时会导致实验终止。
目前,ADV的检测方法包括如碘凝集实验、对流免疫电泳、火箭电泳、酶联免疫吸附试验、免疫复合物法、间接免疫荧光试验、补体结合试验、胶体金免疫层析技术的血清学检测方法以及PCR、荧光定量PCR、PCR-DPLC、核酸杂交技术、基因芯片技术、环介导等温扩增技术等分子生物学方法[3]。
PCR方法检测ADV,最大的优点是应用范围广,可以对血清学检测方法无法检测的样品进行检测,例如死胎、组织标本,敏感性更强,为粪便、尿液等低病毒样本检测提供了一种新方法[4]。其准确性与特异性远超现在世界公认的对流免疫电泳[5]。
VP2是ADV病毒主要免疫原性抗原,是抗原决定簇的载体,是研究病毒毒力、致病机理等的首选基因[6],所以本实验根据ADV病毒Utah株的VP2基因设计一对引物进行扩增。
1 材料与方法
1.1 材料
1.1.1病毒与细胞株: ADV、小鼠多瘤病毒(Polyoma Virus,POLY)、小鼠细小病毒(Minute virus of mice,MVM)、犬细小病毒(Canine Parvovirus,CPV)、疱疹病毒(Herpes Simplex virus,HSV)、鼠痘病毒(Ectromelia virus,ECT)、仙台病毒(Sendai virus,SV)、小鼠腺病毒(Mouse adenovirus,Mad); CRFK细胞。涉及的病毒及细胞本室保存。
1.1.2引物: 根据Gene Bank提供的ADV病毒Utah株VP2基因设计一对引物,分别是P2S-F:5′-aca cat taa cca agc tga cac a-3′,P2S-R:5′-tca tct tgt act gca tcc cag g-3′。
1.1.3试剂: Taq DNA聚合酶、核酸提取试剂盒、质粒提取试剂盒、琼脂糖凝胶回收试剂盒均购自Takara公司;pCloneEZ-TA-AMP载体购自中美泰和生物技术有限公司;Trans1-T1 Phage Resistant Chemically Competent Cell感受态细胞购自全式金生物技术有限公司。
1.1.4测试样品: 来源于某实验动物繁育机构的新鲜雪貂粪便样品39份。
1.2 方法
1.2.1DNA提取: 参照核酸提取试剂盒说明书提取ADV病毒DNA。
1.2.2目的片段扩增及测序: 病毒DNA扩增条件如下:10×Buffer Solution(Mg2+)3 μL,dNTP Mix 3 μL,上下游引物各1 μL,rTaq DNA聚合酶0.5 μL,模板DNA 1 μL,ddH2O 20.5 μL。94 ℃变性5 min;94 ℃ 30 s、65 ℃ 30 s、72 ℃ 30 s,35个循环;72 ℃延伸5 min。扩增产物通过1.5%琼脂糖凝胶电泳检测,切胶回收目的条带后送测序。
1.2.3特异性: 使用“1.2.2”中的方法对ADV、POLY、MVM、CPV、HSV、ECT、SV和Mad这8种DNA病毒进行检测,测试本引物的特异性。
1.2.4敏感性: 使用重组质粒进行敏感性测试。将目的基因连接到pCloneEZ-TA-AMP克隆载体上并进行感受态细胞转化,转化后的细胞在含有氨苄青霉素的平板上生长8~9 h,挑取菌落在含有氨苄青霉素的LB液体培养基内震荡培养。使用质粒提取试剂盒提取质粒,PCR鉴定,紫外分光光度计测定阳性质粒浓度,根据质粒拷贝数计算公式[7]计算拷贝数。将质粒进行连续10倍梯度稀释,测试PCR最低检测限。
1.2.5样品检测: 雪貂粪便样品进行处理。按1∶10的比例将粪便和DMEM培养基混合震荡,离心12 000 r/min 30 min,取上清液作为样品提取DNA[8]。提取方法按照核酸提取试剂盒说明书中的方法操作。使用“1.2.2”中的方法进行PCR,测试时同时设立环境对照、空白对照、CRFK细胞培养液对照、病毒核酸对照、质粒阳性对照。
2 结果
2.1 扩增及测序结果
通过电泳检测,在500 bp位置上方出现条带,具体见图1。
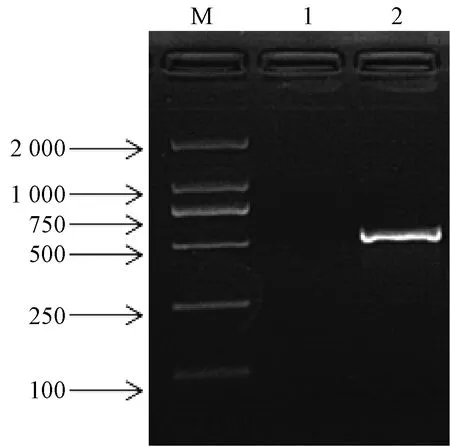
图1 ADV扩增结果注:M:DL2000 DNA marker;1:空白对照;2:ADVFig.1 ADV amplification resultsNote:M: DL2000 DNA marker; 1: blank control; 2: ADV
目的条带测序结果通过NCBI数据库进行Blast比对,结果显示与报道的ADV病毒Utah株VP2基因的核酸序列和氨基酸序列同源性高达99%,片段长度为531 bp。
2.2 特异性
将ADV、POLY、MVM、CPV、HSV、ECTR、SV、Mad的扩增产物进行1.5%琼脂糖凝胶电泳检测,只有ADV得到单一目的条带,长度为531 bp,POLY、MVM、CPV、HSV、ECT、SV、Mad均没有扩增出目的条带,结果见表1。

表1 引物特异性测试结果Table 1 primer specific test results
2.3 敏感性
测试质粒浓度为23.485ng/μL,通过计算得出质粒拷贝数为9.06×109copy/μL。经连续10倍梯度稀释进行PCR检测,在10-8稀释度仍可检测出ADV阳性条带,确定此方法的最低检出限在90.6 copy/μL,结果见图2。

图2 方法敏感性结果注:M:DL2000 DNA marker;1:空白对照;2:10-6;3:10-7;4:10-8;5:10-9;6:10-10;7:10-11;8:10-12;9:10-13;10:10-14;11:10-15;12:10-16Fig.2 method sensitivity resultsNote:M: DL2000 DNA marker; 1: blank control; 2: 10-6; 3: 10-7;4: 10-8; 5: 10-9; 6: 10-10; 7: 10-11;8: 10- 12;9:10-13;10:10-14;11:10-15;12:10-16
2.4 雪貂样品检测结果
在环境对照、空白对照、CRFK细胞培养液对照、病毒核酸对照、质粒阳性对照成立的情况下,39份雪貂粪便样品均未检测出ADV,检测结果具体见表2。

表2 39份雪貂粪便样品ADV病毒核酸检测结果Table 2 Results of detection of ADV virus nucleic acid in 39 samples of ferrets
3 讨论
雪貂作为实验动物目前逐渐广泛用于生物医学研究。我国对雪貂实验动物化开始时间较晚,因此对雪貂进行实验动物质量控制具有重要意义。
阿留申病毒是实验动物雪貂必须排查的病原。通过建立的PCR检测方法,可以直接、快速检测出雪貂是否携带ADV,以此来预防和控制疾病扩散起重要作用。本实验建立的PCR检测方法具有特异性强、敏感性高的特点,可以作为ADV的一般检测方法使用。
PCR方法作为一种较为敏感的病原检测方法,可以对动物病原携带情况进行评估。虽然ADV在自然界广泛存在,但使用本实验建立的PCR方法并未在实验雪貂粪便样品中检出阳性。这可以说明,该雪貂动物群体ADV病毒无流行状况。全面评价动物的微生物质量仍需结合血清学检测结果进行。

