卵巢生长性畸胎瘤综合征一例并文献复习
姚迎春,王玲,韩丽英
生长性畸胎瘤综合征(growing teratoma syndrome,GTS)是未成熟畸胎瘤或混合性恶性生殖细胞肿瘤化疗中或化疗后的一种合并症。Logothetis等[1]于1982年首次提出GTS这一概念,用来描述6例患者[其中睾丸恶性生殖细胞肿瘤5例,卵巢未成熟畸胎瘤(immature teratoma,IT)1例]的疾病现象,并指出经适当的化疗,肿瘤标志物正常后出现良性畸胎瘤的转移,腹膜后是卵巢GTS最常见的转移部位,其他位置有骨盆、纵隔、肺、淋巴结、大脑和肝[2]。卵巢GTS少见,发病率低于睾丸GTS的1.9%~7.6%[3]。国内文献多为个案报道。本文报道1例卵巢GTS,结合相关文献,从病因、诊治及预后等方面提高认识,以避免误诊、误治。
1 病例报告
患者 女,37岁,孕2产2,因自觉下腹部包块20 d,于2010年2月22日就诊于本院妇科。20 d前无明显诱因自觉下腹包块,伴下腹坠胀感,偶有尿频。既往体健,月经规律,否认家族遗传病史。妇科查体:左附件区可触及大小约10 cm×6 cm质硬包块。妇科超声提示:子宫上方见9.1 cm×5.8 cm的无回声,形态规则,边界清,内见3.8 cm×2.6 cm的不均质低回声,其内未见明显血流信号。肿瘤标志物均在正常范围内。行腹腔镜探查术,术中见:盆腔包块来源左侧卵巢,大小约10 cm×8 cm,囊实性,表面光滑,壁薄、完整。右侧卵巢囊肿约4 cm×4 cm,表面光滑。行双侧卵巢囊肿剥除术,完整取出,左侧卵巢囊腔内壁可见一大小约4 cm×4 cm的菜花样赘生物;右侧卵巢囊肿内见黄色油脂样液体、毛发,囊壁内未见赘生物,考虑右侧卵巢为成熟畸胎瘤。左侧卵巢囊肿送检快速病理:肿物大部分为成熟成分,小部分见不典型的神经管样结构,考虑为不成熟畸胎瘤Ⅰ级。考虑患者较年轻且有生育要求以及术中快速冰冻切片可能与术后病理结果不符,与家属沟通后行左侧附件切除术。术后病理回报:左侧卵巢囊肿病理同前,左侧附件送检卵巢组织内见黄体出血,未见肿瘤成分,输卵管有炎细胞浸润。右侧卵巢肿物成熟性囊性畸胎瘤。诊断为左侧卵巢不成熟畸胎瘤Ⅰ期、右侧卵巢成熟畸胎瘤。建议继续行保留生育功能的全面分期手术或化疗,患者及家属拒绝再次手术,要求化疗。术后第8天开始化疗,方案为:顺铂+依托泊苷腹腔灌注,共3个周期,间隔21 d。后定期随访2年未见复发。
患者因腹痛、腹胀6个月,发现右上腹肿物3个月,于2018年7月23日于我院普外科住院。全腹CT提示:右上腹腔肝下缘区囊实性团块影,内可见分隔及多发类圆形钙化影,最大横截面约62 mm×48 mm,CT值27~55 HU,边界清,盆腔积液。查癌胚抗原(CEA)、甲胎蛋白(AFP)、糖类抗原199(CA199)在正常范围内。行腹腔镜检查术,术中于肝下见一囊实性肿物,与肝脏及大网膜致密粘连,行肝下肿物剥除术,肝下肿物送检快速病理。同时探查盆腔,右侧卵巢见大小约3 cm×3 cm的囊性肿物,表面光滑。邀请妇科大夫台上会诊行右侧卵巢囊肿剥除术,剥离过程中见有黄色油脂样液体流出,完整取出囊壁,未见明显赘生物。考虑右侧卵巢成熟性畸胎瘤。术中快速病理回报:组织内见黏液腺体,鳞状上皮、软骨组织等,诊断为成熟性囊性畸胎瘤[见图1、图2(封三)]。与家属沟通建议行右侧附件切除术,患者家属拒绝,术终。术后病理:腹腔肿物病理同前,右侧卵巢肿物符合成熟性囊性畸胎瘤。术后第8天出院,术后随访12个月,盆腹腔超声未见复发,目前仍在随访中。
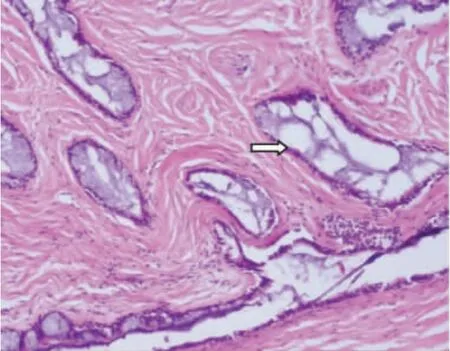
图1 术后病理结果 (HE染色×100)

图2 术后病理结果 (HE染色×40)
2 讨论
2.1 病因与诊断 目前该病病因尚不明确,有以下几种假说:①化疗可能选择性地灭活不成熟成分,延长疾病的病程,从而使良性成分进一步生长[4]。②化疗可改变细胞动力学,使其从全能的恶性生殖细胞向良性组织转变,即“化疗逆转”[5]。③Hong等[6]通过畸胎瘤小鼠模型的实验,提出恶性细胞有内在的和自发向良性组织转化的倾向。④Willis等[7]还提出了成熟畸胎瘤是由原发性未成熟畸胎瘤转移的理论。
GTS的发生可能与以下因素有关。原发性不成熟肿瘤中存在成熟畸胎瘤成分、初始手术不全面、转移性疾病对化疗无反应导致GTS发生的风险增加[4]。Zagamé 等[8]也指出原发性腹膜受累和神经外胚层肿瘤的存在是GTS发生的重要危险因素。有研究认为腹膜胶质瘤病(gliomatosis peritonei,GP)作为卵巢GTS的一种特殊实体,是否与复发有关有待进一步研究[9]。有学者提出GP可作为卵巢IT患者的预后因素,但这缺乏大数据的分析支持[10]。该患者初次手术病理成分中存在成熟畸胎瘤的成分,且没有进行全面分期手术,因此存在GTS发病风险高。
目前采用以下诊断标准:①肿瘤标志物正常化;②化疗期间或化疗结束后,影像学表现为肿瘤的大小或数目的增加或两者同时增加;③既往有未成熟畸胎瘤或睾丸非精原型生殖细胞瘤明确诊断病史,再次手术切除的标本中只存在成熟的畸胎瘤成分[1]。结合该患者病史及术前辅助检查,怀疑本病的可能性大,结合术后病理结果,明确临床诊断。
2.2 辅助检查 定期影像学检查是早期诊断和治疗的关键,然而仅根据CT/PET-CT结果常无法区分恶性肿瘤复发和GTS。Panda等[11]认为放射科医生要意识到GTS的病灶在CT扫描时出现的脂肪、钙化或囊性改变等成熟成分表现,从而为临床提出正确的诊断建议。在生殖细胞肿瘤中,相当一部分肿瘤的AFP水平会有明显升高,CA125、CA199、CEA和HE4等肿瘤标志物联合检测,对于鉴定卵巢IT和成熟畸胎瘤具有重要意义。恶性肿瘤的随访中,肿瘤标志物的升高通常提示肿瘤复发或转移,但在GTS中肿瘤复发与肿瘤标志物表达升高可能并非完全同步[12]。Li等[13]报道1例卵巢GTS患者,10年后发现腹腔包块,伴肝、脾、盆、腹腔广泛转移,肿瘤标志物增高,但术后病理为成熟性畸胎瘤。本例患者中两次术前肿瘤标志物均无明显升高。因此,应结合影像学检查和血清学综合分析。而GTS确诊主要依靠组织学检查,成熟畸胎瘤可含外、中、内三胚层组织,三个胚层均分化成熟,而未成熟畸胎瘤含2~3胚层,由分化不成熟胚胎组织构成,主要为原始神经组织。可术中送检快速病理,明确手术范围,避免误诊、误治。
2.3 治疗与预后 GTS虽然是良性肿瘤,但其具有潜在的恶性生物学行为,如增长、蔓延,并可能压迫周围组织、脏器致其坏死、功能衰竭,严重者危及生命。此外,多达3%~5%的GTS病例可发生恶性转化[4]。目前尚无针对GTS的标准化治疗方案,因为GTS对化疗和放疗不敏感,早期手术彻底切除是治疗的首选方式。GTS部分切除患者的复发率为72%~83%,而完全切除患者的复发率为0~4%[14]。早期完整切除术后的5年生存率为89%~90%[15]。Matsuoka等[15]报道1例纵隔非精原型生殖细胞瘤化疗期间表现GTS,术中病灶未能全部切除,再次术后病理诊断为血管肉瘤,术后全身状况不佳,未能化疗,死于呼吸衰竭。因此,发现GTS后应尽早手术完整切除治疗,这对整体预后至关重要。
卵巢IT首次术后应及时给予化疗。根据2019年美国国立综合癌症网络(NCCN)临床指南建议卵巢IT标准化疗方案为:博来霉素+依托泊苷+顺铂(BEP)[16]。而对于卵巢GTS术后是否需要化疗,仍存在争议。畸胎瘤成熟成分对化疗药并不敏感,因此多数研究认为二次切除术后无需化疗,但也有学者持保守意见。Yu等[17]对10例卵巢畸胎瘤恶变伴腹膜播散(PD)(1例未成熟畸胎瘤伴GTS)病例治疗的回顾性分析中得出:肿瘤细胞减灭术合并腹腔高温灌注是一种安全的治疗方案,可降低选定的卵巢畸胎瘤恶性转化和PD患者的复发。但该样本量较小,不能提供指导性意见。本例患者术后病理为良性肿瘤,与家属沟通后未行化疗。术后应密切随访。
卵巢GTS患者治疗后的生育功能值得关注。对于年轻的有生育要求的患者或者Ⅰ期的卵巢IT,可行保留生育功能的全面分期手术,有临床指征建议转诊至生殖内分泌专家进行咨询评估[16]。对于卵巢GTS可行保守手术治疗。该患者保留了一侧卵巢,但是经过两次卵巢囊肿剥除术,术后卵巢功能可能会受到一定影响,经随访术后月经不规律。Bentivegna等[18]分析了38例卵巢GTS,其中5例患者经过保守手术治疗后正常妊娠。
综上,本病罕见,但诊断明确,预后较好,临床医师要掌握好该病的诊断及治疗,采取合适的手术方式,避免不必要的化疗,防治术后并发症,术后应密切随访,包括影像学检查及血清学分析,争取做到早期发现、早期治疗。

