内质网应激对白藜芦醇代谢的影响
姜佳蕾,蒋昆谕,牛慧敏,董松涛,王诗琪,孟胜男
(中国医科大学药学院药剂教研室,沈阳 110122)
内质网是细胞蛋白质合成和折叠的重要场所。各种生理或病理因素都能干扰蛋白质合成过程,从而使未折叠和错误折叠蛋白在腔内聚集,引起内质网应激(endoplasmic reticulum stress,ERS)[1-2]。ERS是慢性代谢疾病的重要标志,也是连接免疫系统与代谢系统的桥梁[3-4],但ERS对药物代谢是否有影响目前尚不清楚。肝脏是最重要的代谢和解毒器官,肝细胞富含内质网,是ERS最为敏感的细胞之一[5]。目前,ERS对药物Ⅰ相代谢影响的研究比较活跃[6],但ERS对药物Ⅱ相代谢影响的研究较少。随着药物代谢研究的深入和发展,药物Ⅱ相代谢对药物处置的重要性越来越受到重视[7]。尿苷二磷酸葡萄糖酸转移酶(UDP-glucuronosyltransferases,UGTs)是最重要的Ⅱ相药物代谢酶,UGTs介导的葡萄糖醛酸化结合反应对药物的生物利用度、解毒及药物相互作用等有非常重要的作用[4,8-9]。肝脏中的UGTs表达量很高,且位于内质网膜上,如果机体发生ERS,可能会直接造成UGTs表达和活性的改变。白藜芦醇具有抗肿瘤、免疫调节及类雌激素样活性等广泛的药理作用[10],是目前新药开发研究中极具应用前景和临床价值的热点化合物之一[11]。研究[12-13]显示,白藜芦醇的体内外代谢模式主要是UGTs介导的Ⅱ相代谢,且UGT1A1及UGT1A9在其代谢中发挥重要作用。因此,本研究选择白藜芦醇作为模型药物,以考察ERS对白藜芦醇代谢的影响,并探讨ERS是否对UGTs介导的葡萄糖醛酸化代谢产生影响。
1 材料与方法
1.1 材料
1.1.1 药物及试剂:反式-白藜芦醇(98%,上海诺特生物科技有限公司);毒胡萝卜素(thapsigargin,Tg,98%,美国APExBIO公司);蛇床子素(98%,大连美伦生物技术有限公司);Bip抗体(美国Cell Signaling Technology公司);UGT1A1抗体、UGT1A9抗体(中国Absin公司);辣根过氧化物酶标记的山羊抗兔Ig(H+L)二抗(中国ABBKIN公司);HepG2细胞正常组裂解液及Tg诱导模型组裂解液(自提,1.28 mg/mL);辅因子UDPGA、丙甲菌素(美国Sigma-Aldrich公司);DMEM、胎牛血清、胰酶(美国Invitrogen公司);非必需氨基酸、青-链霉素双抗溶液(美国Hyclone公司);乙腈(色谱纯,天津康科德公司);其他试剂为分析纯,超纯水。
1.1.2 仪器:UPLC-Waters,Waters 2996 PDA检测器(美国Waters公司);Aquasonic 150D超声波仪(美国VWR Scientific公司);凝胶成像系统(以色列DNR公司)。
1.2 方法
1.2.1 ERS细胞模型制备:用含10%胎牛血清的DMEM培养液在37℃、5% CO2恒温培养箱中培养肝癌HepG2细胞(本实验室保存)。取对数期HepG2细胞,随机分为正常组和模型组,模型组细胞用1 μmol/L Tg 处理24 h,诱导制备ERS模型,收集细胞。
1.2.2 Westem blotting检测葡萄糖调节蛋白78(glucose regulated protein,GRP78)表达水平的变化:裂解HepG2野生型及诱导型细胞,收集蛋白。行SDSPAGE(分离胶浓度12% ),转膜,5% 脱脂奶粉封闭1 h;分别加入GRP78、UGT1A1、UGT1A9的多克隆抗体,4℃缓慢震荡孵育过夜;洗膜后,加入山羊抗兔二抗,室温孵育1 h;再次洗膜后,ECL发光显像。GAPDH作内参照蛋白。
1.2.3 色谱:色谱柱为 CQUITY UPLC BEH C18(1.7 μm,2.1 mm×50 mm);流动相为乙酸铵水溶液(A)(2.5 mmol/L,pH7.4),乙腈(B)(色谱级)。采取梯度洗脱,0~0.5 min,7% B;0.5~1.5 min,7%~15% B;1.5~3.5 min,15%~50% B;3.5~4.0 min,50%~85% B;4.0~4.5 min,85%~7% B;4.5~6.0 min,7% B;进样量10 μL,流速0.25 mL/min,柱温35℃,内标为蛇床子素。
1.2.4 样品处理及体外孵育实验:
1.2.4.1 细胞培养及细胞裂解液的制备 胰酶消化融合达90%~95%的HepG2细胞,将细胞混悬液(2×105/mL)种植于10 cm培养皿中,培养3 d,PBS洗3次,加入1 mL PBS后将细胞刮下,4℃ 3 000 r/min 离心8 min,在冰冷水浴中用Aquasonic 150D超声波仪以最大功率(135平均瓦特)的短脉冲超声处理细胞悬浮液8 min,收获所得细胞裂解液并测定浓度。
1.2.4.2 白藜芦醇肝细胞裂解液体外葡萄糖醛酸化代谢孵育实验 制终浓度分别为100、500、1 000 μmol/L的白藜芦醇-甲醇溶液。分别取白藜芦醇的储备液,KPI缓冲溶液、UGDPA、丙甲菌素、细胞裂解酶蛋白按3∶186∶42∶53∶16混合,反应体系总体积为200 μL,37 ℃恒温振荡水浴箱中孵育,根据反应速率设定不同的孵育时间。孵育结束后立即取出置于冰浴中,加冰甲醇终止反应,加入内标蛇床子素溶液50 μL,4℃、15 000 r/min离心20 min,取上清进行色谱检测(检测波长306 nm)。
1.3 统计学分析
采用 GraphPad Prism 5.0统计软件进行统计学分析。所有数据点均为3次测定的平均值,以表示。2组间差异比较采用Student’st检验,P< 0.05为差异有统计学意义。
2 结果
2.1 ERS细胞模型的验证
通过Western blotting检测ERS标志性蛋白GRP78的表达变化,验证模型是否构建成功。结果显示,经Tg诱导的模型组HepG2细胞中GRP78蛋白表达增加至正常组的7.35倍,差异有统计学意义(P< 0.001),证明ERS细胞模型构建成功,见图1。
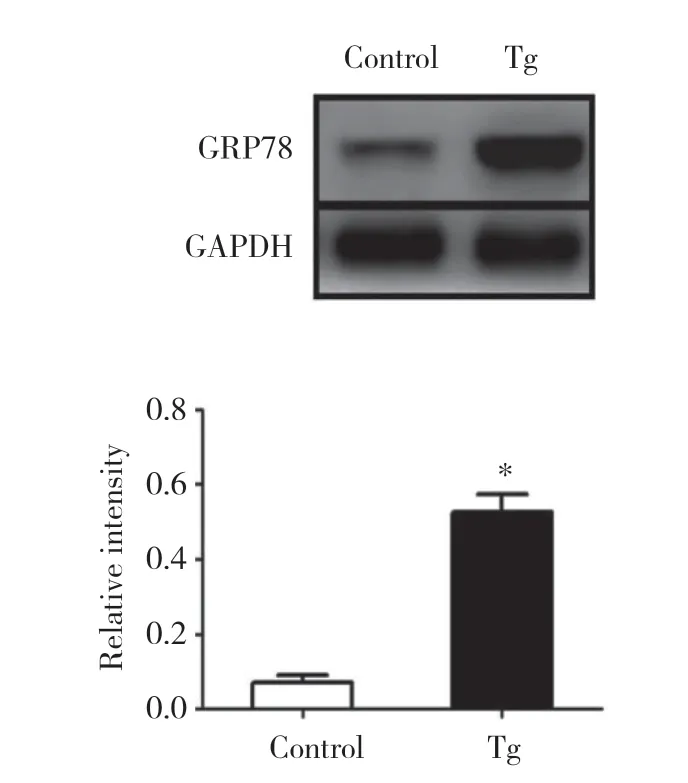
图1 Tg对HepG2细胞GRP78蛋白表达水平的影响Fig.1 The effect of Tg on the expression of GRP78 in HepG2 cells
2.2 ERS对UGT1A1和UGT1A9蛋白表达的影响
与正常组相比,模型组HepG2细胞中Ⅱ相药物代谢酶UGT1A1、UGT1A9蛋白表达分别增高了1.96倍、1.47倍,差异有统计学意义(P< 0.05),见图2。表明ERS可以上调UGT1A1、UGT1A9的蛋白表达。
2.3 ERS对白藜芦醇葡萄糖醛酸化代谢反应速率的影响
细胞裂解液孵育实验结果显示,白藜芦醇在正常组HepG2中有代谢产物生成,而在模型组中代谢产物则很少(图3)。白藜芦醇药物浓度为100、500、1 000 μmol/L时,正常组代谢速率分别是模型组的61.89倍、25.58倍、20.21倍,有统计学差异(P<0.001),见图3。证实ERS可导致白藜芦醇的葡萄糖醛酸化代谢显著减弱。
3 讨论
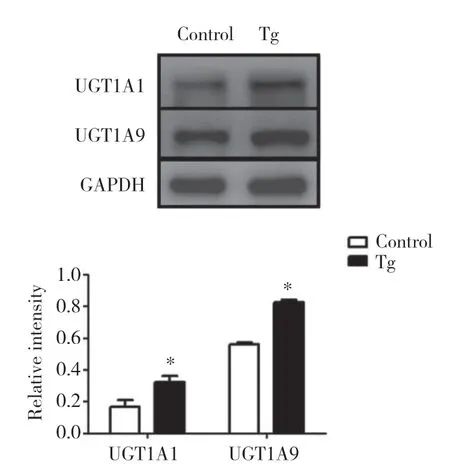
图2 Tg对HepG2细胞UGT1A1和UGT1A9蛋白表达水平的影响Fig.2 The effect of Tg on the expression of UGT1A1 and UGT1A9 in HepG2 cells
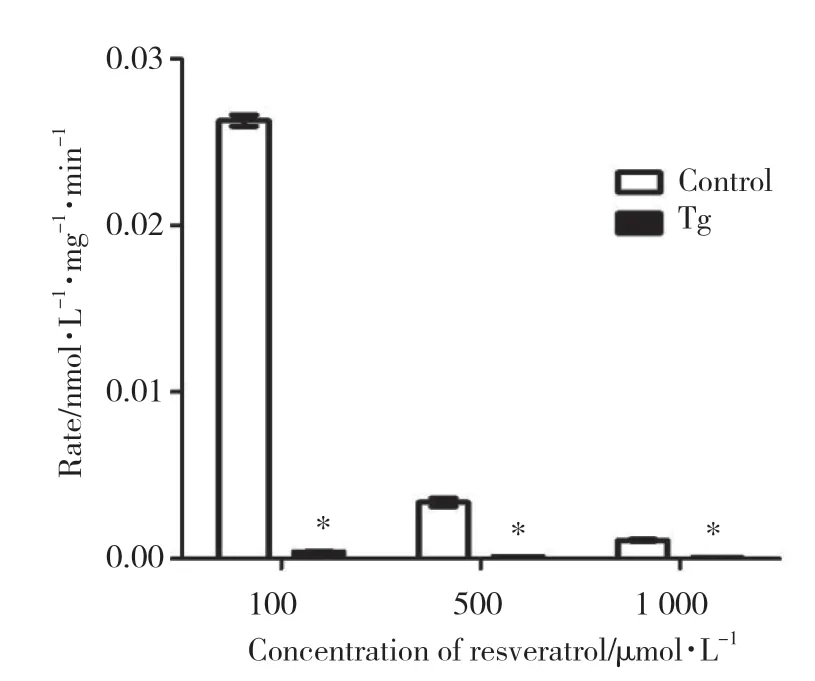
图3 白藜芦醇在正常组和模型组HepG2细胞裂解液中孵育的葡萄糖醛酸化代谢速率Fig.3 Glucuronidation metabolism rate of resveratrol in wild-type HepG2 cell lysate and Tg-induced cell lysate
肝脏是机体最重要的药物代谢器官,内、外源性化合物(包括药物和毒物)通过Ⅰ相和Ⅱ相代谢完成生物转化。肝脏富含药物Ⅰ相和Ⅱ相代谢酶,介导Ⅰ相和Ⅱ相代谢的2个非常重要的酶系,即细胞色素P450酶(cytochrome P450,CYP450)和UGTs均定位于肝细胞内质网中。因此,内质网功能的正常维持对药物代谢具有重要的生物学意义。研究[14]证明,肝损伤及疾病,如肝纤维化、病毒性肝炎、药物性肝炎、非酒精性脂肪肝等可以影响药物代谢酶的表达和功能,且这些损伤和疾病都会引发ERS。因此,明确ERS对药物代谢的影响,对临床提高药物疗效、减少药物不良反应、避免药物相互作用具有重要意义,也是药物精准治疗的迫切需要。
本研究重点探讨了ERS对Ⅱ相药物代谢酶UGTs表达和功能的影响。本研究选用了肝癌HepG2细胞,原因在于肝脏是人体内最重要的代谢和解毒器官。由于正常人体肝脏的细胞株奇缺或难于购买,故本研究选择了目前药物代谢研究中应用广泛、非常活跃、稳定且癌性较低的HepG2细胞。另外,研究[15]证实,HepG2细胞中有较完整的Ⅰ相和Ⅱ相代谢酶的表达,这是选择该种细胞的另一个重要原因。
本研究仅从多个UGTs亚型中选择了UGT1A1和UGT1A9作为研究对象,是由于有多篇文献[16-17]证实两者是白藜芦醇的主要代谢酶。本研究结果显示,ERS可导致这2种主导代谢酶的表达发生显著改变,并且UGTs介导的酶学孵育实验结果也证实白藜芦醇代谢速率的变化趋势与UGT1A1和 UGT1A9蛋白表达变化的趋势一致。提示ERS条件下UGT1A1和UGT1A9仍在白藜芦醇的代谢中发挥主要作用。后续研究将通过应用UGT1A1或 UGT1A9抑制剂及靶基因调控实验进一步确定2种酶的具体作用机制。
目前,常用的制备ERS细胞模型的诱导剂有衣霉素和Tg。但由于UGT1A9的活性可受衣霉素造成的非糖基化影响而失活,而Tg没有非糖基化效应[18]。因此,本研究选择Tg作为ERS模型制备的工具药。
总之,本研究结果证实,ERS可引起UGTs介导的白藜芦醇Ⅱ相代谢发生变化。今后将深入探究ERS对其他Ⅱ相代谢的影响,并综合阐释ERS对药物代谢的作用。

