双链DNA与急性ST段抬高型心肌梗死的相关性分析
王西强,杨丹丹,刘静,范修德,马爱群,4,5,刘平
(1.西安交通大学第一附属医院心血管内科,西安 710061;2.浙江大学医学院第二附属医院心血管内科,杭州 310000;3.西安交通大学第一附属医院感染性疾病科,西安 710061;4.陕西省分子心脏病学重点实验室,西安交通大学,西安 710061;5.环境与疾病相关基因教育部重点实验室,西安 710061)
在冠状动脉病变的基础上,斑块破裂、血栓碎片释放入血,内源性和外源性凝血途径启动,以及随后冠状动脉内血栓形成,是急性心肌梗死发生发展的病理生理学基础,其中中性粒细胞发挥了重要作用[1-2]。研究[3]发现,在动脉粥样硬化的进程中,循环中性粒细胞及构成血管壁的细胞DNA更容易受到损伤,受损细胞通过细胞程序性死亡释放出大量胞外DNA和核小体。通过这种特殊的细胞程序性死亡[4],中性粒细胞、巨噬细胞、单核细胞等释放出球状颗粒串于丝状纤维上,并相互缠绕成网状陷阱样结构,即中性粒细胞外诱捕网(neutrophil extracellular traps,NETs),并促进急性心肌梗死时冠状动脉内血栓形成。NETs结构上的丝状纤维主要由细胞核内的DNA 去致密化而来,为非浓缩的双链脱氧核苷酸(double-stranded DNA,dsDNA)纤维,丝状纤维dsDNA构成了NETs的骨架结构[4-5]。有研究[6-9]发现,NETs具有重要的抗感染作用,并在自身免疫性疾病、肿瘤、深静脉血栓、败血症的发生发展中具有重要作用。近期,BORISSOFF等[10]研究发现,在冠状动脉粥样硬化疾病状态下,由体内免疫细胞释放的dsDNA与严重冠状动脉粥样硬化性患者的预后相关,并且可能是促进冠状动脉粥样硬化心脏病发生的病理生理基础。但dsDNA是否与急性ST段抬高型心肌梗死(acute ST-segment elevation myocardial infarction,STEMI)发生相关仍属未知。本研究拟通过分析STEMI患者dsDNA含量与心肌梗死相关指标,探讨dsDNA与STEMI发生的相关性。
1 材料与方法
1.1 研究对象
选取2015年6月至12月发病12 h内入住西安交通大学第一附属医院心血管内科重症监护室的STEMI患者共145例,以及健康对照者3例。标本采集前告知并征得研究对象或其委托人同意,并签署知情同意书。本研究经西安交通大学第一附属医院伦理委员会批准,并在其监督下完成。
纳入标准:根据最新中国STEMI诊断及治疗指南[11]诊断为STEMI,发病12 h内,并接受急诊冠状动脉支架植入术开通罪犯血管的患者。排除标准:伴肾功能不全且血清肌酐> 20 mg/L;伴肝炎、肝硬化,近期出现或持续存在的肝功能异常;伴骨关节炎、类风湿性关节炎、溃疡性肠病、肌炎/肌病、系统性红斑狼疮等系统性疾病;有瓣膜性心脏病、持续性心房纤颤等心血管疾病;不同意及不配合完成本研究者。
1.2 研究方法
1.2.1 记录基线资料:包括性别、年龄、身高、体质量、既往病史等基本资料。
1.2.2 采集标本:STEMI患者入院后立即于桡动脉或股动脉处取外周动脉血,于术中采集梗死相关冠状动脉血;采集健康对照者外周动脉血。采用EDTA抗凝管取血。
1.2.3 检查生化指标:抽血后立即送检血常规、肝肾功、心肌酶谱、肌钙蛋白、血脂全套等常规检查,使用Sysmex XE-5000全自动血液分析仪及配套试剂进行检测。
1.2.4 分离STEMI患者冠状动脉血、外周动脉血及正常人外周血中性粒细胞:采用中性粒细胞分离试剂盒进行分离。向15 mL离心管中加入试剂A 5 mL,向分离液液面上加入血液标本,500~550g高速离心10 min,可见离心管中标本分为单个核细胞层及中性粒细胞层,吸取离心管中中性粒细胞。若中性粒细胞中混杂有红细胞,则加入红细胞裂解液,即可得目的细胞。转移目的细胞至一新的15 mL离心管,并加入10 mL清洗液,250g高速离心10 min,获得目的细胞。
1.2.5 免疫荧光染色观察STEMI患者梗死相关动脉、外周动脉及健康对照者外周动脉NETs结构并计数分析:4%多聚甲醛固定中性粒细胞30 min,用0.1%TX-100作用于中性粒细胞5 min,使细胞膜通透,用BSA封闭1 h,一抗孵育过夜。用PBS清洗细胞,使用DAPI对中性粒细胞细胞核进行着色,封片,使用荧光显微镜观察NETs结构,对不同视野下NETs结构进行计数,并计算NETs结构占总细胞数比例。
1.2.6 检测梗死相关动脉及外周动脉血浆中NETs相关结构dsDNA含量:使用荧光染料Sytox Green DNA检测。将标准品与样品按照试剂盒说明书稀释后,用含有0.1%BSA的PBS将血浆标本稀释50倍,用100 μL荧光染料与等体积的稀释样品混合后,加入96孔板中,最终标准品的终浓度为1,0.5,0.25,0.125,0.062 5,0.031 25,0.015 625,0 μg/mL。在激发光为488 nm,发射光为525 nm处,使用荧光读数仪检测信号强度,标本加完后尽快上机,以防止荧光淬灭。
1.3 统计学分析
采用SPSS 18.0软件进行统计学分析。符合正态分布的计量资料采用表示,不符合正态分布的计量资料采用中位数表示。2组计量资料符合正态分布及方差齐性的比较采用两独立样本t检验,2组计量资料不符合正态分布与方差齐性的比较采用非参数Mann-WhitneyU检验。满足双变量正态分布资料采用Pearson相关系数分析;不满足双变量正态分布或等级资料采用Spearman相关分析。P< 0.05为差异有统计学意义。
2 结果
2.1 STEMI患者基线资料
入组STEMI患者的基线资料见表1。
2.2 免疫荧光染色结果
梗死相关冠状动脉中可见大量NETs骨架结构生成,见图1。选取不同视野计数NETs骨架结构占总细胞数比例并进行统计学分析,结果显示,STEMI患者梗死相关冠状动脉中NETs骨架结构(32.33%±4.6%)明显多于STEMI患者外周动脉及健康对照者外周动脉(17.87%±1.017%,7.55%±1.95%),差异有统计学意义(P=0.037,P=0.027),见图2。
2.3 免疫酶标仪定量分析结果
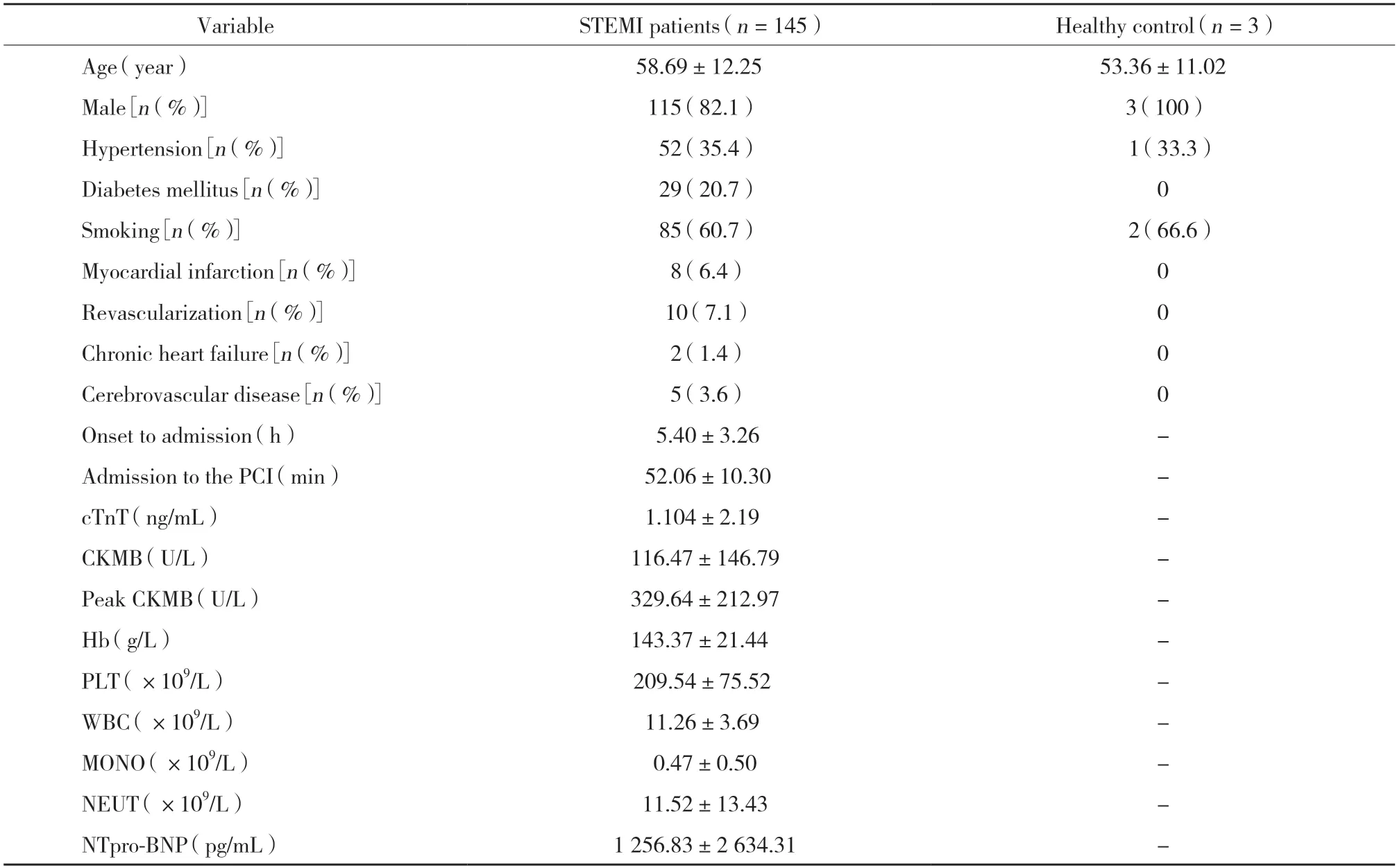
表1 STEMI患者基线资料Tab.1 Clinical baseline data in STEMI patients

图1 免疫荧光染色观察NETs的生成 ×20Fig.1 Analysis NETs formation by immunofluorescence staining ×20
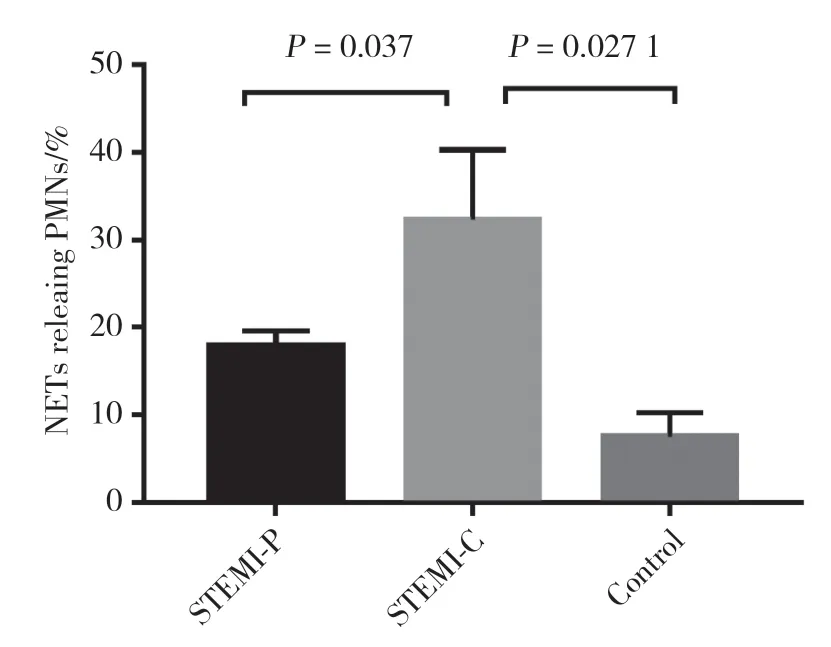
图2 梗死相关冠状动脉、外周动脉及健康对照者外周动脉NETs生成量Fig.2 Neutrophil extracellular traps of polymorphonuclear neutrophils obtained from infarct-related coronary artery,peripheral artery,and control peripheral artery
用荧光分光光度仪测定标准品和外周动脉血游离dsDNA含量,绘制标准曲线,R2=0.998 1,见图3。STEMI患者冠状动脉中dsDNA含量明显高于STEMI患者外周动脉,差异有统计学意义(P=0.038)。
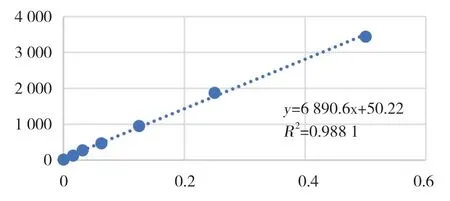
图3 dsDNA标准曲线Fig.3 Standard curve of dsDNA
2.4 dsDNA与心肌梗死相关指标的散点图分析
dsDNA与磷酸肌酸激酶(creatine kinase,CK)、磷酸肌酸激酶同工酶(creatine kinase isoenzyme-MB,CK-MB)、肌钙蛋白T(troponin T,cTnT)、白细胞(white blood cell,WBC)检测结果行散点图分析,结果见图4。
2.5 dsDNA与心肌梗死相关指标的相关性分析
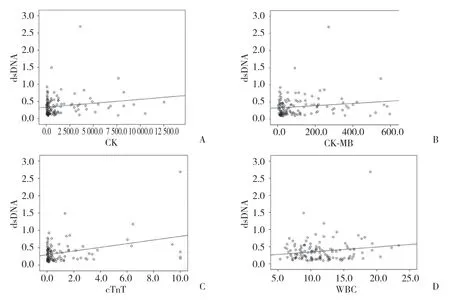
图4 磷酸肌酸激酶、磷酸肌酸激酶同工酶、肌钙蛋白T、白细胞计数与dsDNA散点图Fig.4 Scatter chart of dsDNA and CK,CK-MB,cTnT and WBC
相关性分析结果显示,CK、CK-MB、cTnT、WBC与dsDNA含量呈正相关,差异有统计学意义,见表2。
3 讨论
STEMI是冠状动脉粥样硬化性心脏病患者死亡的主要原因[12-13],其发生机制尚不清楚[1,14]。研究显示,循环中的WBC,特别是单核细胞在动脉粥样硬化血栓形成过程中起重要作用[15],且中性粒细胞是急性心肌梗死患者死亡的独立预测因子[16];中性粒细胞在急性心肌梗死患者冠状动脉血栓中大量聚集[17],并且是预测急性心肌梗死患者远期预后的重要指标[17-19]。但中性粒细胞如何参与上述疾病的发生仍有待进一步探讨。
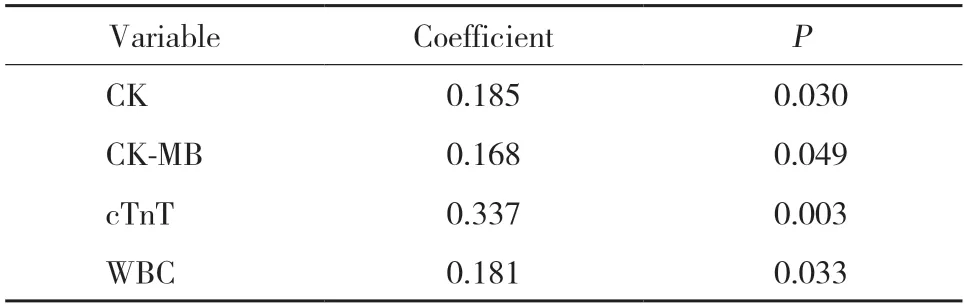
表2 心肌梗死相关指标与外周动脉血浆dsDNA相关性分析Tab.2 Correlation between dsDNA and indicators of myocardial infarction
既往研究[4]显示,中性粒细胞可以通过形成NETs捕获并杀灭病原体。近期的研究[20]发现,NETs不仅对感染性疾病具有保护作用,而且还在动脉粥样硬化以及动脉粥样硬化血栓形成中具有重要作用。本研究检测了STEMI患者梗死相关冠状动脉、外周动脉血中NETs骨架结构、dsDNA含量,结果显示,STEMI患者梗死相关冠状动脉血中NETs骨架结构明显多于STEMI患者外周动脉及健康对照者外周动脉,且STEMI患者冠状动脉中NETs骨架结构dsDNA含量明显高于STEMI患者外周动脉,差异有统计学意义。并对dsDNA含量与心肌酶谱、cTnT、WBC等提示STEMI发生的相关性指标行相关性分析,结果显示,CK、CK-MB、cTnT、WBC与血浆中dsDNA呈正相关,且差异有统计学意义,提示中性粒细胞可能以NETs的形式参与了STEMI的发生,NETs的骨架结构dsDNA可能与STEMI的发生相关,可能为治疗STEMI提供新的思路与靶点。
研究[20]发现,应用动脉粥样硬化小鼠模型,可见中性粒细胞在胆固醇结晶的刺激诱导下形成NETs,巨噬细胞被NETs激活并分泌相关细胞因子,如白细胞介素-1β,在相关细胞因子的作用下,辅助性T细胞17被激活,扩大免疫细胞在粥样硬化灶的聚集,引起慢性炎症反应,为NETs参与冠状动脉粥样硬化的形成、斑块炎症活动提供了可能的机制。研究[21]显示,过度产生的循环DNA、核小体和组蛋白等NETs相关结构在血栓形成、肺炎以及败血症中能够促进疾病的发展,加重病情。由于强有力的细胞毒和促血栓形成作用,胞外DNA可能是炎症和血栓形成之间的桥梁。而且在急性心肌梗死中,中性粒细胞可释放NETs,并暴露有活性的组织因子,激活外源性凝血途径,从而促进急性心肌梗死时血栓的形成[22]。在动脉粥样硬化中,胆固醇刺激NETs的生成,NETs参与并扩大慢性炎症反应,胞外DNA作为炎症和血栓之间的桥梁,促进急性心肌梗死时血栓形成,可能是NETs致STEMI发生的主要机制。因此,中性粒细胞可能以NETs的形式参与了STEMI的发生。

