脉动真空湿热灭菌法去除内毒素的验证效果分析
王舰兵 王云英 李文波 李 雨 贺 亮 张 旭 崔云龙▲
1.长春祈健生物制品有限公司,吉林长春 130012;2.长春生物制品研究所有限责任公司,吉林长春 130012
高压蒸汽灭菌是使物品灭菌后达到最终无菌要求,这是药品生产及相关行业中的一个基本保证,是控制染菌的有效措施之一[1]。纯蒸汽脉动真空灭菌凭借良好的灭菌性能, 得到广泛的应用[2]。目前在药品生产和医疗行业中去除玻璃器皿、金属器具物品上的热源质方法主要是干热灭菌法和酸碱法,但是还有很多如:硅胶管道类、橡胶制品类、棉麻无菌服类、离心杯PVC 类物品都无法承受250℃高温的干热灭菌和酸碱的腐蚀;并且常用的121℃湿热灭菌又无法去除热源质。本次试验就是以脉动真空湿热灭菌为基础,采用合适的压力、温度节点来检测去除热源质的效果,验证无论是控制一般的杂菌还是芽孢杆菌或是去除热源质均可采用高压蒸汽灭菌法。为了保证高压蒸汽灭菌物品质量[3]灭菌后必须采取适当方法进行灭菌效果验证[4] 这是高压蒸汽灭菌效果验证是最关键的首要步骤,也是每个国家检验质量管理体系稳定运行和发展的重要手段[5],是更加安全和更加先进的质量保证方法[6]。
1 材料与方法
1.1 实验材料
灭菌对象是疫苗生产和医疗行业中常用的硅胶管道、敷料包、橡胶制品栓、棉麻无菌服、PVC 类的离心杯、柱芯式过滤器。灭菌器为山东新华医疗器械股份有限公司生产的脉动真空灭菌器(XG1.DTF-1.5B 型)及设备自带的双芯主控温度探头和温度/压力自动记录仪(数字)以及日本横河电机株式会社出品的SR10000 温度曲线自动记录仪(图谱)。灭菌验证所用的器材包括德国颐贝隆公司产的无线温度记录器;Ebro 温度验证记录仪;Ebro 压力验证记录仪;山东新华医疗器械股份有限公司生产的132℃高压灭菌指示条和b-d 真空试验测试图;美国Mesalabs EZTest 公司产的自含菌为嗜热脂肪芽孢杆菌孢子的脉冲指示管;培养基为长春生物制品研究所有限公司生产的无菌实验用硫乙醇酸盐培养基;天津泰斯特仪器有限公司生产的恒温培养箱;湛江安度斯生物有限公司生产的内毒素指示剂,批号:1702170,效价:1250EU/ 支;湛江安度斯生物有限公司生产的鲎试剂,批号:1901301,效价:0.125EU/mL;
1.2 试验方法
1.2.1 脉动真空灭菌器验证 (1)灭菌器性能验证:①空载真空保压试验:设定参数:保压限度:-93kPa,时间:900s,泄露限度:≤2kPa。 结果判定,若900s 后初始压力≤-91kPa、泄露率≤2kPa/15min,确认设备保压合格。②b-d 试验:灭菌器在无负载的初始状态下将b-d 测试包置放于排气口上方约20 ~30cm 处。设定b-d 测试参数:脉动上下限±65kPa,脉动三次,灭菌温度132℃,灭菌时间为4min,在完成灭菌操作程序后,取出测试包并打开观察b-d 指示图。判定结果:若b-d 指示图上的色列条变化均匀,与对照图设计的颜色一致则说明此脉动真空灭菌器能够排除冷空气99%以上,灭菌器此项真空性能合格。③空载热分布试验:灭菌器在无负载的初始状态下,将经过校准合格并处在有效期内的8 个Ebro 自动温度、压力监控记录仪,以几何分布的方式放置在灭菌器的内室中,并保证8 个监控记录仪的每个位置都不小于距离灭菌器内室四壁5cm 的距离。在输水口处至少放置一个压力温度监控仪,并设定监控仪的读取记录频次为每10 秒一次。同时必须保证设备和8 个监控记录仪同时开启和结束;选择我们公司疫苗生产中应用的132℃、8min、脉动±65kPa 灭菌程序进行试验。灭菌操作完成后读取并记录每个点位的温度数值。结果判定,若在灭菌过程中同一时间的不同点位之间的温度差别(均一性)≤2℃,并且灭菌器主控温度探头与监控记录仪记录的温度数值差值均≤1℃,则确认灭菌室内的温度分布均匀;否则视为有“冷点”并判定试验失败。④满载热穿透试验:灭菌器装载待灭菌物品必须按预先设计的规定位置进摆放(此后也要严格执行),待达到满负荷装载后。见图1。
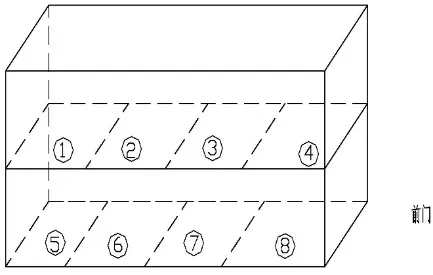
图1 待灭菌物品同监控记录仪及内毒素指示剂摆放位置
1、5 号位各放一个工作盒,每个盒内放置分装管道4 条、离心杯4 个、止血钳5 把、无毛抹布4块;2、6 号位各放置两盒橡胶栓,每盒96 枚;3、7号位各放置洁净服20 套;4、8 号位各放置10 吋柱式滤器一台。将8 个监控记录仪按号位放置,同时也必须保证设备和8 个监控记录仪同时开启和结束。同样选择我们公司疫苗生产中应用的132℃、8min、脉动±65kPa 灭菌程序进行试验。灭菌程序结束后,结果判定,若所有的测试各点标准灭菌时间F0 ≥15min,则视为灭菌器在规定的装载方式且满载的条件下满足灭菌要求。
(2)灭菌器生物挑战试验 按着满载热穿透试验装载方式进行装载,待达到满负荷装载后,将经过校准合格并处在有效期内的嗜热脂肪芽孢杆菌孢子按着满载热分布试验所测试的每个点位的不同物品中放置1份生物指示剂并在灭菌器外留有一份阳性对照。按照设定的灭菌程序(132℃、8min、脉动±65kPa)进行灭菌操作结束后,把经过挑战的生物指示剂和阳性对照同时在55℃~56℃、24h 条件下进行培养。结果判定:经灭菌挑战后的嗜热脂肪芽孢杆菌孢子指示剂管内颜色呈现紫色,(说明书给定的灭菌后的合格颜色)即为培养阴性(-),且阳性对照管内的生物指示剂颜色不变(黄色),可判定灭菌效果合格并达到灭菌验证要求同时需在QC 实验室进行培养,证明无菌生长。若被挑战的生物指示剂有1支或多支指示剂的管内培养液仍为黄色,则判定灭菌效果验证失败。
1.2.2 内毒素挑战试验 按满载热穿透的装载方式和同样的物品进行放置,同时将10 支用锡纸包裹折断颈部的内毒素指示剂一起放入8 个号位即:1、5 号工作盒各放入两枚内毒素指示剂,其中一枚放入管道内、一枚放入离心杯内;2、6 号位各在其中一栓盒内放入一枚指示剂;3、7 号位各在其中一套洁净服内放置一枚指示剂;4、8 号位各在滤器内放置一枚指示剂并在灭菌器外留有一份阳性对照。然后进行132℃、75min、脉动±65kPa 灭菌程序。见图2。

图2 内毒素灭菌时间与温度曲线
此挑战试验共进行五遍。凝胶法限量检查结果判定:将未灭菌的指示剂制作成0.25EU/mL 的阳性对照;将灭菌后的指示剂用细菌内毒素检查用水按指示剂灭菌前的效价(1250EU/ 支)梯度稀释至125EU/mL 作为样品;按细菌内毒素检查法的规定进行检查,阳性对照为阳性,样品检查为阴性,则表明灭菌程序已达到1000 倍的灭活内毒素效力,挑战试验合格。
2 验证结果
2.1 灭菌器性能验证结果
(1)保压试验:脉动真空灭菌器保压程序停止900s 后,初始压力仍≤-93kPa、泄露率≤2kPa。因此该设备没有泄露,保压试验合格。(2)b-d 试验结果:在空载条件下脉动上下限±75kPa、灭菌温度132℃、灭菌时间为4min,在完成灭菌操作后,取出测试包打开观察b-d 指示图呈现色列条变化均匀与对照图设计的颜色一致则说明此脉动真空灭菌器能够排除冷空气99%以上,灭菌器此项真空性能试验合格。(3)空载热分布试验结果:在完成了一个灭菌周期(132℃、8min、脉动±65kPa)后读取监控记录仪,数据显示在灭菌过程中的任何相同时间的不同位置之间的温度差别(均一性)均≤2℃,并且灭菌器温度控制探头与监控记录仪所数值记录的温度差值均≤1℃,可判定空载热分布试验合格。(4)满载热穿透试验结果:按着规定的装载方式且达到满负荷装载后选择132℃、8min、脉动±65kPa灭菌程序进行试验。灭菌程序结束后读取监控记录仪数据显示:所有的测试各点F0 ≥15min,证明此次满载热穿透试验合格。(5)生物挑战试验结果:芽孢指示剂按着满载热分布试验所测试的每个点位的不同物品中布放,完成1个灭菌程序操作后,取出所有被挑战的生物指示剂观察颜色并同阳性一起在55℃~56℃、24h 条件下进行培养。结果判定:被灭菌后的生物指示剂管内颜色呈现紫色,(与说明书判定合格颜色一致)即为培养阴性(-),同时55℃~56℃、24h 培养后无菌生长,因此可判定生物挑战试验合格。
2.2 内毒素挑战试验结果
待完成132℃、75min、脉动±65kPa 灭菌程序后将未灭菌的指示剂和已灭菌的指示剂
分别加入适量的细菌内毒素检查用水复溶。将未灭菌的指示剂梯度稀释至0.25EU/mL,用作阳性对照;将灭菌后的指示剂用细菌内毒素检查用水按指示剂灭菌前的效价(1250EU/ 支)梯度稀释至125EU/mL 作为样品;立即用效价(0.125EU/mL)的鲎试剂进行凝胶法限量检查。结果表明阳性对照呈现凝集反应;样品无凝集反应。表明灭菌达到1.000 倍的灭活内毒素效力(lgRd >3);可使内毒素下降3 个对数单位,符合中国药典三部(2015 版)关于内毒素的检测规定。
3 讨论
本次试验首先通过了脉动真空高压蒸汽灭菌器的性能验证、微生物挑战试验验证,结合蒸汽灭菌的三大基本要素即:作用时间、灭菌温度和饱和蒸汽的质量[7],证明灭菌器设备本身的完整性和可靠性,且符合现行GMP 关于对灭菌法的要求。关键是对灭菌程序进行了验证,保证了灭菌效果的有效性[8]同时密切观察在最冷点放置的生物指示剂是否通过微生物挑战性试验从而来进一步证明灭菌的效果[9]。然后用此台灭菌器进行高压蒸汽灭菌方法去除内毒素的挑战试验。现在国内所有制药企业和医疗行业祛除热源质的办法主要是250℃/45min 以上干热灭菌法、酸碱侵泡法、离子交换法等,针对的都是玻璃器皿、金属物品以及制水系统等,具有非常大的局限性,但对于PVC 材质的硅胶管道和离心杯、橡胶制品类的各种胶栓、棉麻类的无菌服和敷料包以及滤芯、滤膜等这些制药生产和医疗工作的主要物料只能进行无菌处理却无法去除内毒素热源质,所有只能依靠生产过程和工作过程中的控制,不能进行最终灭菌,从而给生产和医疗带来了很大的隐患和风险。同时干热灭菌和酸碱侵泡杀灭内毒素所使用的方法周期耗时较长,如果能更进一步证明用脉动真空湿热灭菌法去除内毒素,那么可大大拓宽被灭菌物品的范围,体现出湿热灭菌法具有穿透力强、传到快、灭菌能力更强的特点[10],将会在制药企业和医疗行业以及相关领域得到广泛的推广和应用。但无论采用何种灭菌参数都必须要严格按着验证过程中的包装方式和装载位置进行包装和装载。以保证灭菌的有效性和均一性[11],都必须证明所采用的灭菌工艺和监控措施在日常的工作过程中能确保物品灭菌后的内毒素能下降3 个对数单位,同时验证及操作人员应具备极强的责任心和专业理论水平[12]。
总之灭菌效果验证是药品生产企业和医疗行业中质量安全的必要条件和保障,设备的验证和装载方法的验证要定期化和常态化并且符合设备验证的工艺要求[13],验证后的日常生产中的每次灭菌也必须对各项参数进行监测,经常用化学指示卡和生物指示剂监控灭菌效果[14]加强消毒灭菌薄弱环节的管理,落实各项消毒灭菌制度,提高消毒灭菌工作质量[15]。这也是对药品生产质量和医疗工作的重要保障。

