miR-208a通过下调p21的表达促进心肌肥厚
陈 恩,蔡 炜,吴佳易,郑行春
心肌肥厚(cardiachypertrophy,CH)是心肌细胞对心脏长期超负荷工作的的代偿过程,在维持心脏功能上有着重要作用,临床上常发生于高血压病、急性心肌梗死后及心肌病的患者。但是,随着疾病的进展,心脏负荷的持续存在或增加,CH在晚期将不可避免的走向失代偿,最终导致心力衰竭而死亡[1-2]。目前CH的病因尚未完全明确,同时临床也缺乏切实有效的治疗策略。因此,寻找新的有效的治疗靶点一直是研究的热点,近年的研究发现,微小RNA(miRNA)参与调控CH,与心力衰竭的发生密切相关[3-6]。miRNA是一种大小为19~25个碱基的单链非编码小分子RNA,通过其“种子序列”与靶mRNA 3′-端非翻译区(UTR)的序列完全互补或不完全互补结合,导致靶mRNA 降解或翻译抑制,从而在转录后水平负调控靶基因的表达[7-8]。有研究报道,心脏特异性的miR-208a过度表达将造成小鼠心肌β-肌球蛋白重链(β-myosin heavy chain, β-MCH)表达的增加,导致CH[9];而且通过抑制小鼠miR-208a的表达,可以减少小鼠CH,从而改善心脏功能[10]。提示miR-208a有望作为逆转CH的治疗靶点。但是miR-208a在CH过程中的具体作用机制仍未完全明确。
有研究发现,miR-208a在HEK293细胞中能够在转录后水平负调控p21的表达[11]。p21是一种重要的细胞周期抑制因子,能够与cyclin D/CDK形成复合物使细胞周期停滞在G1期,抑制细胞的增殖,使其退出细胞周期[12]。哺乳动物出生后不久,在正负细胞周期调控因子的共同作用下心肌细胞退出了细胞周期,大部分停滞于G0/G1期,成为高度分化的终末细胞,丧失了有丝分裂的能力[13]。即使在某些病理刺激下,心肌细胞可以通过下调p21等细胞周期负调控因子的表达,重返细胞周期,促进细胞内DNA和蛋白质合成增加[14-16],但是,由于其丧失有丝分裂的能力,最终表现的是心肌细胞体积上增大(即CH),而并非数量上的增加[17]。因此,miR-208a可能通过调控细胞周期抑制因子p21的表达,影响心肌细胞周期,从而影响CH的发生、发展过程。本研究将通过建立小鼠CH模型,明确miR-208a和p21的表达情况;通过体外细胞模型,明确miR-208a影响小鼠CH的调控靶基因,为CH的基因治疗提供一条新的思路。
1 材料与方法
1.1主要材料 8~10周龄的雄性C57BL/6L小鼠[上海斯莱克实验有限公司,许可证SCXK(沪)2007-00005];小鼠心肌细胞株(HL-1)、HEK293T购至中科院上海细胞所;慢病毒载体系统pWPXL,psPAX2,pDM2G(上海肿瘤研究所黄胜林博士赠送)。胚胎牛血清和DMEM培养基(美国Gibco公司);miR-208a模拟物和抑制物(广州市锐博生物科技有限公司);定量聚合酶链反应(qPCR)试剂盒(日本TaKaRa公司);Dual-Luciferase Reporter Assay System(美国Promega公司),SuperSignal Western-blot化学发光底物系统(美国Pierce公司),p21单克隆抗体及GADPH(美国Sigma公司),山羊抗小鼠二抗(北京中杉金桥生物技术有限公司)等。
1.2小鼠CH模型 55只清洁级小鼠,体质量(20±5)g,分为假手术组(Sham组,n=20)和CH组(n=35)。(1)CH组:将经腹腔注射3%戊巴比妥钠(35 mg/kg)麻醉的小鼠仰卧位固定,气管插管接呼吸机控制呼吸,胸前正中区备皮、消毒,切开皮肤,分离组织,暴露主动脉弓,26~27 G垫扎针头垫扎,对主动脉及垫扎针用5号丝线结扎,结扎确实后抽出垫扎针,检查主动脉弓近心端波动增强,逐层关胸,缝皮。手术切口处用红霉素眼膏涂敷,待小鼠自主呼吸恢复后脱机拔管,观察至苏醒。(2)Sham组同期开胸但不进行主动脉弓结扎。(3)4周后再次麻醉小鼠,开胸取心脏,一部分做成蜡块用于石蜡切片,另一部分保存于-80 ℃冰箱中,用于后续的RT-qPCR和Western-blot检测。所有的小鼠试验均遵守相关的操作指南[18]。
1.3H-E染色 石蜡切片经二甲苯脱蜡,依次梯度乙醇水化;苏木精液染色5 min后,流水冲洗1~3 min;然后加1%盐酸乙醇2 s,流水冲洗3~5 min,伊红染液复染30 s后脱水,最后用中性树胶封片。
1.4细胞培养 将小鼠心肌细胞株(HL-1)和HEK293T细胞放置于含10%胎牛血清、50 μg/mL链霉素和50 U/mL青霉素的DMEM培养基中,培养条件为体积分数为0.05、37 ℃的CO2饱和湿度。
1.5慢病毒载体构建、包装和滴度测定 根据miR-208a的基因序列设计引物(表1),以小鼠基因组DNA为模板,采用巢式PCR扩增获得包含pre-miR-208a序列在内的基因序列,凝胶电泳分离目的片段,胶回收片段,酶切,纯化,连接入pWPXL慢病毒载体上,构建pWPXL-miR-208a。酶切、测序鉴定。采用脂质体法(脂质体2000试剂,转染效率85%以上)按一定比例将pWPXL,pLVTHM,pWPXL-miR-208a与包装质粒psPAX2、包膜质粒pMDG2共转染HEK293T细胞,要求转染时细胞融合度为60%,包装产生慢病毒颗粒,连续稀释法测定病毒滴度。测定后病毒颗粒感染心肌细胞,而后根据荧光强度判断感染效果。

表1 RT-PCR的引物序列
WT:野生型;M86:突变型.
1.6野生型和突变型荧光素酶报告载体构建及活性检测 (1)野生型荧光素酶报告载体构建:采用PCR 分别扩增p21基因全长的3′-UTR,凝胶电泳分离目的片段,胶回收片段,酶切,纯化,连接到荧光素酶报告载体pCDNA-luciferase-MCS,构建pCDNA-luciferase-p21。酶切、测序鉴定。(2)突变型荧光素酶报告载体构建:分析miR-208a 对p21基因全长3′-UTR 的结合位点,设计引物突变这个位点(表1)。采用搭桥PCR 扩增特异片段,凝胶电泳分离目的片段,胶回收片段,酶切,连接到荧光素酶报告载体pCDNA-luciferase-MCS,构建pCDNA-luciferase-p21-mut。酶切、测序鉴定。(3)双荧光素酶检测实验:将pCDNA-luciferase-p21及miR-208a模拟物与对照载体及阴性对照与荧光素酶报告载体(野生型或突变型)、Renilla 共感染小鼠心肌细胞,双荧光素酶检测试剂检测荧光素酶活性,根据荧光强度判断感染效果。
1.7总RNA 提取和实时定量PCR检测miR-208a和p21-mRNA水平表达 总RNA提取参照TaKaRa反转录试剂盒的说明书反转录。以GAPDH为内参,使用qPCR试剂盒及特异性引物通过PCR仪扩增检测合成的cDNA,采用2-△△Ct方法,计算每个基因的相对表达量。
Real-time PCR 对小鼠心肌细胞株进行miR-208a的表达检测,用pWPXL-miR-208a 慢病毒颗粒感染表达miR-208a 的小鼠心肌细胞株;流式细胞仪分选表达绿色荧光蛋白的阳性细胞,完全培养基培养,获得可以传代的稳定细胞株。
1.8Western-blot法检测p21蛋白水平表达 提取细胞总蛋白后,取等量蛋白,在12%的SDS-PAGE凝胶中电泳后,转膜至硝酸纤维素滤膜上,封闭2 h后,孵育一抗,4 ℃过夜。PBS室温漂洗4次,孵育二抗,1 h后洗膜,曝光。
1.9细胞周期分析 将生长状态良好的心肌细胞接种于6孔板内,待细胞长至50%融合度,转染小RNA,24 h后加入Nocodazole,使细胞同步化,16 h后换成完全培养基,释放6 h后收集细胞。细胞用胰酶消化,冷PBS洗2次,用300 μL PBS重悬细胞,再缓缓加入-20 ℃预冷的无水乙醇700 μL,混匀后置于-20 ℃固定过夜。次日,先用1 000 r/min离心5 min,弃去乙醇,冷PBS洗2次,再用含有RNA酶(终浓度5 mg/L)的PBS 500 μL重悬细胞,37 ℃处理30 min;后加入PI 5 μL,室温避光染色30 min,流式细胞仪FACSCalibur检测,记录激发波长488 nm处红色荧光,并用ModFit LT V3.0软件分析结果。
1.10统计学处理 采用GraphPad Prism 6统计软件进行分析,组间比较采用独立样本t检验。P<0.05为差别有统计学意义。
2 结 果
2.1CH小鼠miR-208a和p21的表达 病理组织学H-E染色可见:与Sham组比较,CH组的心肌细胞体积增大;Western-blot检测发现,与Sham组比较,CH组的p21表达明显下调(P<0.05,图1)。
心脏组织RNA水平检测发现,CH组中的miR-208a明显增多,而p21-mRNA明显减少,且二者呈现负相关(图2)。

A:H-E染色结果(上:4×;下:40×);B:p21蛋白检测,与假手术组比较,☆☆:P≤0.001.图1 假手术组和心肌肥厚组H-E染色结果和p21蛋白的表达情况Fig 1 The difference of H-E staining and p21 protein expression between Sham group and CH group

A:miR-208a; B:p21-mRNA; C:miR-208a和p21-mRNA关系.图2 miR-208a和p21-mRNA在小鼠假手术组和心肌肥厚组的表达Fig 2 The difference expression of miR-208a and p21-mRNA between Sham group and CH group
2.2miR-208a通过结合p21 3′-UTR下调p21表达 miR-208a可以下调野生型p21-3′-UTR-荧光素酶的活性,但不影响突变型p21-3′-UTR-荧光素酶的活性(图3A)。同时,在心肌细胞中分别转染miR-208a模拟物及miR-208的抑制剂,从而使得心肌细胞中miR-208a过表达或表达下调,结果表明,过表达miR-208a后心肌细胞中p21的mRNA及蛋白水平均出现明显下调(图3B,C);相反,抑制miR-208a的表达后心肌细胞中p21的蛋白水平则呈上调(图3C)。
2.3miR-208a促进心肌细胞周期G1-S期的转化
流式细胞仪检测发现,过表达miR-208a时,G1期的细胞数明显减少,S期细胞数明显增加;抑制miR-208a表达后,G1期细胞数增多,S期细胞数减少(图4)。
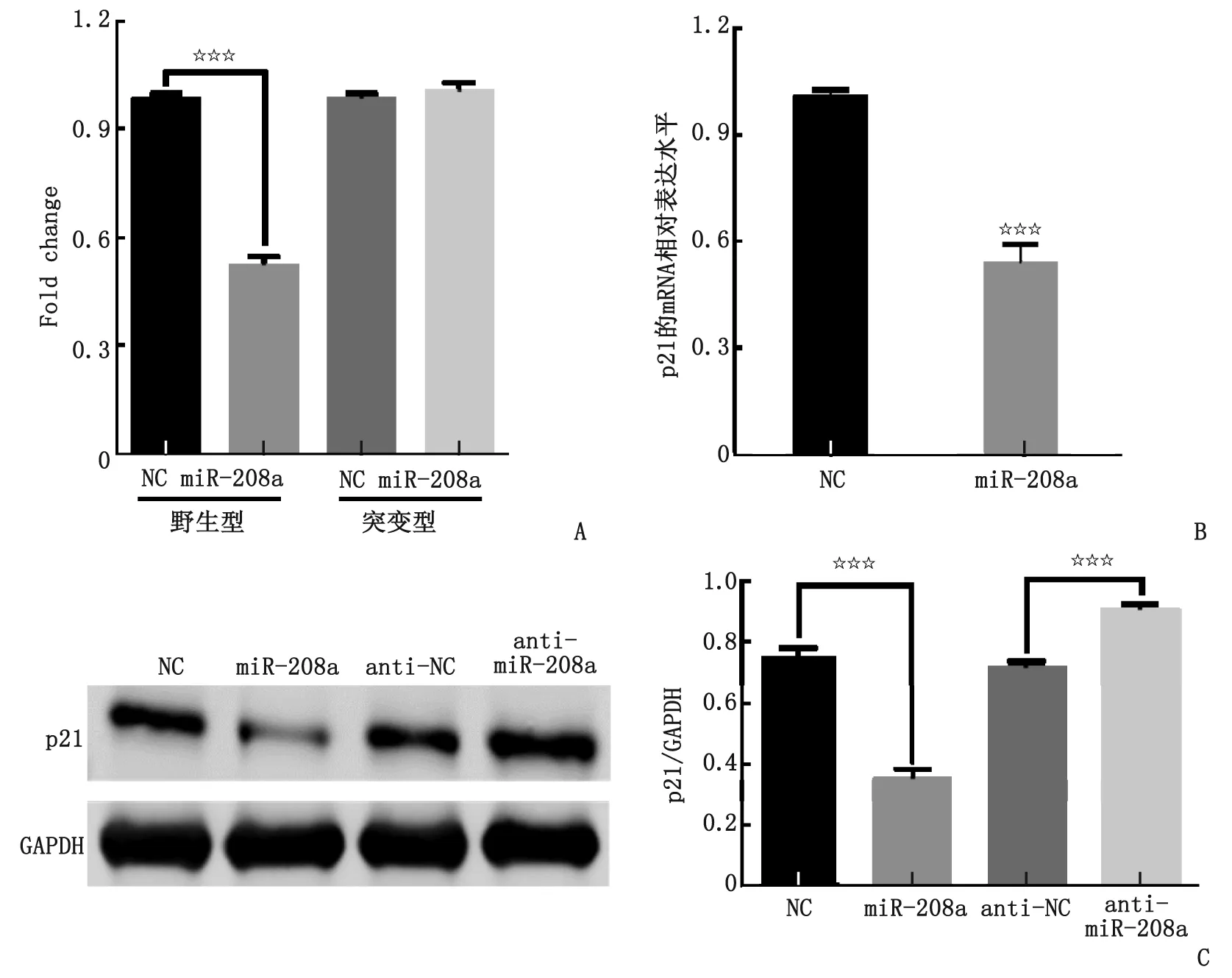
A:双荧光素酶检测;B:过表达miR-208a后p21的mRNA水平的检测; C:过表达miR-208a和抑制miR-208a表达后的p21蛋白水平的检测. NC:对照组;miR-208a:过表达miR-208a组;anti-NC:阴性对照组;anti-miR-208a:抑制miR-208a组. 两两比较,☆☆☆:P≤0.000 1.图3 miR-208a通过结合p21 3′-UTR下调p21的表达Fig 3 miR-208a down-regulates p21 expression by directly targeting p21 3′-UTR
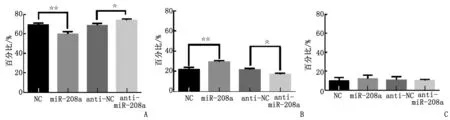
过表达miR-208a和抑制miR-208a表达后, G1期(A)、S期(B)及G2/M期(C)细胞数的变化. 两两比较,☆:P≤0.05,☆☆:P≤0.001.图4 miR-208a促进心肌细胞周期G1-S期的转化Fig 4 miR-208a promotes cell cycle G1/S transition in cardiomyocyte
3 讨 论
miR-208a是miR-208家族成员之一,由α-心肌β-MCH基因的内含子编码。早期的研究发现,在miR-208a转基因小鼠模型中,随着miR-208a的过表达,小鼠心肌细胞体积明显增大,心室壁增厚,出现明显的CH,在此过程中,β-MCH也随着增加。当miR-208a缺失时,甲状腺激素核受体辅助因子(Med13)受到抑制,从而抑制β-MCH的表达,也就不会出现CH[9]。还有研究发现,miR-208a通过靶向作用于CATA结合蛋白4(GATA4),参与CH[19]。miR-208a在CH的机制探讨上,有研究还发现,miR-208a能通过上调内皮素的表达水平而发挥促进CH的作用[20],但是现有的研究仍然没有完全明确miR-208a促进CH的机制。本研究着眼于CH的直观表现——心肌细胞体积增大,通过miR-208a和细胞周期调控因子p21的表达水平,探讨其机制。
由于现有的研究已经明确miR-208a促进CH的进展,所以本研究未建立miR-208a转基因小鼠模型,仅通过主动脉缩窄手术建立CH的小鼠模型,以此检测miR-208a和p21的表达水平。而且近年的研究表明,在大鼠心肌细胞中,通过AngⅡ或血清诱导细胞肥大损伤后,可以看到p21的表达下调,细胞内的DNA和蛋白质合成增多,最终出现CH的表现[21-22]。结合本研究的结果,无论是蛋白质水平,还是RNA水平,p21在CH的小鼠中表达均减少。提示p21可能参与CH的进程。
有学者通过高通量筛选能调控p21表达的miRNA发现,28个miRNA中就包含了心脏特异性表达的miR-208a[11]。结合本研究的结果,在CH的小鼠中,miR-208a的表达增加,且与p21-mRNA负相关。提示miR-208a促进CH的发生、发展可能是通过下调p21的表达来实现的。因此,本研究还在体外设计了可稳定表达miR-208a的心肌细胞株,通过对miR-208a过表达和抑制miR-208a的表达后,对心肌细胞株行Western-blot检测,发现miR-208a可以在转录后水平靶向负调控p21的表达。
p21作为细胞周期负调控因子,下调p21的表达,能够促进细胞周期G1-S期的转化,促使细胞分裂增殖。但由于心肌细胞丧失了有丝分裂的能力,心肌细胞数量并不会增加,表现出的是体积增大(CH)。若miR-208a是通过下调p21的表达来促进CH,miR-208a必然也能促进细胞周期转化。因此,本研究还对体外细胞株使用流式细胞仪进行分析,发现miR-208a过表达后处于G1期的细胞数明显减少,S期数量明显增多,而抑制miR-208a表达后,这种趋势不再存在。这与前期设想是一致的。
综上所述,本研究表明了miR-208a靶向负调控p21的表达,促进细胞周期G1-S期转化,以此参与CH的发生、发展过程,为CH的基因治疗提供新思路。

