葡萄球菌性烫伤样皮肤综合征(SSSS)快速诊断ELISA方法的初步探索*
赖 芸,尤 聪,李立明,李龙年,叶小英
(赣南医学院 1.2017级硕士研究生;2.第一附属医院,江西 赣州 341000)
葡萄球菌性烫伤样皮肤综合征(Staphylococcal Scalded Skin Syndrome, SSSS)是由金黄色葡萄球菌(Staphylococcus aureus, S.aureus)产生的表皮剥脱毒素(Exfoliative Toxin, ET)引起的以皮肤形成浅表水疱、皮肤弥漫性红斑及皮肤大面积剥脱后留有潮红的糜烂面为特征的皮肤病[1-2]。目前临床上没有针对ETA的SSSS快速诊断试剂盒的报道,本实验选择合适的结合方法,将抗体偶联在酶标板上,利用特异性的ETA抗体,体外检测ETA抗原,进行抗原检测的ELISA方法的初步探索。本项目参考乙肝病毒表面抗原诊断试剂盒制备的研究[3]以及布鲁氏菌VirB12蛋白纯化及其抗体ELISA方法的初步建立[4],通过建立合理的抗体偶联固定化方法,初步建立了检测SSSS患者ETA的ELISA方法。
1 材料与方法
1.1材料
1.1.1临床血清样品血清来源于赣南医学院第一附属医院皮肤科2017年-2018年采集的SSSS患者血清、内毒素阳性患者血清及正常人血清(至我院体检的非SSSS患者血清)各7份。患者家属对血样的采集目的知情同意,血样的采集符合赣南医学院伦理委员会标准章程。
1.1.2主要试剂ETA购自武汉爱博泰克生物科技有限公司。Anti-ETA抗体购自南京金斯瑞生物科技有限公司。0.1 mmol·L-1碳酸盐包被缓冲液(0.1 M pH 9.6)、0.01 M磷酸钾缓冲液(PBS pH 7.4)、封闭液5% BSA、包被微孔板、0.1 M磷酸钾缓冲液(PBS pH 6.8)、2.5%戊二醛液、辣根过氧化物酶(HRP)、TMB显色液、阳性对照稀释液(PBS液)、2 M甘氨酸液、蒸馏甘油、透析袋、HRP标记抗体稀释液、PBS洗涤液(PBS干粉 2 L pH 7.2~7.4配制)均购自江西阿普斯戴尔生物科技有限公司。
1.2ELISA方法的建立
1.2.1Anti-ETA固相载体的包被采用方阵滴定法选择包被抗体和酶标记抗体最佳的工作浓度,分别为10 μg·mL-1和1∶100。将Anti-ETA溶解在0.1 M碳酸盐包被缓冲液中,浓度为10 μg·mL-1,100 μL/孔,2~8 ℃放置24 h,弃去孔内旧液,用PBS洗涤液向每孔加入200 μL,洗板3次,拍干,每次3 min,再加入150 μL/孔封闭液,置18~26 ℃封闭2 h,弃去孔内旧液,拍干,置18~26 ℃,干燥不少于12 h。用铝箔袋装好干燥好的抗体板,置4~8 ℃冰箱保存备用。
1.2.2酶标二抗的制备将2 mg ETA抗体(Anti-ETA)与4 mg酶在总体积400 μL的0.1 M磷酸钾缓冲液(pH 6.8)中混合,在4 ℃对0.1 M磷酸钾缓冲液(pH 6.8)透析过夜,用0.1 M磷酸钾缓冲液(pH 6.8)稀释2.5%戊二醛至1%,向混合液中加入50 μL稀释过的戊二醛,在室温下轻搅拌3 h,加入2 M甘氨酸液使甘氨酸最终浓度达到0.1 M,混合液室温放置2 h,以封闭残存的醛基,混合液在4 ℃对0.01 M PBS(pH 7.4)透析过夜,10 000×g 4 ℃离心30 min,将上清移入另一管中,按体积1∶1加入甘油,使终浓度达50%,置-20 ℃保存。
1.2.3Anti-ETA最适包被浓度的确定用0. 1 M 碳酸盐包被缓冲液将Anti-ETA分别稀释成1,2,4,6,8,10 μg·mL-1的浓度梯度,每孔加入100 μL,分别设4孔,4 ℃过夜包被。次日,将酶标板洗涤 3次后,加封闭液封闭。将稀释好的ETA(10 μg·mL-1)、正常人血清各两孔加入100 μL,37 ℃孵育1 h。 洗涤 3次后加入100 μL 1∶100浓度的酶标二抗,37 ℃孵育30 min,洗涤后加入100 μL TMB显色液,避光显色20 min,加入100 μL终止液。在酶标仪上读取OD 450值。
1.2.4酶标抗体最适工作浓度的确定稀释好的ETA(10 μg·mL-1)包被 4 ℃过夜,用PBS洗涤液向每孔加入200 μL,洗板3次,拍干,每次3 min,再用150 μL/孔封闭液,置18~26 ℃封闭2 h,用稀释液稀释酶标抗体成1∶100,1∶200,1∶400,1∶800,1∶1 600,分别加入到反应板中,每个稀释度二孔,每孔100 μL,置37 ℃孵育1 h后洗涤,洗涤后加入TMB显色液和终止液,测定OD 450值。
1.2.5酶标反应板初步测定从包被好的酶标板中随机抽取3条,洗涤3次,加入临床血清样品,每孔 100 μL,同时使用ETA做阳性对照孔,37 ℃孵育1 h后,用洗涤液洗涤3遍,洗涤后加入 100 μL 1∶100浓度的酶标二抗,37 ℃孵育30 min,洗涤后每孔加入TMB底物显色液100 μL,避光显色20 min。 每孔加入100 μL终止液,放入酶标仪测定吸光度值(OD 450值)。
1.2.6酶联免疫吸附剂测定将包被好的ETA抗体反应板取出,置于室温30 min,在对应的微孔内加入校准品(采购的ETA作为阳性对照)、正常人血清、内毒素阳性患者血清、SSSS患者血清各100 μL,37 ℃孵育30 min。弃孔内液体,用稀释好的洗涤液漂洗4次,拍干。每孔加入100 μL酶标液(HRP标记的ETA抗体), 37 ℃孵育30 min,用稀释好的洗涤液漂洗4次,拍干,每孔加入100 μL显色液,避光37 ℃孵育15 min,每孔加入100 μL终止液终止反应。反应终止30 min内,在450 nm处读取吸光度OD值。
2 结 果
2.1ETA抗体包被工作浓度的选择将包被抗体(Anti-ETA)稀释成1,2,4,6,8,10 μg·mL-1的浓度,分别固定在酶标板上,进行酶联免疫吸附测定,得到阴阳性血清的OD值(表1),计算阳性OD值/阴性OD值(P/N值),结果显示,当ETA抗体包被浓度为10 μg·mL-1时,P/N值最高,为4.83,效果最好,所以确定包被抗体最适宜的工作浓度为10 μg·mL-1[4]。
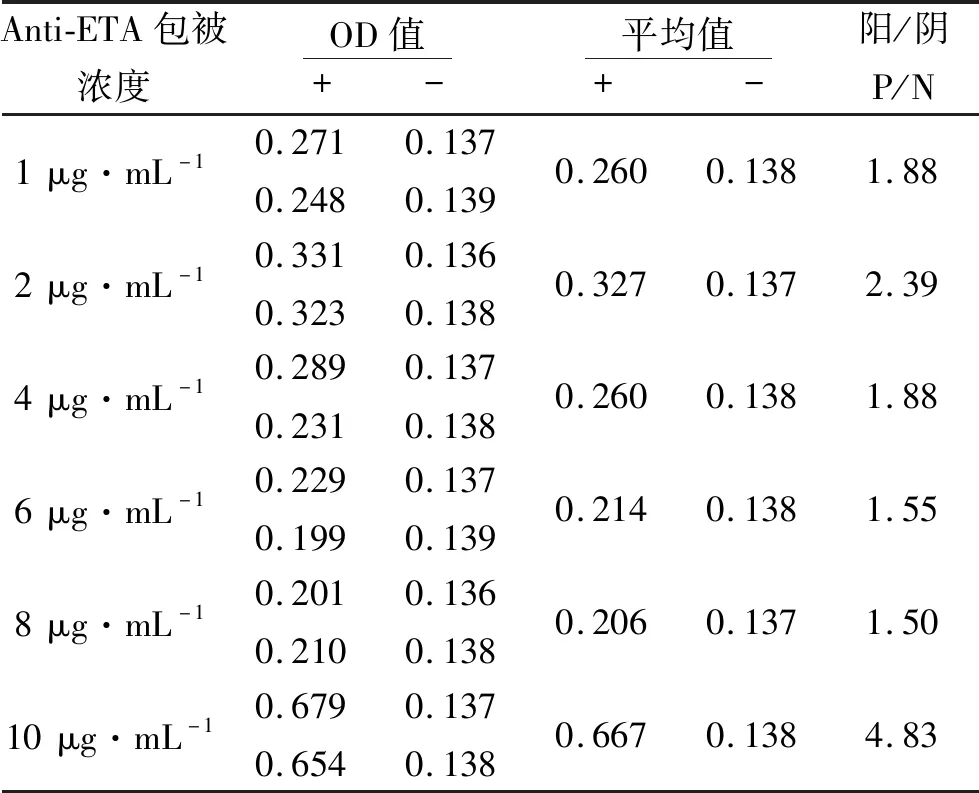
表1 最佳包被浓度的确定
注:“+”表示ETA,“-”表示正常人血清。
2.2酶标二抗工作浓度的选择将包被抗原(ETA)稀释成10 μg·mL-1的浓度,固定在酶标板上,用经过一系列稀释的酶标抗体进行酶联免疫吸附实验,测定OD值(表2),结果显示,酶标二抗稀释倍数为1∶100时OD值最高接近1.0[5],反应效果最好。 在后面的试验中二抗进行100倍稀释。
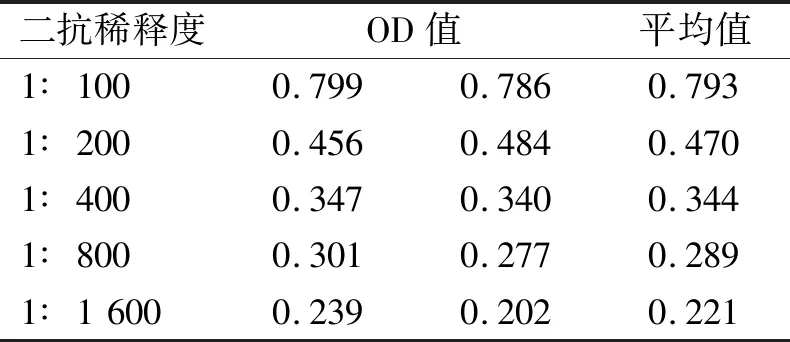
表2 酶标二抗工作浓度滴定
2.3酶标反应板初步测定从包被好的酶标板中随机抽取3条,加入临床血清样品、酶标二抗后显色测定OD值(表3),结果OD 450平均值为0.077,标准差为0.007 9,变异系数为10.3%,提示检测结果较稳定,且变异系数小于15%,显示所制备的酶标板稳定性好,能满足ELISA实验的要求[4,6]。
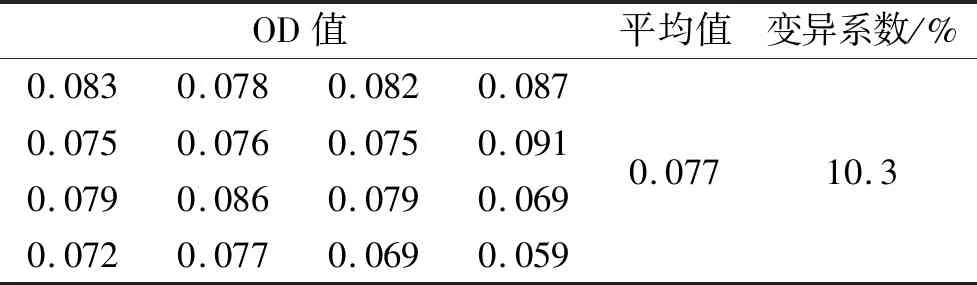
表3 酶标反应板的初步测定
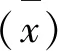
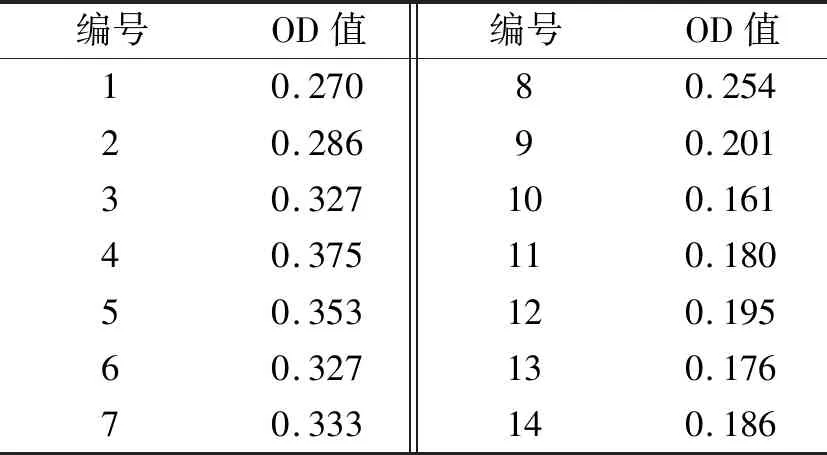
表4 临界值确定
2.5抗体包被板加封闭液与不加封闭液的包被板比较将抗体固定在酶标板上,分别采用患者血清、ETA进行酶联免疫吸附测定(表5)。结果显示,不加封闭液组的OD均值及标准差高于添加封闭液者组,经检验发现,两组总体OD均值差异无统计学意义(t=0.078,P=0.939),OD值的大小反应ELISA显色强度,得出:进行封闭可在一定程度上增强偶联体系的稳定性,且不降低显色反应强度。
2.6临床样品检测采用包被好的ETA抗体反应板,分别对SSSS患者血清、正常人血清、内毒素阳性患者血清进行酶联免疫吸附测定,并进行比较(表6)。

表5 加封闭液与不加封闭液的包被板OD值比较
注:“+”表示ETA,下同。
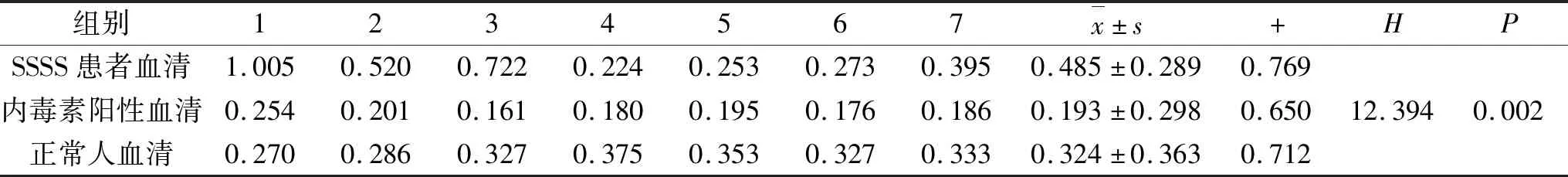
表6 三组临床样品检测的OD值比较
结果得出不同组ELISA检测得出的OD值总体分布不全相同(H=12.394,P=0.002),可以认为不同组的OD值有差别,可以认为不同组的表皮剥脱毒素A的含量不全相同。进一步两两比较得出:SSSS患者血清组与内毒素阳性血清组的OD值有差别(调整后P=0.004);正常人血清组与内毒素阳性血清组的OD值有差别(调整后P=0.012);SSSS患者血清组和正常人血清组的OD值无差别(调整后P>0.05)。
3 讨 论
SSSS主要发生于婴幼儿,但也见于免疫功能低下或肾功能衰竭的成人。本病发病率近年来有明显上升,虽然多数患者在经抗生素治疗后能完全恢复,但部分患者经积极的抗生素治疗仍不能获得满意疗效甚至死亡。本病的预后取决于其快速诊断与及时准确的治疗,但目前SSSS诊断主要依靠临床表现和医生的临床经验。1970年,Melish和Glasgow[7]首次用新生小鼠试验证实金葡菌分泌的ET与 SSSS发病的相关性,随后的研究确定ET是导致SSSS的致病物质[8]。ETA和ETB与人类SSSS的发病有关。编码基因ETA和ETB具有 40%的序列同源性,分别产生242个氨基酸(分子量分别为26.9 kDa)的ETA与246个氨基酸(分子量为27.3 kDa)的ETB[9-11]。ETA和 ETB属丝氨酸蛋白酶[12-13],均可直接作用于表皮颗粒层细胞桥粒,导致细胞间的桥粒连接断裂,从而产生水疱和剥脱。ELISA具有简便快速、不需要特殊的仪器设备、可在短时间内定性或定量检测大量标本的特点。常规的病原学实验诊断、表皮病理检查技术存在耗时长、阳性率不高、检测过程繁琐、有创等缺点[14]。反向被动胶乳凝聚试验(RPLA) 检测ET虽有简单快速的优点,但其特异性差,假阳性率高[15]。目前国外对(ETA/ETB)的快速检测多采用RPLA或PCR扩增ETA/ETB基因的原理,前者有日本生研与美国Thermo科学公司的EXT-RPLA试剂盒,后者以多重PCR的应用为多,需要较繁琐的实验步骤进行DNA提取与目的基因扩增与检测,而国内虽有PCR扩增ETA/ETB基因从而诊断SSSS的实验研究个别报道,但ETA/ETB的ELISA快速检测试剂盒的研究及其临床应用尚属空白。
本研究以抗原抗体结合反应为基础,比较SSSS患者与正常人血清中ETA的含量,为研发一种快速检测SSSS患者血清中ETA的ELISA方法进行初步探索,通过ELISA固相载体的制备、酶标二抗的制备,然后对包被抗体的包被浓度进行滴定,获得了最佳的包被浓度(10 μg·mL-1),对二抗的浓度进行了筛选和优化,选择出最佳工作浓度为1∶100,在条件优化好后,进行酶标板初步检测,评判所制备的酶标板的稳定性,避免因酶标板包被存在的问题影响到结果的判定。通过对已知正常人血清的检测结果及统计学方法确定了临界值,进行了加封闭液与不加封闭液的检测,结果得出封闭液可以使ELISA更加稳定的结论。然后与正常人血清及内毒素阳性患者血清进行比较,得出SSSS患者血清组和正常人血清组OD值无差别,可以认为单纯包被Anti-ETA尚不能作为SSSS的有效检测。该方法的建立,成功测定出SSSS患者血清存在ETA,并与正常人血清及内毒素阳性患者血清进行比较,为SSSS的快速检测试剂盒的建立奠定了基础。在未来的研究中,需加大样本量,并进一步结合Anti-ETB作为共同包被抗体,以期成功研发能够适用于临床的SSSS快速诊断试剂盒。

