无乳链球菌产CMP-唾液酸合成酶发酵培养基优化
(河南科技学院食品学院,河南新乡 453003)
CMP-唾液酸合成酶是合成唾液酸化糖链的关键酶,催化合成唾液酸的激活形态CMP-唾液酸(Cytid5′-monophosphate N-acetyneuraminic acid,CMP-Neu5Ac)[1-2]。唾液酸(N-acetyneuraminic acid,Neu5Ac)在CMP-唾液酸合成酶的催化下与三磷酸胞苷(cytidine triphosphate,CTP)缩合进一步生成CMP-唾液酸,唾液酸的激活形式是一种单磷酸盐的衍生物,最后在唾液酸转移酶(Sialytransferase,ST)的催化下与糖连接形成唾液酸化寡糖[3]。唾液酸化寡糖是一类含有唾液酸的低聚糖[4],具有促进双歧杆菌增值、降低血内毒素及血氨、增强机体免疫力的作用[5],研究者发现唾液酸寡糖作为神经节苷脂的重要组分,可能将成为婴幼儿生长的条件性必需营养素[6-7]。酶催化法合成唾液酸寡糖转化率高、产品纯度高、快速便捷,是合成唾液酸化寡糖最为有效的方法[8-9]。
无乳链球菌是一种广泛分布于自然界的革兰氏阳性菌,属于B群链球菌[10],易引起乳腺炎,其病原体经常存在于奶牛的皮肤、乳头及乳房,并通过挤乳工人和苍蝇传播,是水产生物条件性致病菌,无乳链球菌感染也存在于海水和淡水鱼类,其主要症状为败血症和脑膜炎[11]。催化合成CMP-Neu5Ac的CMP-唾液酸合成酶已在哺乳动物组织和细菌中被发现[12],目前已有产CMP-唾液酸合成酶的大肠杆菌的克隆与高效表达[13-14],Haft[15]发现血清型为Ib的无乳链球菌也可产CMP-唾液酸合成酶且酶活达到1.59×107U/mol,通过前期试验发现无乳链球菌(CICC10465)在基础培养基下酶活仅为(0.507±0.002)×107U/mol,本文通过研究培养温度、碳源、氮源和pH对无乳链球菌产酶的影响,并采用响应面方法[16]对无乳链球菌产CMP-唾液酸合成酶的培养基进行优化,以获得低成本高酶活的培养基,为无乳链球菌产CMP-唾液酸合成酶及其应用奠定了基础。
1 材料与方法
1.1 材料与仪器
无乳链球菌CICC10465 北京北纳创联生物技术研究院商城分理处;NmCSS 山东大学糖工程研究中心;Neu5Ac 宁波经济技术开发区弘翔生化科技有限公司;CTP 杭州美亚药业股份有限公司;脱水小牛脑浸粉、脱水小牛心浸粉、琼脂、蔗糖、甘露糖、葡萄糖、麦芽糖 天津市光复科技发展有限公司;NaCl、Na2HPO4、硫酸铵、MgCl2、聚乙二醇 天津市科密欧化学试剂有限公司。
ZHWY-211C型恒温培养振荡器 上海智诚分析仪器制造有限公司;MB100-4A型微孔板恒温振荡器 杭州奥盛仪器有限公司;ZNCL-B型磁力搅拌器 河南爱博特有限公司;ME104E型电子天平 梅特勒-托利多仪器(上海)有限公司;2011279型立式压力蒸汽灭菌锅 上海博讯实业有限公司医疗设备厂;752N型紫外可见分光光度计 上海精科实业有限公司;INFINITE F50型酶标仪 Tecan Groupltd;Multifuge XIR Centrifuge型台式高速冷离心机 美国Thermo公司;92-IIDN型超声波细胞粉碎机 宁波新芝生物科技有限公司;PHS-3C型pH计 上海盛磁仪器有限公司;P70D20N1P-G50WO型微波炉 广东格兰仕微波生活电器制造有限公司。
1.2 实验方法
1.2.1 培养基的配制 基础培养基(BHI)[17]:脱水小牛心浸粉5.0 g/L、蛋白胨10.0 g/L、脱水小牛脑浸粉12.5 g/L、NaCl 5.0 g/L、葡萄糖2.0 g/L、Na2HPO42.5 g/L、琼脂粉20 g/L、pH7.0±0.2、121 ℃条件下灭菌20 min、培养温度31 ℃。
1.2.2 菌种活化 将无乳链球菌菌种从-80 ℃冰箱转移至无菌操作台,用吸头取少量菌种,在固体培养基平板上采用Z字划线的方法逐步稀释菌液,在31 ℃培养24 h,生长繁殖成单菌落,即得到初步活化的菌种。挑取一环无乳链球菌单菌落至100 mL液体发酵基础培养基中(装液量20 mL),在220 r/min摇床上31 ℃培养过夜,得到二次活化的菌种,再以1%接种量转接于100 mL 液体发酵基础培养基中(装液量20 mL),在220 r/min摇床上31 ℃培养过夜,得到最终活化的菌种。
1.2.3 菌种生长曲线 将菌液在31 ℃恒温振荡的条件下培养24 h。每间隔2 h取出一瓶,使用酶标仪测其在600 nm下的吸光值,并取其平均值,以时间为横坐标,OD600值为纵坐标,绘制生长曲线。
1.2.4 CMP-唾液酸合成酶液的制备 将20 mL菌液离心(8000 r/min,30 min)倒掉上清,用20 mL 50 mmol/L Tris-HCl缓冲液(pH8.0)悬浮菌体,置于冰上超声破碎细胞。离心(8000 r/min,30 min)去除细胞碎片,向上清液中缓慢加入固体硫酸铵,收集35%~60%饱和度的沉淀。将沉淀溶于20 mL 50 mmol/L Tris-HCl缓冲液(pH8.0)中,用2 L的含0.1 mol/L NaCl的50 mmol/L Tris-HCl的缓冲液(pH7.6)透析,每4 h更换一次透析液,透析液不浑浊即可终止透析。将透析所得的粗酶液用聚乙二醇浓缩,进一步用离子交换柱DEAE-52(2.5cm×30cm)纯化。用含0.1 mol/L NaCl的50 mmol/L Tris-HCl缓冲液(pH7.6)平衡柱子,上样后,先用一个柱体积的平衡缓冲液洗脱掉未结合的蛋白。然后用2L同样缓冲液配置的0.10~0.25 mol/L NaCl分别进行梯度洗脱,以上各步骤均在4 ℃下进行。
1.2.5 单因素试验
1.2.5.1 温度对菌株发酵的影响 分别在温度28、31、34、37、40 ℃下采用液体发酵基础培养基培养培养24 h 后,检测并计算酶活及细胞干重得到。得到的最佳培养温度直接应用到以下单因素试验中。
1.2.5.2 碳源对菌株发酵的影响 分别以0.20% 的蔗糖、麦芽糖、甘露糖、葡萄糖为液体发酵基础培养基中的碳源,考察不同碳源对无乳链球菌产酶酶活和细胞干重的影响。
1.2.5.3 蔗糖浓度对菌株发酵的影响 分别以 0.05%、0.10%、0.15%、0.20%、0.25%、0.30%蔗糖浓度为液体发酵基础培养基中的碳源浓度,考察不同蔗糖浓度对无乳链球菌产酶酶活和细胞干重的影响。
1.2.5.4 氮源浓度对菌株发酵的影响 分别以2.25%、2.50%、2.75%、3.00%、3.25%为液体发酵基础培养基中的氮源(脱水小牛心浸粉、蛋白胨、脱水小牛脑浸粉混合氮源)浓度,考察不同氮源浓度对无乳链球菌产酶酶活和细胞干重的影响。
1.2.5.5 pH对菌株发酵的影响 分别以5.5、6.0、6.5、7.0、7.5、8.0为液体发酵基础培养基中的pH,考察不同pH对无乳链球菌产酶和细胞干重的影响。
1.2.6 响应面试验优化 根据单因素试验结果,选取蔗糖浓度(A)、氮源浓度(B)、pH(C)为三个因素,为获得低成本高酶活的产CMP-唾液酸合成酶培养基,用酶活作为响应值,进行中心组合试验设计。每组试验重复3次,取其平均值,响应面试验水平如表1所示,得出最优的蔗糖浓度、氮源浓度和pH,以此确定无乳链球菌培基最优配方。
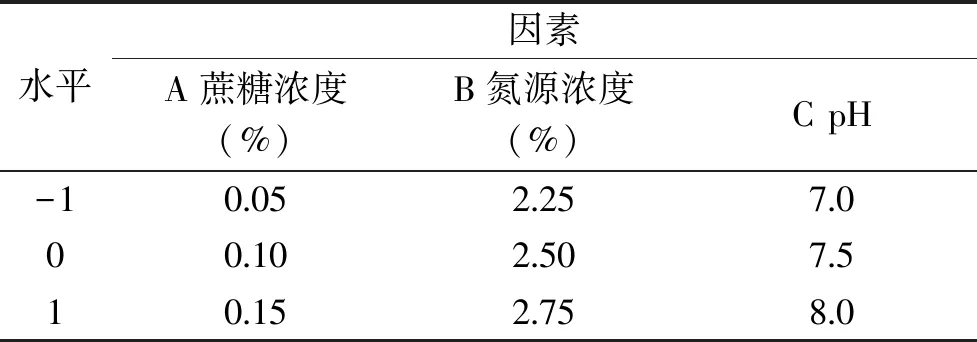
表1 响应面的因素水平表Table 1 Factors and levels of response surface design
1.2.6 细胞干重的测量 菌液在8000 r/min的转速下离心10 min,倒掉上清液,在45 ℃干燥24 h后称重,得到菌种细胞干重(DCW),无乳链球菌的吸光值与细胞干重的线性回归曲线为y=0.3781x-0.0108(R2=0.9987),说明二者相关性较好
1.2.7 酶活的检测 采用硫代巴比妥酸测酶活[18]250 μL反应体系中含有5.5 mmol/L CTP,2.8 mmol/L唾液酸,0.2 mol/L Tris-HCl(pH9.0),20 mmol/L MgCl2和0.2 mmol/L DTT(Dichlorodiphenyltrichloroethane)。在37 ℃保温1 h,加入50 μL 1.6 mol/L NaBH4置于室温15 min,用于还原剩余的唾液酸。然后加入50 μL 6.7 mol/L H3PO4置于0 ℃ 5 min,用于消除剩余的NaBH4,于37 ℃水浴中保温10 min,用来断裂CMP-唾液酸中的磷脂键。加入50 μL 0.02 mol/L NaIO4来氧化解离下来的唾液酸,置于室温10 min。加入400 μL溶于0.5 mol/L HCl的4% NaAsO2,再加入1 mL溶于0.5 mol/L NaSO4的0.6% 2-硫代巴比妥酸,于沸水中加热15 min。加入1 mL环己酮,将液相的粉红色萃取至有机相,将有机相在549 nm比色。酶的活力单位定义为在37 ℃ 1 min内催化生成1 μmol CMP-唾液酸的酶量。
1.3 数据处理
每组试验重复3次,取平均值。采用origin 9.60对测定数据作图,采用SPSS 17.0进行单因素方差分析与显著性差异分析,Design-Expert 8.0.5进行Box-Behnken响应面试验设计。
2 结果与分析
2.1 无乳链球菌的生长曲线
在基础培养条件下,以时间为横坐标,OD600为纵坐标,绘制无乳链球菌的生长曲线。如图1所示,可知无乳链球菌在0~2 h为生长延迟期,在2~12 h为生长对数期,12~24 h为稳定期。因此,选择无乳链球菌生长至24h测定酶活及细胞干重。

图1 无乳链球菌的生长曲线图Fig.1 Growth curve of Streptococcus agalactiae
2.2 单因素试验结果
2.2.1 温度对无乳链球菌产酶的影响 温度是影响微生物生长最重要的因素之一[19]。由图2可以看出,随着培养温度的增加,酶活先升高后降低,34 ℃时酶活最大,为(1.312±0.025)×107U/mol,这是因为适宜的培养温度有利于提高微生物细胞内酶反应速率,从而提高了细胞的合成速率。当培养温度升高至34、37、41 ℃时细胞干重依次升高,但酶活却下降,这是因为温度升高有利于细胞膜的流动性和物质的运输,加快了细胞的繁殖速率[20],但仅有利于菌株的繁殖而不利于代谢产酶,因此不能提高菌液浓度而忽略了菌体产酶的活性。34 ℃为无乳链球菌的培养温度响应面设计的零水平,这与陈贺等[21]的研究结果相符。
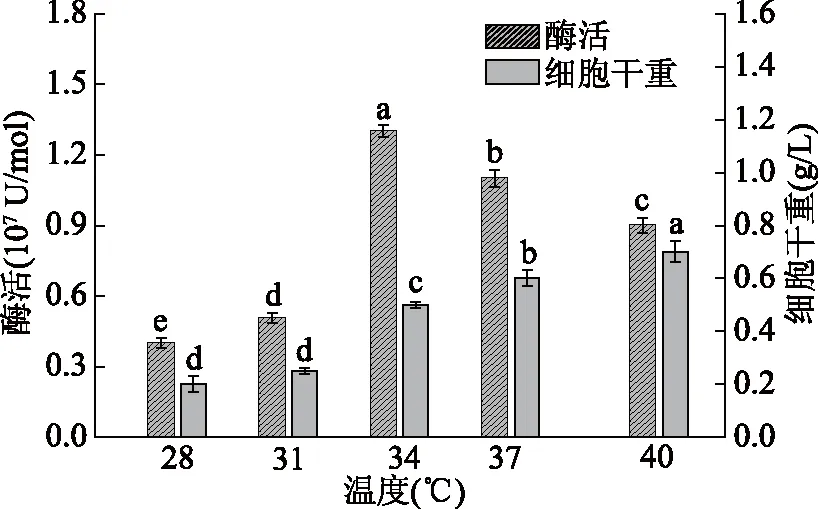
图2 不同温度对菌株产NmCSS酶活及细胞干重的影响Fig.2 Effect of different temperatureson NmCSS activity and dry weight of cell注:图中不同字母表示差异显著,P<0.05;图3~图6同。
2.2.2 碳源种类对无乳链球菌产酶影响 碳源是组成细胞骨架和细胞生命活动所需的能量,可提供合成产物的碳架,为微生物或细胞的正常生长、分裂提供物质基础,除了葡萄糖外,蔗糖、甘露糖、麦芽糖等天然有机化合物也可以作为碳源,用于微生物生长和生产[22]。由图3可知,菌株能利用不同的碳源产CMP-唾液酸合成酶,不同种类的碳源对CMP-唾液酸合成酶的活性具有显著性影响(P<0.05)。以蔗糖为碳源时菌株的细胞干重和CMP-唾液酸合成酶酶活达到了最高水平,细胞干重达到(1.821±0.035) g/L、酶活达到(3.611±0.016)×107U/mol,且发酵液粘稠度高。而师红亚等[23]得出的无乳链球菌(WC04152)的最适碳源是葡萄糖,与本文结论不同的原因可能是是菌株来源、所处的生长环境及内部代谢途径的不同[24-25]。综上所述,本实验选择蔗糖作为培养基的最佳碳源。

图3 碳源种类对菌株产NmCSS酶活及细胞干重的影响Fig.3 Effect of carbon source specieson NmCSS activity and dry weight of cell

图4 蔗糖浓度对菌株产NmCSS酶活及细胞干重的影响Fig.4 Effect of sucrose concentrationon NmCSS activity and dry weight of cell
2.2.3 蔗糖浓度对无乳链球菌产酶影响 由2.2.2可知无乳链球菌培养基最佳碳源为蔗糖,不同浓度的蔗糖对菌株CICC 10465产酶酶活的影响如图4所示,随着蔗糖浓度的增加酶活与细胞干重均呈现先升高后降低的趋势,当蔗糖浓度为0.10%、0.15%,酶活达到(1.521±0.030)×107U/mol和(1.411±0.011)×107U/mol,二者无显著差异(P>0.05),综合比较应选择蔗糖浓度响应面零水平为0.10%。
2.2.4 氮源浓度对无乳链球菌产酶影响 液体发酵基础培养基中的氮源主要是有机的氮源,能为微生物生长及合成核昔酸、维生素提供氮元素[26-27],菌体生长及代谢产物的生成需要合适的氮源浓度。不同氮源浓度对菌株CICC 10465产酶酶活的影响如图5所示,随着氮源浓度的升高酶活与细胞干重先上升后以平稳的趋势下降,氮源浓度为2.50%时最大,当氮源浓度为2.50%时酶活达到(4.351±0.030)×107U/mol、细胞干重达到(2.263±0.004) g/L,显著高于其他处理组(P<0.05)。所以培养基中的氮源浓度应调节至2.50%。

图5 氮源浓度对菌株产NmCSS酶活及细胞干重的影响Fig.5 Effect of nitrogen source concentrationon NmCSS activity and dry weight of cell
2.2.5 pH对无乳链球菌产酶影响 为满足微生物的生长繁殖和产生代谢产物,培养基pH必须控制在一定的范围内。由图6可知,当把培养基pH调节至7.5时酶活达到最大(3.023±0.055)×107U/mol、细胞干重也达到最大(1.721±0.004) g/L,显著高于其他处理组(P<0.05)。pH调节至酸性时酶活和细胞干重下降,这是由于无乳链球菌在生长过程中分解碳源产酸,酸性环境不适合其生长[21],pH调节至碱性8.0时,细菌菌体容易衰老和死亡也不利于细菌生长[21],梁琳琳等[28]报道了B群链球菌的pH影响原生质膜所带电荷的极性和渗透性,如一些极性营养物质脂肪酸、氨基酸的解离吸收会受到影响,从而影响细胞代谢繁殖和产酶,这说明酸度适宜的外环境有利于微生物的繁殖代谢和产酶。这也与田海燕等[29]的研究结果一致,因此,应该将培养基pH设为7.5作为响应面零水平。
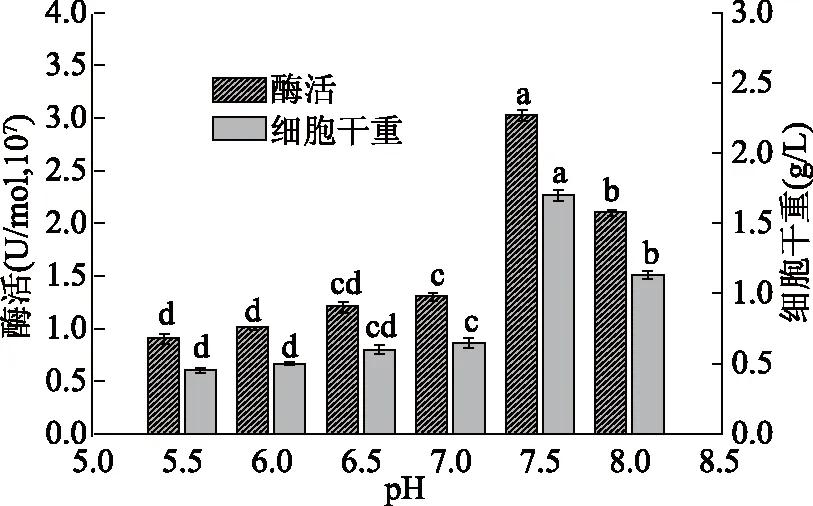
图6 pH对菌株产NmCSS酶活及细胞干重的影响Fig.6 Effect of pH on NmCSS activity and dry weight of cell
2.3 无乳链球菌产CMP-唾液酸合成酶发酵工艺响应面实验结果
2.3.1 响应面实验设计及结果 响应面试验结果及分析利用Design-Expert 8.0.5中Box-Behnken对无乳链球菌产CMP-唾液酸合成酶发酵工艺进行优化实验设计及分析,其响应面实验方案及结果见表2,方差分析结果见表3。

表2 响应面试验设计及结果Table 2 Results of response surface test
2.3.2 回归方程及参数分析 回归拟合后,可从各测试因素对响应值的影响得出拟合方程:
酶活Y=5.880×107-4.608×105A-5.070×105B-4.657×105C-3.848×105AB-1.286×105AC-250.00BC-2.735×107A2-2.818×107B2-2.817×107C2。
对该回归模型进行方差分析,结果如表3所示,回归模型的P<0.0001,失拟项的P=0.0987,模型极显著,失拟项不显著,说明模型可靠。R2=0.9992,该模型拟合程度较好,很好的反映酶活与培养基的蔗糖浓度、氮源浓度、pH之间的关系。通过回归方程系数显著性可知:模型的二次项A2、B2、C2为极显著,P<0.01。
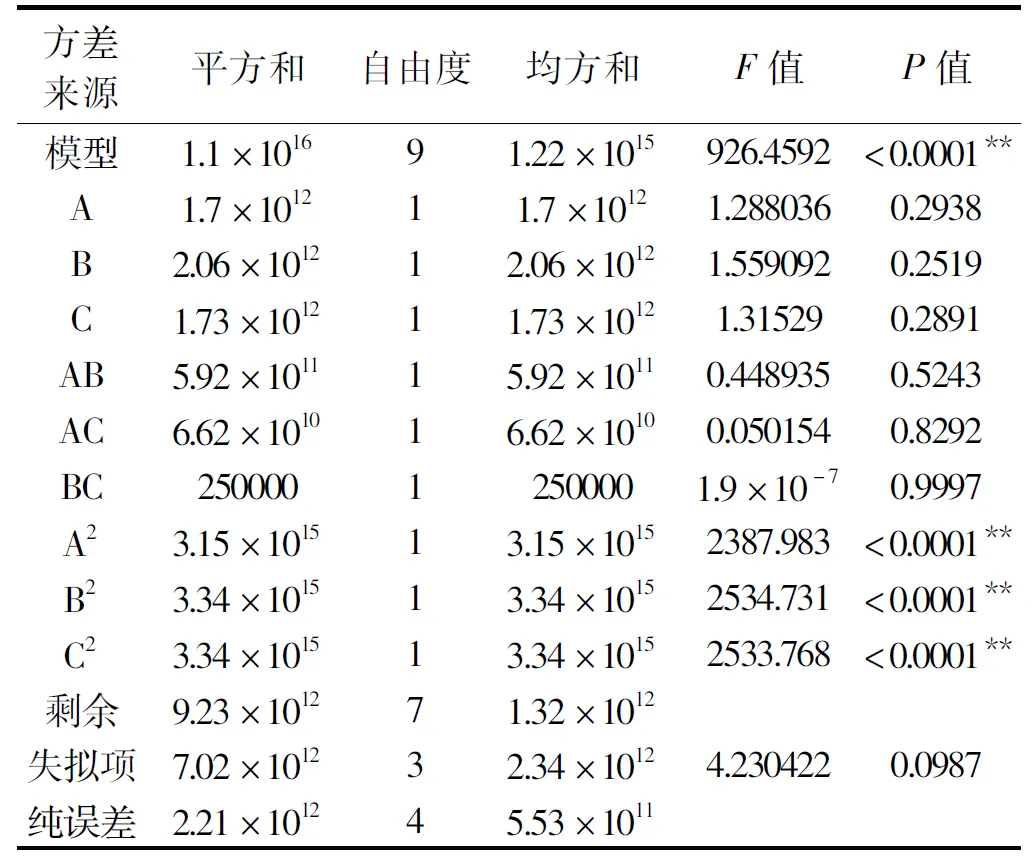
表3 回归方程方差分析Table 3 Analysis of variance table of regression model
注:*:P<0.05,差异显著;**:P<0.01,差异极显著。
2.3.3 响应面优化及分析 利用响应面分析法可以得到三维空间图形。它们之间的相互作用可以从试验所得的响应图中分析得出,从图7~图9分析可知无乳链球菌产CMP-唾液酸合成酶酶活与发酵培养基蔗糖浓度、氮源浓度、pH这三个因素的相互关系。
通过2.3.3中的表3可知,蔗糖浓度与氮源浓度的交互作用显著。通过图7a可以发现,蔗糖浓度调节到较低或者较高水平时,随着氮源浓度的增加酶活呈现先增加后降低的变化趋势;说明蔗糖浓度对酶活作用受氮源浓度的影响。当氮源浓度在较低水平或者较高水平时,随着蔗糖浓度的增加酶活呈先增加后减少的趋势。说明氮源浓度对酶活作用受蔗糖浓度的影响。由图7b可知,最大的酶活值为4.932×107U/mol。
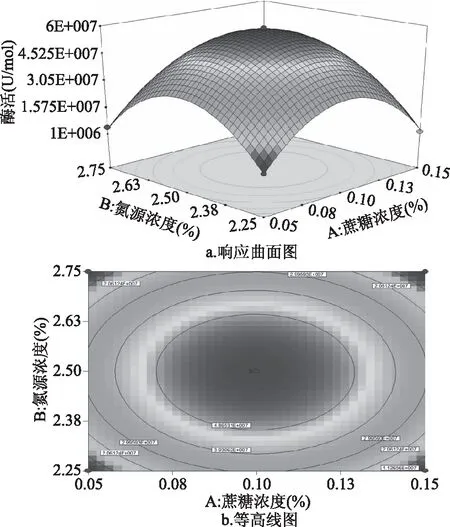
图7 蔗糖浓度与氮源浓度交互影响酶活的曲面图Fig.7 Response surface diagram of the interactionbetween sucrose concentration and nitrogensource concentration on enzyme activity
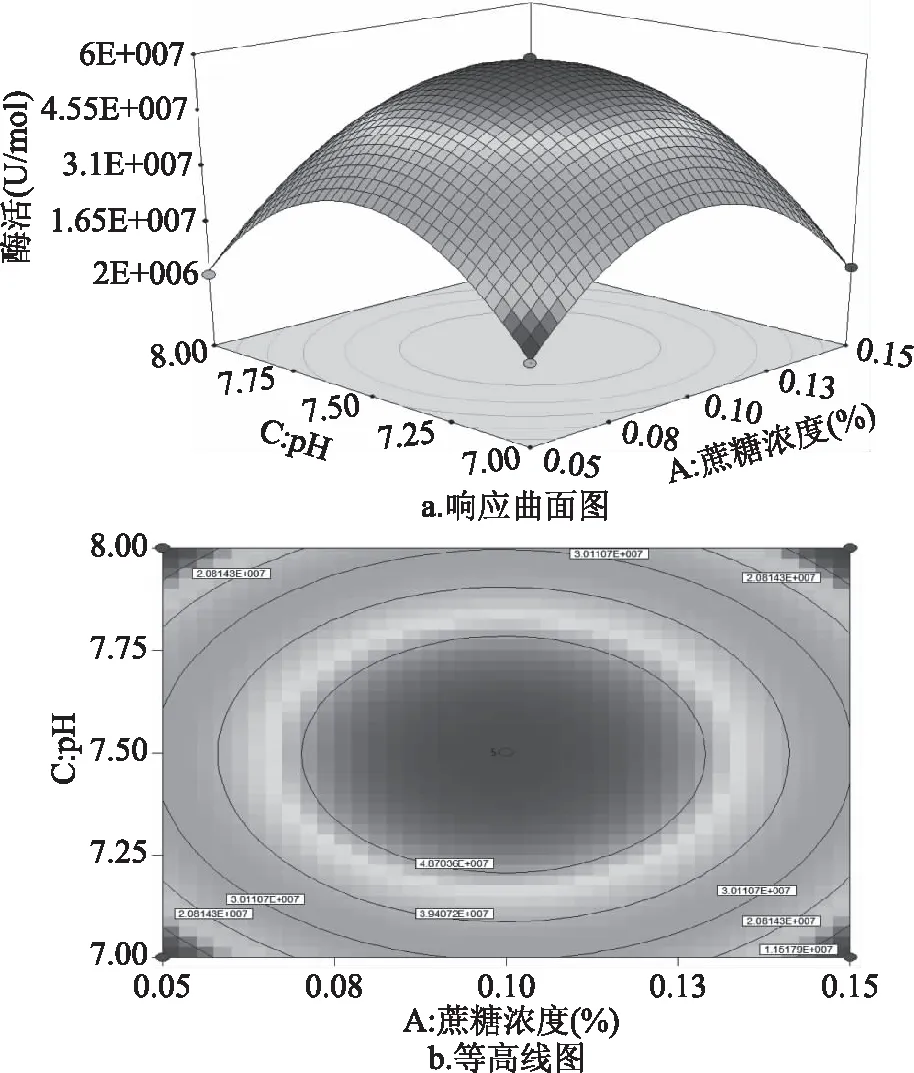
图8 蔗糖浓度与pH交互影响酶活的曲面图Fig.8 Response surface diagram of the interactionbetween sucrose concentration and pH on enzyme activity
如图8所示,蔗糖浓度与pH交互影响酶活的曲面图及等高线图。当把pH调节为7~8水平之间时,可以看出跟随着蔗糖浓度的增多,酶活变化趋势均为先升高再降低;反之,如果调节蔗糖浓度处于0.05%~0.15%水平变化时,可以观察到随着pH的增大酶活变化趋势均也为先升高再降低。由此可说明说明在我们的试验中蔗糖浓度与pH具有相互作用。由图8b可知,最大的酶活值为4.937×107U/mol。
如图9所示,氮源浓与pH交互影响酶活的曲面图及等高线图。当把pH调节为7~8水平之间时,可以看出跟随着氮源浓度的增多,酶活变化趋势均为先升高再降低;反之,如果调节氮源浓度处于2.25%~2.75%水平变化时,可以观察到跟随着pH的增大,酶活变化趋势均为先升高再降低。由此可说明说明在我们的试验中氮源浓度与pH具有相互作用。由图9b可知,最大的酶活为4.924×107U/mol。
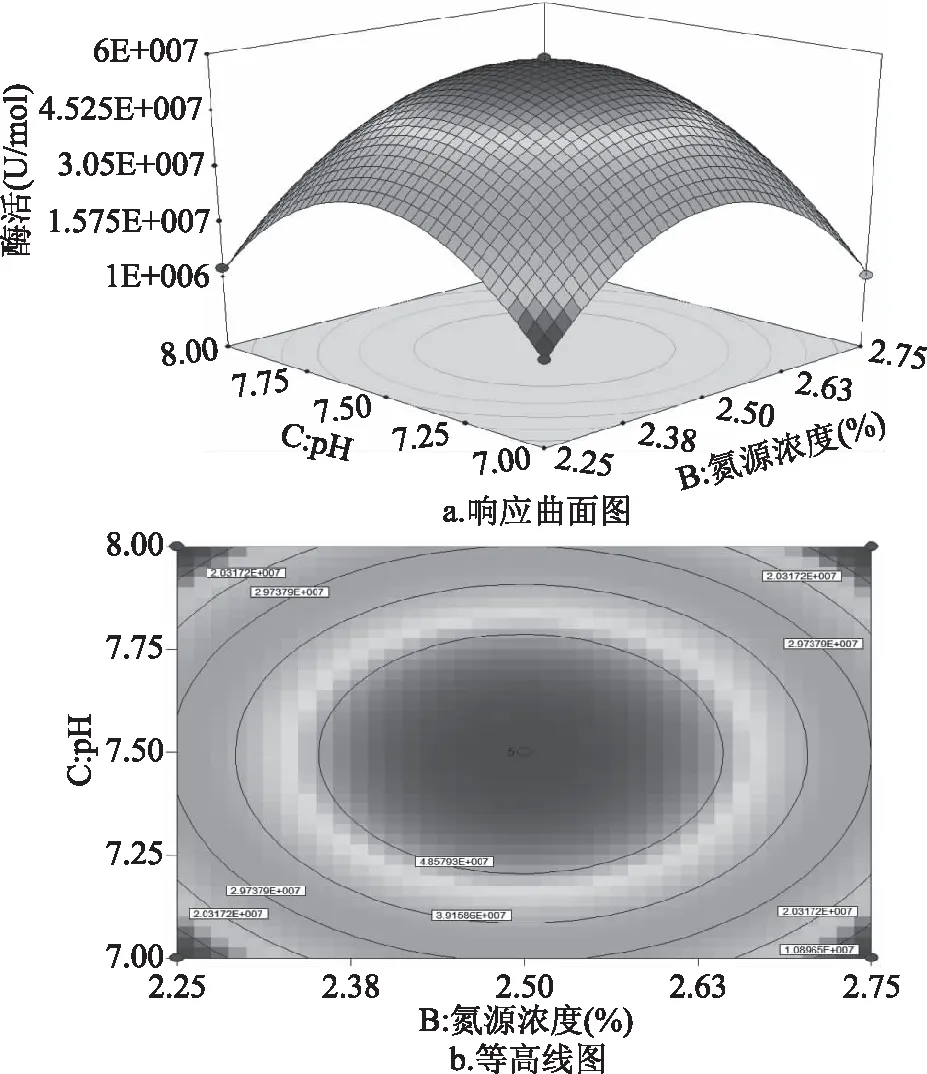
图9 氮源浓度与pH交互影响酶活的曲面图Fig.9 Response surface diagram of the interaction betweennitrogen sucrose concentration and pH on enzyme activity
2.3.5 验证实验 用Design Expert 8.0.5软件分析,得出最适发酵培养基为蔗糖浓度为0.10%,氮源浓度为2.44%,pH为7.42,此时预测酶活为5.881×107U/mol。为了验证回归方程的准确性,利用优化后培养基的条件(蔗糖浓度为0.10%,氮源浓度为2.50%,Na2HPO42.5 g/L、NaCl 5.0 g/L、培养温度为34 ℃、pH为7.50)进行3次重复性试验,酶活为(5.895±0.005)×107U/mol。试验值与模型预测值偏差仅0.014×107U/mol,表明该回归模型预测值与实验值拟合性好,可用该模型对酶活进行预测,同时优化后的酶活(5.895±0.005)×107U/mol)比优化前(0.507±0.002)×107U/mol)提高了10.627倍,说明本试验优化的培养基明显提高了酶活。
3 结论
通过无乳链球菌(CICC10465)培养工艺条件的单因素试验及Box-Behnken响应面设计试验,分析得到的产酶培养条件为:蔗糖浓度为0.10%,氮源浓度为2.50%,Na2HPO42.5 g/L、NaCl 5.0 g/L、培养温度为34 ℃、pH为7.50,酶活达到(5.895±0.005)×107U/mol,较优化前培养基产酶酶活(0.507±0.002)×107U/mol 提高了10.627倍,Haft R F[15]发现血清型为Ib的GBS产CMP-唾液酸合成酶的酶活达到1.59×107U/mol,而本实验优化的到的酶活为(5.895±0.005)×107U/mol,这可能是因为菌株差异不同导致,也说明此次对酶活的优化是很有意义的。

