金耳脂类粗取物促进伊文氏蓝透过血脑屏障的研究
刘娜丽,李久长2,郭春燕3,郭 芸
(1.山西药科职业学院,山西太原 030031;2.山西大学生命科学学院,山西太原 030006;3.山西省生物研究院有限公司,山西太原 030006)
金耳(Tremellaaurantialba),又称脑耳、黄木耳等,为真菌界担子菌门担子菌纲银耳目银耳科银耳属黄木耳的子实体,是一种营养价值较高的食药兼用菌[1]。有人提出金耳是“中国最新发现最有价值之大补品”。金耳富含碳水化合物、蛋白质、脂肪、矿物质、维生素等营养成分,虽然蛋白质含量不高,但人体所必需的8种氨基酸氨基酸含量丰富,比例接近人体需要[2]。除了具有高的营养价值,金耳还具有抗氧化[3-4]、提高机体免疫力[5]、调节血糖、降血脂、降胆固醇、保护肝脏、抗肿瘤[6]、抗病毒、抗凝血[7]等作用,因而金耳在食品及药品方面有很好的开发前景及应用价值。目前已经开发出的功能性金耳食品有金耳功能性酸奶、金耳玫瑰保健饮料等,都有一定的保健营养作用[8-9],已经研究出的金耳糖肽胶囊药品,已用在临床上治疗脑血管疾病[10]。虽然目前国内外对于金耳的营养价值及药用价值都进行了大量的研究,但是金耳功能的研究主要集中在多糖方面[11-12],金耳脂类成分是否具有一些药用功能,还未见有报道。
血脑屏障是中枢神经系统特有的结构,一方面允许血液循环中脑组织所需营养物质的通过,另一方面能阻挡有害物质的侵入。但是由于血脑屏障的存在,使药物很难到达病灶发挥作用,因而血脑屏障的存在使中枢神经系统疾病的治疗成为难点[13-14]。目前研究发现一般脂溶性高、分子量小的物质容易通过血脑屏障[15]。而大多数治疗中枢神经系统疾病的药物为水溶性的,正常情况下入脑量甚微。因而寻找脂溶性高、副作用小且能促进治疗药物通过血脑屏障的物质,目前在国内外日益受到关注[16]。在现代研究中,发现不少中药或其单体自身能迅速通过血脑屏障发挥治疗脑内疾病的作用,如冰片、麝香、天麻、薄荷等中药材都有开放血脑屏障的功能[17-19]。而冰片促进药物透过血脑屏障的作用尤为明显[20-22]。因此本文选择冰片与金耳脂类粗提物进行透过血脑屏障的对比研究。
血脑屏障通透性的检测方法有示踪剂法、影像学法、透射电镜法等。示踪法可以对一些具有特殊物理化学特性的物质通过血脑屏障进行特殊描述。伊文氏蓝是一种经典的血脑屏障示踪剂,入血后,几乎百分之百地立即与血浆白蛋白结合,形成伊文氏蓝-白蛋白复合物(ESA),并持续数小时存在于血液中,而且伊文氏蓝在632nm处有最大吸收光谱,根据此特点可以利用分光光度计进行血脑屏障的定性定量检测[23]。因此本研究选用甲酰胺-紫外分光光度计检测脑组织中的伊文氏蓝含量,作为判断血脑屏障开放程度的一种定量指标。
综上,本文将金耳提取得到的金耳脂类粗取物,进行促进伊文氏蓝透过血脑屏障的研究和冰片进行透过血脑屏障的对比研究,旨在研究金耳脂类作为载体可携带药物通过血脑屏障发挥治疗作用,为今后金耳脂类的功能开发,以及将金耳制备成功能食品提供科学依据。
1 材料与方法
1.1 材料与仪器
金耳(Tremellaaurantialba) 取自中条山腹地;伊文氏蓝(SCRC) 国药集团化学试剂有限公司;甲酰胺 天津市大茂化学仪器供应站;吐温80 天津市化学试剂三厂;石蜡油 广州市德隆化工贸易有限公司;冰片 河南万博化工产品有限公司;其余试剂 均为分析纯及常用试剂;昆明种雄性健康小鼠156只(20±2 g) 许可证号:SCXK(晋)2015-0001,山西医科大学提供。
HH-4数显恒温水浴锅 国华电器有限公司;JA1003型电子天平 上海良平有限公司;DHG-9240 A型电热恒温鼓风干燥箱 上海精宏实验设备有限公司;SP-2000UV型紫外可见分光光度计 上海光谱仪器有限公司;TGL-16G高速台式离心机 上海安亭科学仪器厂制造;细胞组织匀浆器 北京博奥森技术有限公司;CTX-50型浴式超声仪 北京医疗设备二厂;涡悬振荡器 上海医科大学仪器厂。
1.2 实验方法
1.2.1 金耳脂类粗取物的制备 将金耳置于烘箱65 ℃干燥24 h,粉碎过60目筛,取粉末适量,以10倍量的石油醚为提取溶剂,用连续回流法提取两次,第一次4 h,第二次2 h,合并两次提取液减压浓缩,得到金耳脂类粗取物[24]。
1.2.2 金耳脂类粗取物与伊文氏蓝混合物的制备 1%的伊文氏蓝液的配制:称取伊文氏蓝适量,以生理盐水为溶剂,配制成伊文氏蓝液含量1%的溶液;
5%的金耳脂类粗取物的配制:称取金耳脂类粗取物,取等量的吐温80做乳化剂,再用生理盐水配制成金耳脂类粗取物含量5%的溶液,最后超声使之分散成均匀的乳剂;
5%金耳脂类粗取物伊文氏蓝混合液的配制:称取所需的金耳脂类粗取物量,取等量的吐温80做乳化剂,再加入称好的伊文氏蓝,最后用生理盐水逐渐稀释至伊文氏蓝含量为1%、金耳脂类粗取物含量为5%的混合液,最后超声使之分散成均匀的乳剂;
5%的冰片石蜡油的配制:以液体石蜡为溶剂配制成所需浓度。
1.2.3 伊文氏蓝含量测定方法的建立 采用甲酰胺提取-紫外分光光度法[25]。称取4 mg伊文氏蓝于容量瓶中,加生理盐水至总容积为25 mL,取0.3 mL加入5.7 mL甲酰胺中混匀作为第1管;从第1管中取3 mL加入3 mL甲酰胺中作为第2管;将第2管溶液对半稀释作为第3管;依此类推共作6管,其浓度依次为8、4、2、1、0.5、0.25 μg/mL。于37 ℃水浴震荡提取72 h后,在632 nm处测定吸光度,绘制标准曲线。
1.2.4 给药方式对其促透作用的影响
1.2.4.1 分开给药与混合给药的影响 取昆明种小鼠24只,体重20±2 g,随机分为3组,每组各8只,3组分别为对照组、分开给药组、混合给药组。小鼠进行适应性饲喂2 d后,空腹12 h后用药,对照组注射1%的伊文氏蓝液0.1 mL/10 g;分开给药组尾静脉注射1%伊文氏蓝0.1 mL/10 g,腹腔注射5%的金耳脂类粗取物液0.1 mL/10 g;混合给药组尾静脉注射5%金耳脂类粗取物伊文氏蓝混合液0.1 mL/10 g[26]。
各组分别于注射后的2、4 h取脑,并用生理盐水清洗残留的血液然后匀浆,取脑右半球组织匀浆,按2 mL/100 mg加甲酰胺,然后于37 ℃恒温水浴振摇72 h,3000 r/min离心15 min,取上清液在632 nm处测定其吸光度,根据标准曲线计算脑组织中伊文氏蓝浓度[25]。
1.2.4.2 灌胃与注射给药的影响 取24只小鼠随机分为3组,每组各8只,即对照组(Ⅰ)、灌胃组(Ⅱ)、注射组(Ⅲ)。小鼠进行适应性喂养2 d后于同一时间用药,其中Ⅰ组注射1%伊文氏蓝液0.1 mL/10 g,Ⅱ组灌胃5%金耳脂类粗取物伊文氏蓝混合液0.1 mL/10 g、Ⅲ组注射金5%耳脂类粗取物伊文氏蓝混合液0.1 mL/10 g[22],其余方法同1.2.4.1。
1.2.5 给药量对其促透作用的影响 取60只小鼠随机分为3组,每组各20只,即对照组(Ⅰ)、金耳脂类粗取物低剂量组(Ⅱ)、金耳脂类粗取物高剂量组(Ⅲ),小鼠进行适应性饲喂2 d后,并于同一时间分别尾静脉注射溶液,Ⅰ组注射1%伊文氏蓝液0.1 mL/10 g,Ⅱ组注射5%金耳脂类粗取物伊文氏蓝混合液0.1 mL/10 g、Ⅲ组注射金耳脂类粗取物5%伊文氏蓝混合液0.15 mL/10 g[22]。
各组分别于注射后的0.25、0.5、1、2、4 h取脑及肝、脾,并用生理盐水清洗残留的血液然后匀浆,取脑右半球匀浆,其中脑和肝按2 mL/100 mg加甲酰胺,脾按4 mL/100 mg加甲酰胺,其余方法同1.2.4.1。
1.2.6 金耳脂类粗取物与冰片促进伊文氏蓝的对比研究 取48只小鼠随机分为3组,每组各16只,即对照组(Ⅰ)、金耳脂类粗取物组(Ⅱ)、冰片组(Ⅲ),小鼠进行适应性饲喂2 d后于同一时间分别尾静脉注射溶液,Ⅰ组注射1%伊文氏蓝液0.1 mL/10 g,Ⅱ组注射5%金耳脂类粗取物伊文氏蓝混合物0.1 mL/10 g、Ⅲ组灌胃冰片石蜡油液0.1 mL/10 g,随后尾静脉注射伊文氏蓝液0.1 mL/10 g[27]。
各组分别于注射后的0.5、1、2、4 h取脑,并用生理盐水清洗残留的血液然后匀浆,取脑右半球匀浆,按2 mL/100 mg加甲酰胺,其余方法同1.2.4.1。
1.3 数据处理
采用SPSS Statistics对研究结果进行统计分析,计量数值采用均数±标准差表示,组间比较采用ANOVA分析,检测不同组与对照组之间的差异显著性。
2 结果与分析
2.1 伊文氏蓝标准曲线绘制
由图1可知,各组织中伊文氏蓝的浓度在0~8.0 mg/L时,提取液的吸光度与浓度呈良好的线性关系,y=0.0522x-0.0151,R2=0.9988,说明用甲酰胺提取-紫外分光光度法测定小鼠各脏器中伊文氏蓝的浓度,重现性好,能有效地减少脏器中残留血迹含有的非测定性成分产生的荧光对测定的干扰。
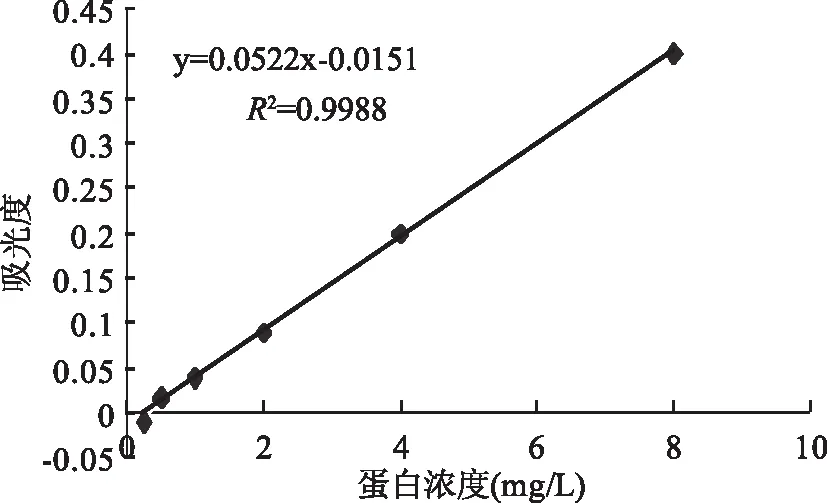
图1 伊文氏蓝标准曲线Fig.1 Evans Blue standard curve
2.2 分开给药与混合给药对透过脑组织的伊文氏蓝浓度影响
由表1结果可以看出,与对照组相比,混合给药组在给药后2、4 h均有显著性差异(P<0.05),而分开给药组仅在4 h时有显著差异(P<0.05)。两组脑组织匀浆中伊文氏蓝的浓度明显高于对照组,在用药2 h时,混合给药组脑组织内伊文氏蓝的浓度达到13.25 μg/g,远高于对照组伊文氏蓝的浓度4.20 μg/g,同时结果显示混合给药法相比较分开给药法,具有能在短时间内达到较高浓度、代谢期较长的优点。因而表明此类金耳脂类粗取物具有促进伊文氏蓝透过血脑屏障进入脑组织的作用,且给药方式以混合给药法效果较好。
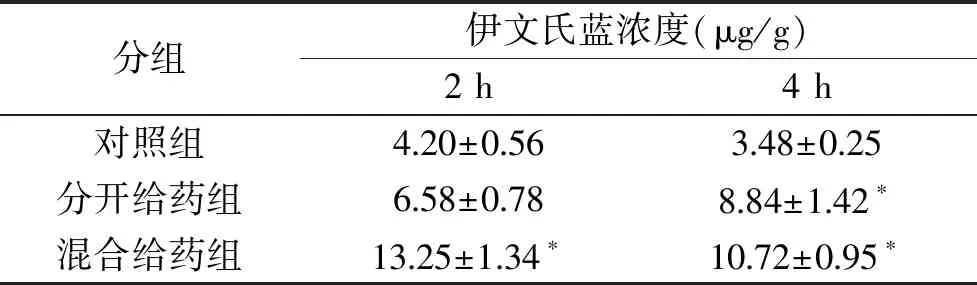
表1 分开给药与混合给药对金耳脂类粗取物促透作用的影响Table 1 Effect of separate and mixed administration on thepermeability of fatty extracts from Tremella auricula
注:与同一时间对照组相比,*表示P<0.05,具有显著性差异,**表示P<0.01,具有极显著差异;表2~表6同。
2.3 灌胃与注射对透过脑组织的伊文氏蓝浓度影响
表2结果可以看出,与对照组相比,注射组静脉注射2 h脑液中伊文氏蓝浓度具有极显著差异(P<0.01),平均值为15.96 μg/g,而灌胃组没有显著差异;给药4 h时,灌胃组具有显著性差异(P<0.05),而注射组则具有极显著性区别(P<0.01),同时注射组浓度比灌胃组浓度高。因此采用注射方式较好。此外对照组、注射组、灌胃组3组在用药4 h时伊文氏蓝的浓度均比2 h时低,表明在2~4 h时小鼠已经开始代谢,因此研究用药时间应控制在0~4 h。
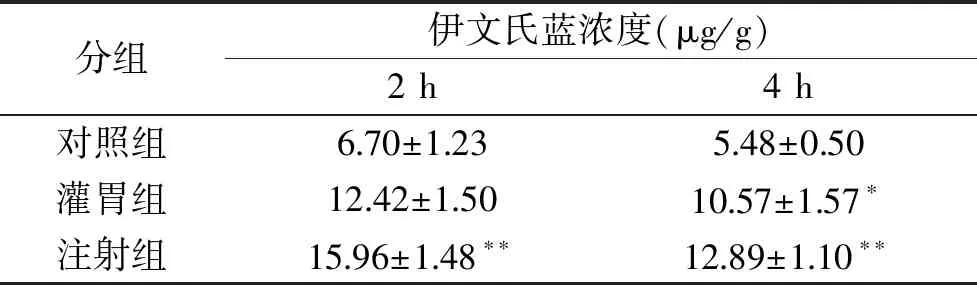
表2 不同给药方式对小鼠脑中伊文氏蓝浓度的影响Table 2 Effects of different administration wayson the concentration of Evans Blue in the brain of mice
2.4 给药剂量及纯度对金耳脂类粗取物促进伊文氏蓝透过各个器官的影响
2.4.1 脑组织中伊文氏蓝浓度的比较结果 表3结果显示,低剂量组、高剂量组在用药后0.25~2 h间,大脑中伊文氏蓝含量均有不同程度的增加,而且随着时间增长而增加。表明伊文氏蓝金耳脂类粗取物进入血脑屏障需要一定的时间,因此脑组织中伊文氏蓝的浓度在0~2 h有增加的趋势,呈时间效应。结果显示,总体脑中伊文氏蓝浓度由大到小顺序为:高剂量组>低剂量组>对照组,其中,高剂量组在每个时间段含量都最高。与对照组相比,高剂量组在1、2、4 h这几个时间段均有极显著差异(P<0.01),0.5 h时具有显著差异(P<0.05);低剂量组在2、4 h具有极显著差异(P<0.01),1 h时具有显著差异(P<0.05)。因此实验结果表明:金耳脂类粗取物可促进伊文氏蓝透过血脑屏障,且高剂量时效果较好。

表3 脑组织中伊文氏蓝的浓度Table 3 Concentrations of Evans Blue in Brain Tissues
2.4.2 肝组织中伊文氏蓝浓度的比较结果 表4结果显示,与对照组相比,在肝组织中,高剂量组在0.5、1、2、4 h这几个时间段均有极显著差异(P<0.01);低剂量组在1、2、4 h具有极显著差异(P<0.01),0.5 h时具有显著差异(P<0.05)。由于伊文氏蓝经静脉注入后,就会迅速遍布体内,聚集在肝、脾等器官,唯独不能进入脑组织。由表4数据可以看出,对照组肝组织中的伊文氏蓝含量在1 h时含量达到最高,而且与2 h相比差别不大,而低剂量组、高剂量组都在2 h时含量急剧下降,尤其高剂量组下降较快。结合脑组织中伊文氏蓝含量数值,可以得出携带伊文氏蓝的金耳脂类粗取物混合物,其金耳脂类粗取物含量越高,结合伊文氏蓝量越大,透过血脑屏障的浓度越大,提高了有效浓度,降低了伊文氏蓝与血浆白蛋白结合,因而在肝内的浓度降低。
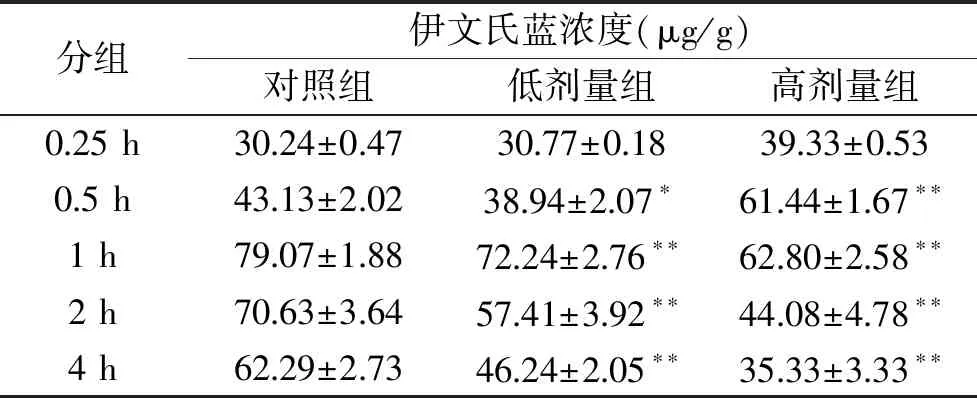
表4 肝组织中伊文氏蓝的浓度Table 4 Concentrations of Evans Blue in Liver Tissues
2.4.3 脾组织中伊文氏蓝浓度结果比较结果 表4结果显示,与对照组相比,在脾组织中,低剂量组、高剂量组在0.25、0.5、1、2、4 h这几个时间段均有极显著差异(P<0.01)。各组在0.25 h时,所测结果均较低,而在1 h时,低剂量组、高剂量组脾组织含量都达到最高,而对照组1 h时浓度最大。由于伊文氏蓝入血后,几乎百分之百地立即与血浆白蛋白结合,形成伊文氏蓝-白蛋白复合物,并持续数小时存在于血液中,所以对照组在每个时间段检测值都较大;而将金耳脂类粗取物与伊文氏蓝混合注射,由于一部分伊文氏蓝结合金耳脂类粗取物透过血脑屏障,因而在1 h后各个实验组脾中伊文氏蓝含量均降低,尤其高剂量组脾中伊文氏蓝含量最低。
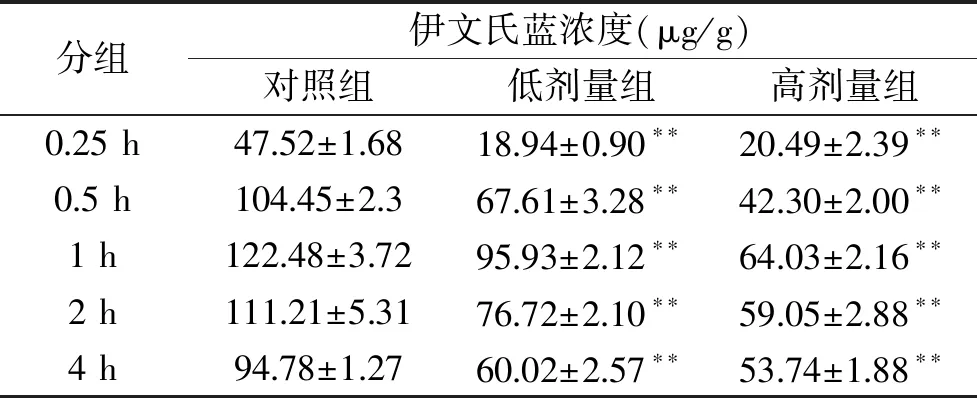
表5 脾组织中伊文氏蓝的浓度Table 5 Concentrations of Evans Blue in Spleen Tissues
2.4.4 脑、肝、脾中伊文氏蓝浓度比较结果 图2~图4结果显示,与低剂量组、高剂量组相比,对照组小鼠脾中伊文氏蓝含量呈增长趋势,且伊文氏蓝在脑组织内的含量4 h内变化不太明显;低剂量组、高剂量组曲线变化趋势大致相同,其中肝、脾组织中伊文氏蓝含量,基本在1 h前呈上升趋势,1 h后呈下降趋势,而脑组织中伊文氏蓝含量则是在2 h时达到最高,其后含量开始降低。结果表明相比较对照组,低剂量组、高剂量组在注射金耳脂类粗取物伊文氏蓝混合物2 h时,药物透过血脑屏障聚集在脑组织内的浓度最大,此时肝、脾中游离的伊文氏蓝相对较少,表明金耳脂类粗取物结合伊文氏蓝具有促进伊文氏蓝透过血脑屏障进入脑组织作用。
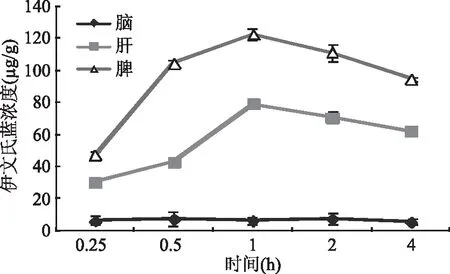
图2 对照组3种器官中伊文氏蓝浓度比较曲线图Fig.2 Comparisons of Evans Blue concentrationin three organs of the control group

表6 脑组织中伊文氏蓝浓度Table 6 Evans Blue concentration in brain tissue
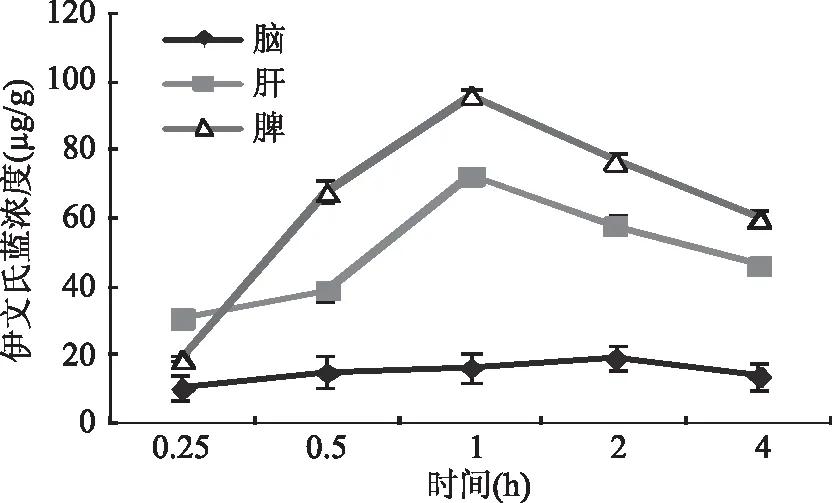
图3 低剂量组3种器官中伊文氏蓝浓度比较曲线图Fig.3 Comparisons of Evans Blue Concentrationin Three Organs of Low Dose Group

图4 高剂量组3种器官中伊文氏蓝浓度比较曲线图Fig.4 Comparisons of Evans Blue concentrationin three organs of high dose group
2.5 冰片与金耳脂类粗取物促进伊文氏蓝透过血脑屏障的对比结果
实验所得结果表6表明,对照组与金耳脂类粗取物组在用药后0.5~2 h间,大脑中伊文氏蓝含量呈增加趋势,但是在4 h时含量降低。而冰片组在1 h时伊文氏蓝浓度最大,且冰片组与对照组相比在用药2 h时具有极显著差异(P<0.01),在用药0.5 h与2 h时具有显著差异(P<0.05);金耳脂类粗取物组则是在用药2 h时达到浓度最大19.31 μg/g,且均大于对照组及冰片组。因此,实验结果表明:冰片在1 h时到达脑内浓度最大,金耳脂类粗取物组在2 h时到达脑内伊文氏蓝浓度最大,且高于冰片组最大浓度18.88 μg/g,表明金耳脂类粗取物组虽然作用时间较冰片组长,但是透过血脑屏障的效果较冰片好。冰片具有芳香开窍作用,可以暂时开放血脑屏障,因而冰片可以短时间内促进伊文氏蓝透过血脑屏障,但是金耳脂类粗取物可以更为持久的促进伊文氏蓝透过血脑屏障,而且增加了伊文氏蓝在脑内的停留时间。
3 结论
经研究结果表明金耳脂类粗取物可以促进伊文氏蓝透过血脑屏障,并且得出选用混合给药方式比分开给药效果好、尾静脉注射比灌胃效果好、尾静脉注射2 h时效果最好、高剂量的金耳脂类粗取物促进伊文氏蓝透过血脑屏障效果好、在用药2 h时金耳脂类粗取物较冰片促进伊文氏蓝透过血脑屏障效果要好。此研究结果对中枢神经系统疾病的治疗研究有一定的意义,因此可以进一步研究金耳作为载体促进临床用药透过血脑屏障发挥作用,也可开发制备功能食品,具有很好的市场应用前景。但是目前尚不清楚发挥作用的金耳脂类成分是什么,因此有待于进一步进行金耳脂类物质的提取分离纯化,以明确发挥作用的成分。

