猪圆环病毒2 型ORF3 蛋白的原核表达及抗体检测ELISA 方法的建立
李鑫鑫,张广芳,吕其壮,张彦明,郭抗抗
(西北农林科技大学动物医学院,陕西 杨凌 712100)
猪圆环病毒2 型(PCV2)是引起断奶仔猪多系统衰竭综合征(PMWS)、猪皮炎与肾病综合征(PDNS)和猪呼吸道综合征(PRBC)多种疾病的主要病原之一[1]。PCV2 会引起猪的免疫抑制、混合感染和继发感染,使养殖户遭受巨大经济损失[2]。近些年来,通过疫苗免疫接种是防控PCV2 相关疾病的有效方法,但还不能完全阻止病毒的感染[3],因此,阐明PCV2 致病机理对本病的防控具有重要的指导作用。
研究表明,PCV2 在感染细胞中可以促进细胞的凋亡,软件预测其存在11 个开放阅读框(Open reading frame,ORF),理论上可以编码11 个产物。其中,ORF3 编码产物可以诱导宿主细胞的凋亡,这种作用可能有利于病毒在动物体内的增值,在PCV2 感染和致病中发挥重要作用[4-6]。
目前,临床常用的检测PCV2 抗体的方法仍是ELISA,此方法操作简单、快速,易于标准化,适合临床上检测大量样品[5]。因此,本试验制备ORF3 蛋白抗体,并建立了基于ORF3 蛋白的PCV2 抗体检测间接ELISA 方法,为ORF3 抗体检测和鉴定提供了方法,也可以用于PCV2 感染和疫苗免疫猪抗体的检测。
1 材料与方法
1.1 毒株、菌株、抗体与主要试剂 PCV2 杨凌分离株由西北农林科技大学动物医学院兽医公共卫生学实验室(本实验室)分离保存;TaqDNA 聚合酶、IPTG,购自生工生物工程(上海)股份有限公司;DNA 胶回收试剂盒、PCR 试剂盒,购自天根生化科技(北京)有限公司;原核表达载体pGEX-6p-1、大肠埃希菌(E.coli)DH5α 和BL21 感受态细胞、T4 DNA 连接酶、DNA Marker DL-5 000 和蛋白Marker,均为宝生物工程有限公司(TakaRa 大连)产品;GST 标签抗体和羊抗鼠二抗,购自上海三箭生物技术有限公司;辣根过氧化物酶标记羊抗猪血清系晶彩生物科技公司产品;猪圆环病毒ELISA 检测试剂盒为上海谷研实业有限公司产品;所用阴阳性血清均由西北农林科技大学动物医学院畜禽疫病防控与兽医公共卫生实验室保存;猪瘟病毒(CSFV)、伪狂犬病病毒(PRV)、猪繁殖与呼吸综合征病毒(PRRSV)阳性血清,均由本实验室鉴定并提供。
1.2 引物设计与基因克隆 由PCV2 杨凌分离株全基因测序结果、GenBank 中PCV2 ORF3 序列设计特异性引物,其序列如下:
FP:5′-GCGAATTCATGGTAACCATCCCACCACTTG-3′
RP:5′-GCGAATTCATGGTAACCATCCCACCACTTG-3′。
PCR 条件为:95 ℃5 min;94 ℃30 s,60 ℃30 s,72 ℃30 s,共35 个循环;72 ℃10 min。PCR 产物用12 g/L 琼脂糖凝胶电泳并纯化回收。
1.3 重组质粒pGEX-6p-ORF3 的构建 纯化回收的PCR 产物和pGEX-6p-1 空载体连接以构建重组质粒,转入E.coliDH5α,筛选阳性菌落扩大培养后提取质粒。提取的质粒进行双酶切后送北京六合华大基因科技有限公司测序分析,测序正确的重组质粒命名为pGEX-6p-ORF3。
1.4 重组质粒的诱导表达和蛋白纯化 重组质粒与空质粒共同导入BL21 感受态菌株中,筛选得到阳性菌落并扩大培养后加入IPTG,对不同诱导时间的菌体蛋白进行SDS-PAGE 鉴定以确定最适表达时间。
将得到的菌体蛋白用切胶法进行纯化,纯化目的蛋白的样品进行Western Blot 鉴定,确定是否得到重组ORF3 蛋白。
1.5 猪圆环病毒2 型抗体检测间接ELISA 方法的建立
1.5.1 ORF3 蛋白包被浓度与血清稀释度的确定 采用棋盘滴定的方法,将已纯化的重组蛋白抗原用0.06 mol/L CBS 包被液按照1 μg/mL、2 μg/mL、4 μg/mL、8 μg/mL 梯度稀释包被酶标板。酶标板4 ℃过夜后加入按照1∶40、1∶80、1∶160、1∶320稀释的PCV2 阴阳性血清作为一抗孵育、辣根过氧化物酶标记羊抗猪血清作为二抗孵育,进行ELISA。比较血清OD450值,确定重组抗原最佳包被浓度与血清稀释度。
1.5.2 封闭液的选择 以重组蛋白抗原最佳包被浓度包被酶标板并分成两组,一组加入10% PBS 的PBST,另一组加入25 g/L 脱脂奶粉的PBST。酶标板37 ℃封闭1h 后加入最佳稀释度的阴阳性血清作为一抗,孵育洗涤后加入酶标二抗进行ELISA。重复两次后比较阴阳性血清OD450值及P/N 值,确定最佳封闭液。
1.5.3 血清最佳反应时间的确定 以抗原最佳包被浓度与抗原最佳包被条件,加入最佳封闭液和一抗阴阳性血清,37 ℃条件下分别反应0.5 h、1 h、1.5 h,洗涤后加入酶标二抗进行ELISA,最后比较阴阳性血清OD450值及P/N 值,确定一抗血清最佳反应时间。
1.5.4 显色时间的确定 按如上已确定的反应条件,加入底物后分别显色5 min、10 min、15 min。比较阴阳性血清OD450值及P/N 值,最终确定最佳显色时间。
1.5.5 间接ELISA 阴阳性临界值的确定 将30 份经检测为PCV2 核酸和抗体阴性的猪血清用建立的间接ELISA 方法进行检测,重复2 次,计算30 份血清OD450值的平均值和标准方差(SD),根据公式:临界值=X+3SD,计算出阴阳性血清的临界值。根据统计学规则,当血清OD450>临界值时,可判定为阳性。
1.5.6 特异性试验 用建立的包被ORF3 蛋白的检测PCV2 抗体的间接ELISA 方法分别检测CSFV、PRV、JEV、PRRSV 的阳性血清,同时设PCV2 抗体阳性、阴性对照,判断方法的特异性。
1.5.7 临床血清样品检测 对猪场收集的80 份血清,用建立的方法进行PCV2 抗体检测,同时用商品化试剂盒进行对照检测,对检测结果进行比较。
2 结果
2.1 猪圆环病毒2 型ORF3 蛋白的原核表达与纯化
2.1.1 目的基因的扩增 PCR 结果显示,扩增出的片段大小在300 bp 左右(图1),符合预期。对目的产物进行纯化回收后,序列测定表明片段大小为
315 bp,未发现突变、缺失现象。

图1 ORF3 基因的PCR 扩增
2.1.2 重组质粒的鉴定与表达 重组质粒pGEX-6p-ORF3 测序结果显示,插入的ORF3 基因完全正确,未出现碱基变化,可用于进一步的产物表达。IPTG 诱导表达确定最适时间后SDS-PAGE 电泳结果显示,重组ORF3 蛋白大小为37 kDa,在37 ℃,225 r/min,IPTG 1.0 mmol/L 诱导5 h 时表达量最大(图2)。

图2 重组质粒表达产物的SDS-PAGE 分析
2.1.3 GST-ORF3 重组蛋白纯化的鉴定 纯化回收的重组蛋白经SDA-PAGE 电泳,可见到在37 kDa 左右处出现单一的条带(图3);Western Blot 分析,出现2 条特异性条带,大小分别为26 kDa 和37 kDa(图4),纯化蛋白大于空载体。表明ORF3 基因得到了表达,经切胶法得到了纯化蛋白,测定纯化蛋白的浓度为10.08 μg/mL。
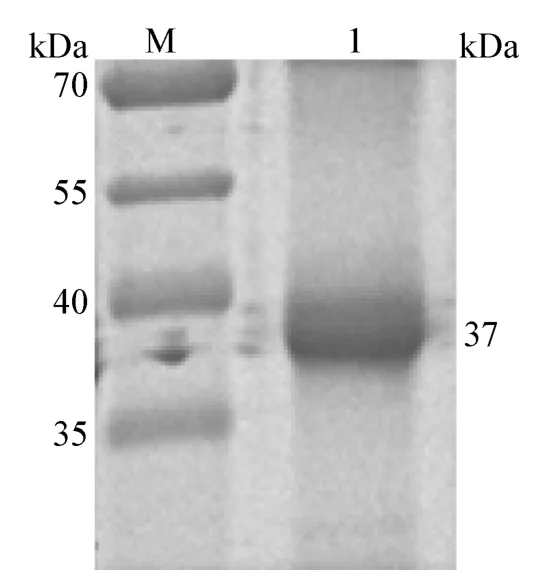
图3 GST-ORF3 蛋白纯化的SDS-PAGE 分析
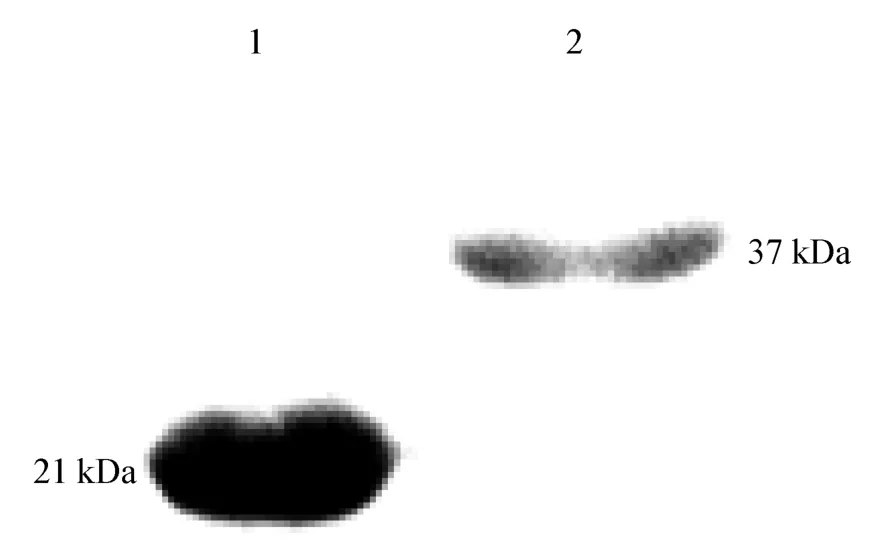
图4 Western Bolt 对纯化的GST-ORF3 蛋白的检验
2.2 猪圆环病毒2 型抗体间接ELISA 方法的建立与应用
2.2.1 抗原最佳包被浓度和血清稀释度的确定采用棋盘滴定的方法,将已纯化的重组蛋白抗原梯度稀释,4 ℃包被过夜,加入按照1∶40、1∶80、1∶160、1∶320 稀释的阴阳性血清进行ELISA。比较不同包被液浓度和不同血清稀释度下OD450值(表1),可知抗原的最佳包被浓度为2 μg/mL,血清的最佳稀释度为1∶160。
2.2.2 封闭液的选择 分别用10% PBS 的PBST、25 g/L 脱脂奶粉的PBST 2 种封闭液对已用抗原包被的酶标板进行封闭,加入最佳稀释度的阴阳性血清,进行ELISA 且重复2 次。比较阴阳性血清OD450值及P/N 值(表2),确定最佳封闭液为10%PBS 的PBST。
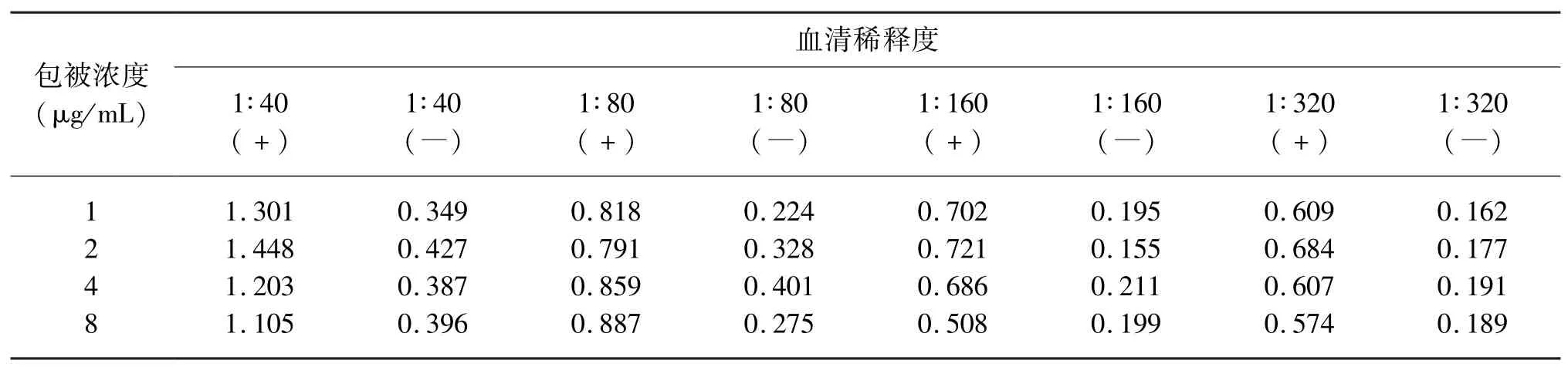
表1 重组ORF3 蛋白抗原最佳包被浓度和血清稀释度的确定

表2 封闭液的确定
2.2.3 血清最佳反应时间的确定 以抗原最佳包被浓度与抗原最佳包被条件,加入封闭液和一抗血清,进行ELISA 且重复2 次。比较阴阳性血清OD450值及P/N 值(表3),确定一抗血清最佳反应时间为1 h。
2.2.4 显色时间的确定 按已确定的反应条件,加入底物后,分别显色5 min、10 min、15 min,重复2次。比较阴阳性血清OD450值及P/N 值(表4),确定最佳显色时间为15 min。
2.2.5 间接ELISA 阴阳性临界值的确定 将30份经检测为PCV2 核酸和抗体阴性的猪血清用已建立的间接ELISA 方法进行检测,结果见表5。计算得到30 份阴性血清的OD450平均值为0.239,标准差(SD)为0.063,临界值为0.428。因此,当待检血清的OD450值>0.43 时,可判为阳性;若待检血清的OD450值<0.43,则判为阴性。

表3 血清最佳反应时间的确定
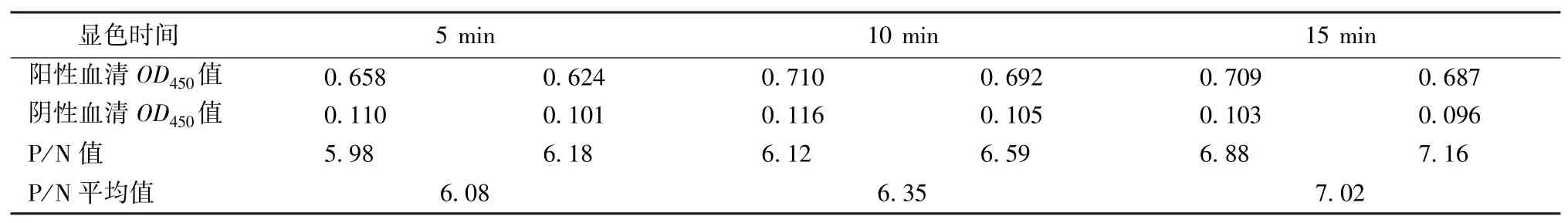
表4 最佳显色时间的确定
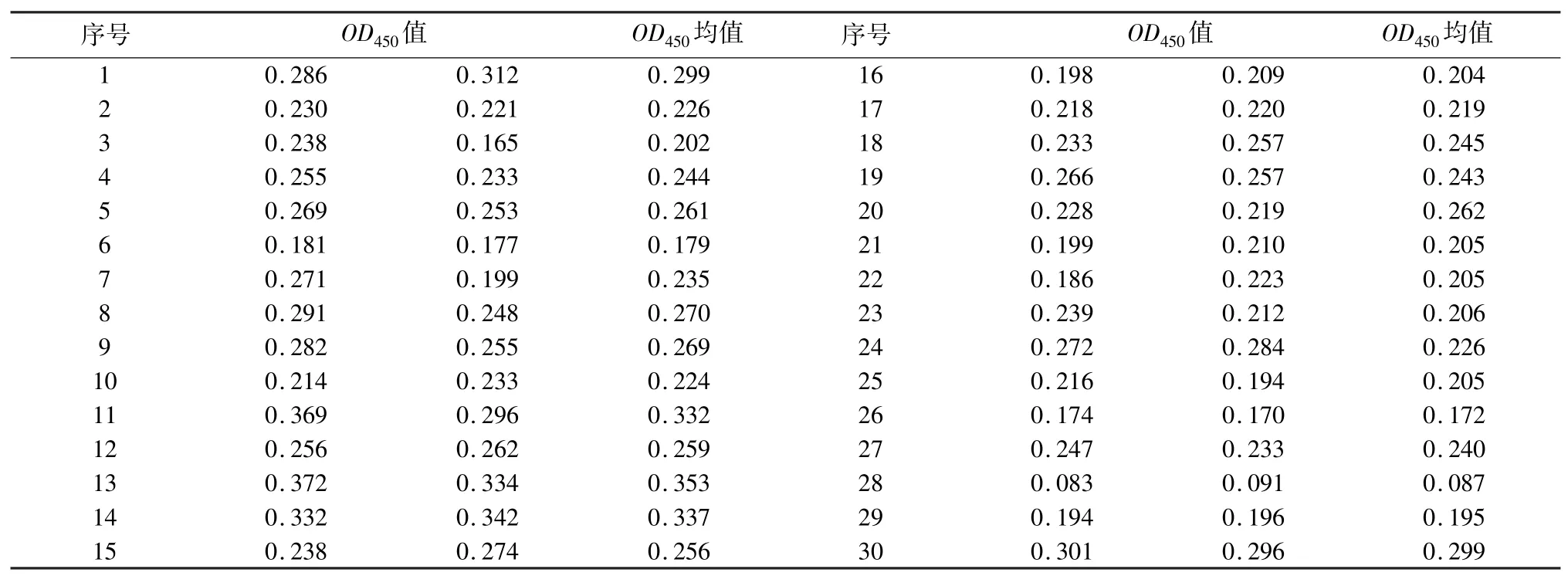
表5 间接ELISA 阴阳性临界值的确定
2.2.6 特异性试验结果 用建立的间接ELISA 方法分别检测CSFV、PRV、JEV、PRRSV 的阳性血清,同时设阳性、阴性对照,结果(表6)均为阴性,表明该ELISA 方法具有高度的特异性。

表6 间接ELISA 方法的特异性试验
2.2.7 临床血清样品检测结果 用建立的间接ELISA 方法对临床80 份血清样品进行检测,同时和购买的商品化试剂盒进行比较。结果显示,本研究建立的ELISA 方法检出阳性样品48 份,商品化试剂盒检出阳性样品45 份,两种方法阳性符合率为93%。
3 讨论
目前,基于PCV2 分离株的序列比较可知其大致分为5 个基因型:PCV2a、PCV2b、PCV2c、PCV2d和PCV2e[6],已报道与猪群中许多疾病的发生有显著关系,并与PMWS 有直接关联[7]。PCV2 感染后会引起机体的细胞凋亡,病毒通过刺激细胞凋亡可躲避宿主免疫系统或诱导宿主感染细胞死亡,从而加快病毒粒子向周围细胞的扩散,促进病毒的增殖[8]。PCV2 ORF3 为非结构性蛋白,牵涉诱导受感染细胞的凋亡,被认为与PCV2 的发病机制和全身性扩散密切相关。华丽等[9]利用生物信息学软件发现ORF3 成熟蛋白有4 个主要的抗原位点。Stevenson[10]等证明ORF3(31aa~50aa)编码的多肽可以诱导T 淋巴细胞的增殖能力。研究还发现,PCV2 ORF3蛋白可以引起免疫小鼠血清中IL-4 浓度显著升高,表明ORF3 蛋白在PCV2 诱发的体液免疫中发挥一定的作用[11]。PCV2 抗体检测的方法有多种,其中ELISA 检测与常用的免疫过氧化物酶单层细胞试验、免疫组织化学技术和间接免疫荧光试验相比,其操作更加简便、敏感性好,能够快速检测大量样品[12]。
本研究构建ORF3 重组蛋白,并使用重组蛋白作为包被抗原建立抗体检测的间接ELISA 方法。经验证,所建立的ELISA 方法的特异性以及与商品化试剂盒检测结果的阳性符合率均较高。综合李鹏飞[13]使用ORF2 蛋白作为包被抗原所建立的检测猪圆环病毒抗体的间接ELISA 方法,本研究用的重组蛋白包含了PCV2 特异性的抗原位点,能够区分PCV1 和PCV2;两种抗体检测试剂盒均能将PCV2 与CSFV、PRRSV、PRV 进行区分,在实际应用中具有较大意义。
综上,本试验为进一步研究PCV2 ORF3 蛋白提供了思路,建立的间接ELISA 方法可以用于检测单克隆抗体效价、疫苗免疫动物后免疫效果的监测,为其他研究人员检测PCV2 抗体提供了方法。进一步研究会将得到的重组蛋白用于兔子和小鼠的免疫,并利用建立的检测方法对免疫后抗体效价进行测定,为PCV2 疫苗的研发、疾病的防控提供基础。
——一道江苏高考题的奥秘解读和拓展

